胸腺瘤PDC 模型的建立及化疗药物筛选
2022-08-16敖永强丁建勇蒋家好
敖永强 高 健 王 帅 丁建勇 蒋家好
(复旦大学附属中山医院胸外科 上海 200032)
胸腺上皮肿瘤约占成人前纵隔肿瘤的50%[1],大多数可通过手术联合辅助放疗治愈,但仍有约30%的患者患为晚期或复发性肿瘤,需要进行化疗[2]。60%的患者采用顺铂为主的治疗方案,而基于非铂的方案包括奥曲肽-泼尼松和卡培他滨-吉西他滨等[3]。目前还有免疫治疗如抗PD-L1 抗体以及免疫治疗结合放疗[4],但治疗相关的自身免疫不良事件较多,临床获益仍有待评估[5]。目前胸腺瘤或胸腺癌的一线化疗方案是顺铂-蒽环类药物或顺铂-依托泊苷组合[3]。临床证据显示胸腺瘤对化疗不敏感,尽管对多种化疗药物有反应,但是很少有完全缓解的患者[2],且不良反应较多。不论是诱导还是联合化疗,对胸腺瘤治疗的获益尚不确定[6-7],临床上化疗方案的多样性和胸腺瘤的异质性也给医师指导个体化用药带来挑战。为减少化疗不良反应,同时提高反应率,需要更多的研究来提高胸腺瘤患者化疗的临床获益。近年来人源肿瘤异种移植物(patient-derived tumor xenograft,PDX)及人源肿瘤细胞(patient-derived tumor cell,PDC)在转化肿瘤研究和肿瘤化疗药物筛选中具有重要地位[8-10]。
PDX 模型很好地概括了肿瘤的异质性,并且保留了肿瘤的分子、遗传以及组织学特性[11],而PDC模型也可反映患者的肿瘤特征和临床反应[12],相比传统的肿瘤细胞系可以更好地模拟人体肿瘤,对开展肿瘤学研究具有重要意义。基于PDX 和PDC 模型,我们不仅可以通过体外药物反应预测体内药物活性,还能作为发现血清学肿瘤标志物的平台[13],对指导临床用药,发现新的肿瘤标记物具有重要作用。尽管PDX 模型在人类癌症建模方面具有很高的保真度,但高昂的时间和经济成本阻碍了其成为大规模筛选治疗药物的理想平台[14]。且PDX 模型的建立需要免疫缺陷的小鼠,不仅成功率较低,小鼠和人的免疫微环境也有较大差别。相比之下,PDC 模型建立的成功率更高,也更易于开展研究,可以极大地增加化疗药物筛选的数量、剂量,从而生成可靠的反应参数。目前基于PDX 和PDC 模型的化疗药物筛选研究已经被运用于卵巢癌、胰腺癌、肝癌、肾癌、食管癌、乳腺癌、肺癌、鼻咽癌、黑色素瘤、脑胶质瘤等恶性肿瘤中,并有一定的临床获益[15-27]。然而,尚无关于胸腺瘤PDX 或PDC 模型的报导。胸腺瘤发病率较低,且病理组织和实验模型缺乏,因此基础研究较少,其分子和遗传特点以及化疗药物敏感性等尚不明确[27]。胸腺瘤恶性程度较低,肿瘤细胞生长缓慢,原代细胞培养较为困难,因此建立PDX 或PDC 模型有很大难度。
本研究首次成功建立了8 例胸腺瘤的PDC 模型,并对7 种临床上常见的化疗药物方案进行肿瘤细胞杀伤试验,筛选出对胸腺瘤细胞杀伤力较强的化疗药物方案,以指导临床实践。
资料和方法
一般病例资料选取2019 年7—12 月在复旦大学附属中山医院胸外科进行手术切除或胸腔镜活检的胸腺瘤患者,于手术时留取部分新鲜肿瘤组织用于制作PDC 模型。在成功建立PDC 模型的8 例胸腺瘤患者中,有7 例进行了全胸腺切除术,1 例进行了胸腔镜活检术。本研究通过复旦大学附属中山医院伦理委员会审核批准(批准号:B2021-781R),所有患者均签署了知情同意书。
PDC 模型的建立手术组织样本收集后置于4 ℃的PBS 中(添加10 mmol/L HEPES 和100 U/mL P/S 双抗),及时进行以下操作:第一步,将组织用PBS 至少清洗5 次,并尽可能去除样本中坏死区域和脂肪组织;第二步,将组织剪切成小块后用组织消化液37 ℃消化1 h,在消化过程中每15 min 用枪头吸吹;第三步,消化结束后用40 μm 的滤网过滤收集细胞悬液;第四步,在4 ℃下300×g离心10 min收集细胞,细胞沉淀用PTC 培养基重悬;第五步,将细胞以1×105/cm2的密度铺于低吸附板中,置于细胞培养箱(37 ℃,5% CO2)进行培养,每隔2~3 天换液。
结 果
临床病理资料分析本次研究共纳入19 例胸腺肿瘤患者,成功建立PDC 模型的有8 例(表1),年龄37~67 岁,平 均 年 龄57 岁,男 女 各4 人。按 照WHO 的分型标准[28],包括1 例A 型胸腺瘤,3 例AB型胸腺瘤,3 例B2 型胸腺瘤和1 例胸腺癌。根据Masaoka 等[29]的 分期标准,有3 例为Ⅱ期,3 例为Ⅲ期,2 例为Ⅳa 期。2 例患者合并重症肌无力(myasthenia gravis,MG),分别为眼肌型(ocular)和全身型(systemic),其余6 例患者无自身免疫性疾病。5 例患者行剑突下切口电视辅助胸腔镜(video assisted thoracic surgery,VATS)手术,完整切除肿块,2 例为胸骨正中劈开切口。1 例不具备手术条件,术前CT 引导穿刺也未能明确病理,于是行胸腔镜纵隔肿块活检术并取得肿瘤组织。术后2 例患者行辅助放疗,方案分别为Dt 5000 cGy/20 次(10 周)以及Dt 5000 cGy/12 次(4 周),化疗期间无明显不适主诉;未能手术治疗的病例则依据药敏测试结果进行化疗,方案为吉西他滨联合顺铂C1D1-C3D8 累计8 周,化疗期间患者前后出现皮疹、骨髓抑制等不良反应,逐渐缓解。全身型MG 患者术后口服溴比斯的明行维持治疗,眼肌型MG 患者术后肌无力症状明显缓解;其他患者术后均恢复良好,对症支持治疗,未行其他辅助治疗,所有患者均常规随访。

表1 PDC 模型的病例资料Tab 1 Case data of PDC models
PDC 模型建立和药敏测试
建立胸腺瘤PDC 模型 手术获取的胸腺瘤组织块在冰盒中运输,于离体24 h 内解离,分离其中的活细胞进行体外培养。经过5~9 天扩增,形成典型的肿瘤细胞克隆(图1),直径30~300 μm,细胞状态良好,可以用于体外药敏实验。对8 例培养成功的胸腺瘤病例,鉴定细胞的活力及生长状态,排除了细菌、真菌、支原体等的污染。
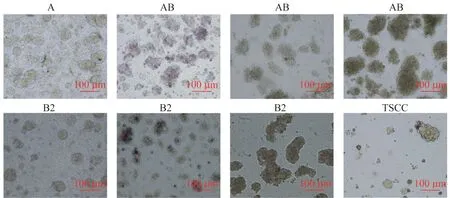
图1 8 例胸腺瘤PDC 模型Fig 1 8 cases of thymoma PDC models
PDC 模型药敏测试 根据美国国家综合癌症网络(NCCN)和中国抗癌协会临床肿瘤学协作专业委员会(CSCO)诊疗指南[30]中胸腺瘤的药物治疗方案,对8 例建立成功的PDC 模型进行药敏测试。把肿瘤细胞杀伤效率分为5 个等级,对药物杀伤效果和效率都做了详细定义(表2)。其中,肿瘤细胞数杀伤>70%的药物组合为强杀伤,在药物作用下,多数肿瘤细胞团瓦解凋亡或者体积明显变小,但仍然可见少量耐药肿瘤细胞团的留存。肿瘤细胞数杀伤<10%,甚至造成持续增殖的药物组合定义为耐药或强烈耐药。测试的药物组合类型一共有7种,都是以顺铂为基础的标准治疗方案,每种治疗方案分别应用于8 例胸腺瘤PDC 模型进行药敏测试。由于操作原因,Vinorelbine+Cisplatin 方案和Epirubicin+Cisplatin 方案中进行药敏测试的胸腺瘤PDC 模型数量分别为7 例及6 例(表3)。同时对每个模型设置了3 个不加药物的对照组,培养7 天后检测培养基中肿瘤细胞的数量和活力。

表2 胸腺瘤细胞杀伤结果Tab 2 Killing ability of thymoma cells
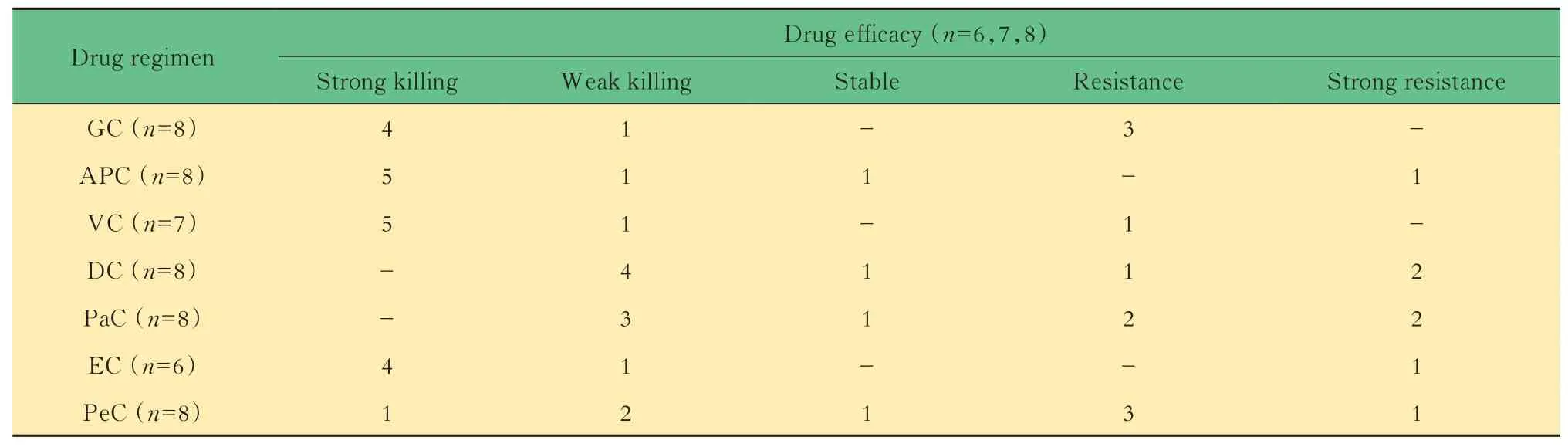
表3 不同药物方案对胸腺瘤细胞的杀伤情况Tab 3 Killing of thymoma cells by different drug regimens
肿瘤细胞杀伤效果 试验结束后,我们对比药物组和对照组肿瘤细胞的生长情况,得到强杀伤、弱杀伤以及耐药的对照(图2)。强杀伤的药物组合显著抑制了肿瘤细胞的生长,仅残留少量肿瘤细胞克隆,残留的肿瘤细胞内可能存在对该药物组合的耐药基因。弱杀伤的药物组合明显抑制肿瘤细胞的生长,但仍留存较多细胞克隆。耐药的药物组合中肿瘤细胞不仅没有减少,反而持续增殖。

图2 化疗药物对胸腺瘤细胞的杀伤效果Fig 2 Killing effect of thymoma cells on chemotherapy
肿瘤细胞杀伤效率 不同的药物组合方案对胸腺瘤细胞的杀伤效果不同(表2),其中白蛋白紫杉醇、长春瑞滨或表柔比星联合顺铂方案对胸腺瘤细胞的杀伤有效率较高,分别为6/8、6/7 和5/6,且耐药率较低,分别为2/8、1/7 和1/6;而多西他赛、紫杉醇、吉西他滨或培美曲塞联合顺铂方案对胸腺瘤细胞的杀伤有效率较低,分别为4/8、3/8、5/8 和3/8,且 耐 药 率 较 高,分 别 为4/8、5/8、3/8 和5/8(图3)。
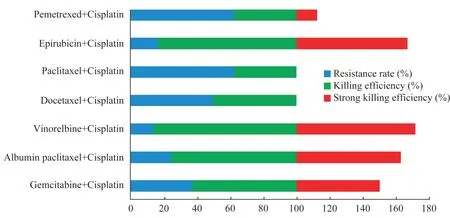
图3 不同药物方案对胸腺瘤细胞的杀伤有效率Fig 3 Killing effectiveness of different drug regimens to thymoma cells
基于PDC 的胸腺瘤化疗方案推荐我们分析了不同药物组合对胸腺瘤细胞的杀伤有效率(图3),强杀伤有效率和杀伤有效率均较高的是白蛋白紫杉醇、长春瑞滨或表柔比星联合顺铂方案,耐药率较高的是多西他赛、紫杉醇、吉西他滨或培美曲塞联合顺铂方案。因此,基于该PDC 模型结果,我们推荐胸腺瘤化疗采用白蛋白紫杉醇、长春瑞滨或表柔比星联合顺铂方案。之前的研究也指出,尽管胸腺瘤的化疗尚无共识,但顺铂+蒽环类药物(如表柔比星)是一线化疗方案,其次是顺铂+依托泊苷,而顺铂+白蛋白紫杉醇常用于复发性胸腺瘤的治疗[3,31]。
胸腺瘤PDC 模型的临床指导意义我们对1例不可切除且穿刺活检诊断困难的胸腺肿瘤患者进行了胸腔镜活检术,活检结果为A 型胸腺瘤,Masaoka Ⅳa 期,我们于术中留取部分活检组织用于建立PDC 模型。通过筛选NCCN 等指南推荐的不同胸腺瘤化疗方案,该患者PDC 模型的药敏测试结果(表4)显示吉西他滨联合顺铂方案具有强杀伤作用,而白蛋白紫杉醇、长春瑞滨或表柔比星联合顺铂方案的杀伤效果有限。已经有回顾性研究证实,对晚期胸腺瘤的化疗使用吉西他滨联合顺铂的方案是有效的[32]。因此我们对该患者进行吉西他滨联合顺铂化疗,化疗后胸腺瘤较前明显缩小(图4)。结果初步证实胸腺瘤PDC 模型可以用于模拟胸腺瘤化疗药物敏感测试和筛选,并用于指导胸腺瘤化疗药物的使用。对于需要化疗的患者,可以通过活检获取肿瘤细胞建立PDC 模型,筛选出敏感化疗药物,降低肿瘤负荷或分期,增加手术可能性。
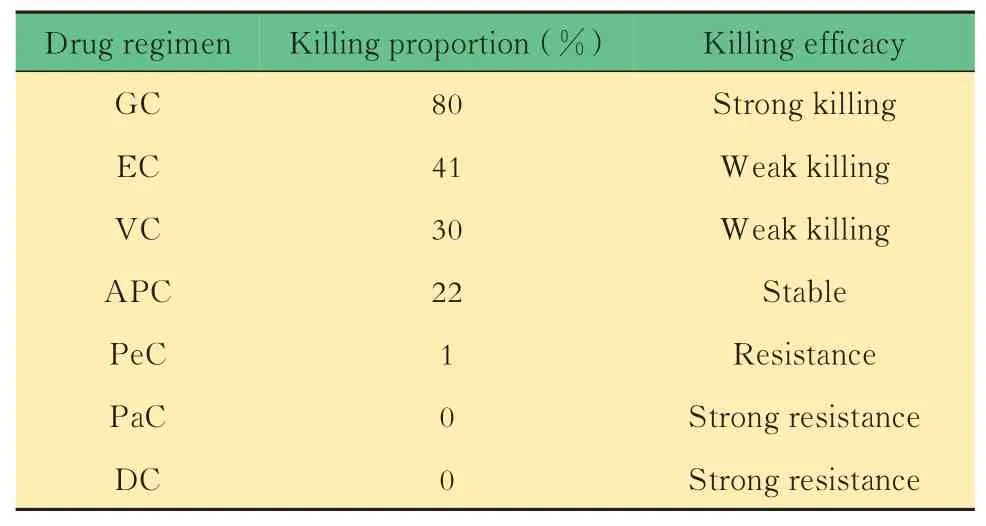
表4 不同方案药敏测试结果Tab 4 Susceptibility test results of different drug regimens
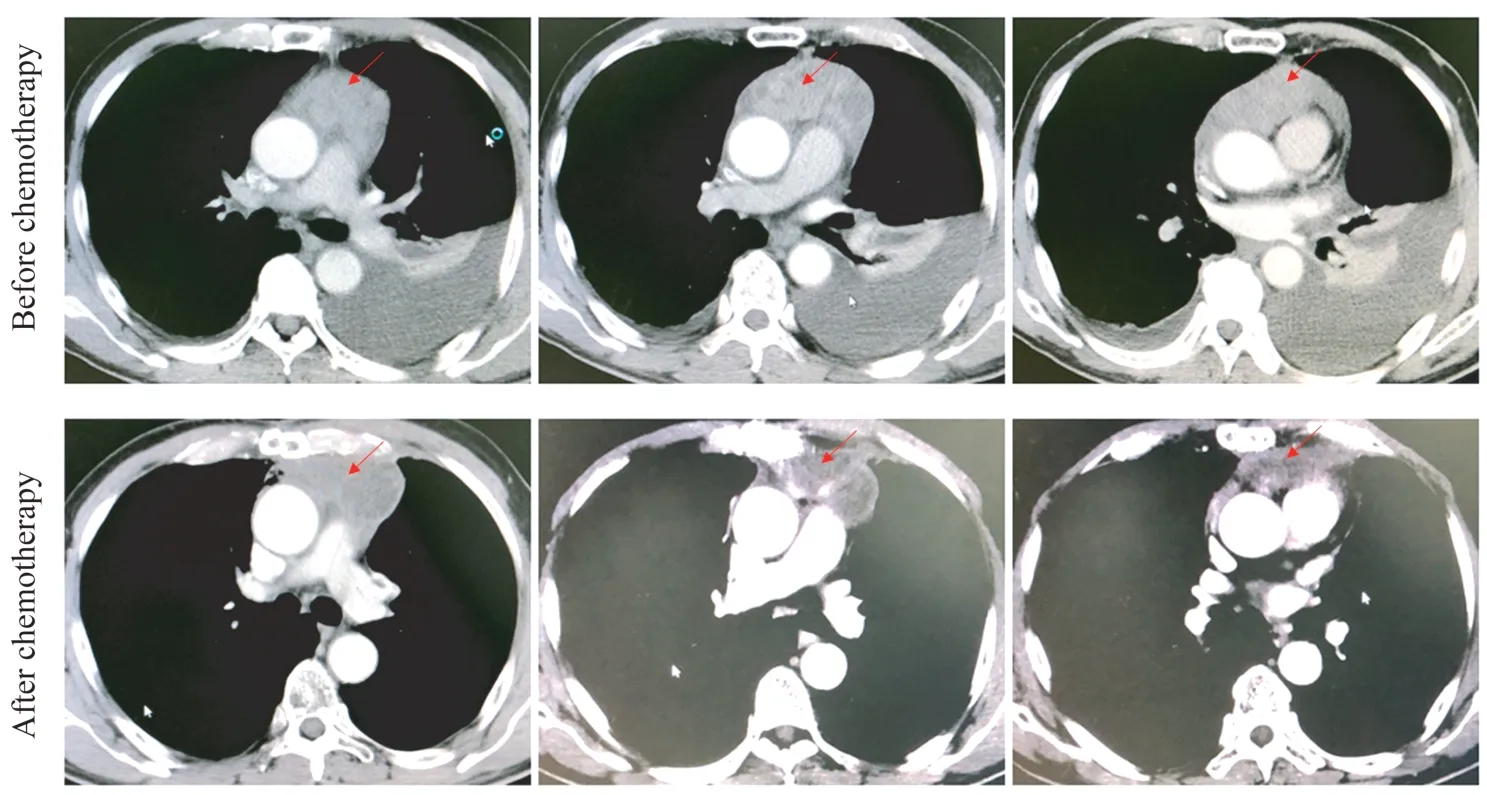
图4 基于胸腺瘤PDC 模型的化疗药物临床验证Fig 4 Clinical validation of chemotherapy drugs based on thymoma PDC model
讨 论
我们成功建立了胸腺瘤的PDC 模型,旨在模拟体内胸腺瘤化疗药物的肿瘤细胞杀伤力,通过药敏测试筛选出杀伤力最强的化疗药物组合方案,以指导临床实践中胸腺瘤化疗药物的使用。既往的研究显示,PDX 或PDC 模型已成功在多种恶性肿瘤中成功建立,并且用于模拟体内化疗药物活性和化疗药物筛选,极大地促进了肿瘤化疗药物运用的发展[33]。在肾癌中,研究者基于肾癌PDC 模型证实了该模型在组织学特点、生物标志物表达、肿瘤突变驱动基因拷贝数等和原始肿瘤的一致性[19]。而在非小细胞肺癌和食管癌PDC 模型中,研究者筛选出特定克服耐药的化疗药物组合方案,极大提高了 患 者 的 治 疗 效 果[20,23]。这 些 成 果 预 示 着 肿 瘤PDC 模型在模拟体内肿瘤生物学特点包括药物敏感性方面有很大的应用价值,对筛选肿瘤治疗药物和发现新的生物学标记物具有重要意义。本次成功建立PDC 模型的胸腺瘤病例都已经侵犯包膜以及纵隔脂肪组织,分期较晚,具有较强的侵袭性。与之相对应,未能成功建立PDC 模型的胸腺瘤标本中,有8 例Ⅰ期,2 例Ⅱ期和1 例Ⅲ期。提示分期越晚,肿瘤侵袭性越强,建立PDC 模型的成功率可能越高。
目前胸腺瘤尚无特别有效的化疗药物,种类多样的化疗方案,胸腺瘤的高度异质性,以及基础研究的缺乏给临床医师选择合适的化疗方案带来挑战。建立胸腺瘤的PDC 模型进行化疗药物筛选将有助于化疗方案的针对性选择,提高化疗有效率和患者的临床预后。根据本研究中建立的胸腺瘤PDC 模型,我们筛选了目前常用的胸腺瘤化疗药物方案,发现白蛋白紫杉醇、长春瑞滨或表柔比星联合顺铂方案对大多数胸腺瘤细胞具有较强的杀伤作用,可以优先选择。然而,在该例A 型胸腺瘤PDC 模型中,尽管推荐方案显示一定杀伤力,但吉西他滨联合顺铂有更明显的疗效。为了避免无效治疗,我们选择后者进行化疗,并取得显著效果。尽管如此,仅仅根据PDC 模型来选择化疗方案显然过于片面,临床实践中,还必须结合患者本身的情况,以及各个药物方案的副作用等综合选择。由于胸腺瘤的异质性,同一方案对于不同亚型的胸腺瘤可能疗效不一。本研究推荐的方案是所有病例中有效率最高的方案,但在该例无法手术的患者中却有不同,因此实际用药的选择还需要参考具体的PDC 模型。
尽管PDC 模型可以很好地模拟肿瘤在体内的生物学行为,肿瘤细胞可以无限生长并且可以通过高通量筛选以积累大量实验数据[11],但是也存在一些局限性。例如,离体的肿瘤细胞会选择性增殖,不断适应培养条件[34],导致对肿瘤异质性的反应不如PDX 模型;同时缺乏体内肿瘤微环境和宿主免疫特点等[35],模型的建立也比较困难,成功率较低。目前尚缺乏大规模研究以确定多种癌症类型药理学和基因组学之间的联系。Lee 等[12]通过高通量测序证实了多种肿瘤组织和相应的PDC 模型间的转录组相似性;Yin 等[36]通过对21 例PDC 模型进行全转录组测序,也指出PDC 模型中微肿瘤团和刚离体活体组织在分子特征、测序序列、免疫marker 等指标上保持高度一致性。因此,基于PDC 模型的研究能在一定程度上模拟体内肿瘤,为临床实践提供参考依据。
然而,本研究也存在一些不足之处。首先,未对胸腺瘤细胞增殖传代过程中的进化和基因突变进行检测。尽管有前人在其他肿瘤类型上的验证,我们尚不能肯定胸腺瘤PDC 模型可以准确地反映体内肿瘤的情况。此外,本次实验的样本量较小,且考虑到胸腺瘤亚型的多样性,最终筛选出的化疗方案可靠性有待更大样本量的研究去进一步验证。第三,尽管我们收治来自全国各地的患者,但仍然是一个单中心研究,多中心的合作将有助于提高研究结论的普适性和可靠性。第四,我们根据所筛选的化疗方案对该例无法手术的患者进行验证并得到满意的结果,但仅一例患者的获益不具有代表性,仍需要更大规模的临床验证支持。后期本团队会纳入更多需要化疗的胸腺瘤患者进行该项研究,以期获得更加令人更信服的数据。为了进一步提高PDC 模型和体内肿瘤微环境的一致性,在确保PDC 模型建立成功的前提下,进一步改进培养条件也将是本团队重点关注的内容,例如添加胸腺瘤微环境中高表达的细胞因子及含量丰富的基质细胞、免疫细胞等[37]。
总之,本研究成功建立了胸腺瘤的PDC 模型,并且在合适的条件下进行了化疗药物敏感测试。根据测试结果,胸腺瘤化疗推荐使用白蛋白紫杉醇、长春瑞滨或表柔比星联合顺铂方案。临床实践中,还必须结合患者自身情况,以及各个药物方案的不良反应等综合选择。不同亚型的胸腺瘤可能有不同的最佳化疗方案,本研究受PDC 模型数量的限制,提供了初步的探索信息,更大样本量的研究将为准确的临床用药提供指导。
作者贡献声明敖永强 数据整理分析,图表绘制,文献调研整理,论文撰写和修改。高健 研究构思设计,论文修改。王帅,丁建勇 研究构思设计。蒋家好 研究构思设计,图表绘制,论文修改。
利益冲突声明所有作者均声明不存在利益冲突。
