下调miR-221诱导胃癌细胞凋亡的机制及其化疗敏感性研究
2022-08-16杨向超田由京海南医学院第一附属医院普通外科海南海口570102
杨向超,田由京,陈 禺,李 合 (海南医学院第一附属医院普通外科,海南 海口 570102)
胃癌属于消化道肿瘤,在全球范围内具有较高的发病率和病死率[1]。手术切除是早期胃癌最有效的治疗方法,然而,由于缺乏精确的早期诊断标准,大部分患者诊断时已处于癌症晚期[2-3]。在晚期胃癌的治疗过程中,化疗药物耐药性的产生导致患者预后差,病死率高[4]。越来越多的研究表明,参与介导肿瘤细胞耐药性发生的机制复杂,因此,探究早期诊断的特异性生物标志物以及克服肿瘤细胞耐药性仍是胃癌研究中的两大重点内容。
MicroRNA(miRNA)是具有约22个核苷酸的内源性单链RNA分子,是高度保守的非编码RNA,能够与目标信使RNA(mRNA)的3’-UTR结合,从而抑制其表达和翻译。miRNA现已用于癌症或其他疾病的诊断研究中。miR-221已被证明与多种类型肿瘤相关,如Aslam等[5]研究表明,miR-221是结直肠癌的新型生物标志物;Shah等[6]指出miR-221和miR-222参与了侵袭性细胞基底样乳腺癌的上皮—间充质转化;Zhang等[7]研究发现高水平的miR-221和miR-222可使神经胶质瘤细胞浸润增加和预后不良。由此可见,miR-221可能在肿瘤的发生发展中发挥一定的促癌作用。此外,有研究指出,miR-221能够影响胃癌耐药细胞增殖和化疗敏感性[8]。但关于靶向下调miR-221介导胃癌细胞凋亡及其影响胃癌细胞化疗敏感性的具体机制尚未明确。鉴于此,本研究通过检测4种胃癌细胞系(SGC-7901、BGC-823、MGC803、MKN-28)中miR-221表达水平,并使用siRNA技术下调miR-221,观察其对肿瘤细胞凋亡及化疗敏感性的影响,并初步探究其作用机制,以期为肿瘤的靶向治疗及克服肿瘤细胞耐药的研究提供新方案。
1 材料与方法
1.1 主要材料与试剂
将正常胃黏膜上皮细胞NGEC与4种胃癌细胞系SGC-7901、BGC-823、MGC803、MKN-28[中国科学院典型培养物保藏委员会(上海)细胞库]加入RPMI-1640培养基(含10%胎牛血清、1%青—链霉素),置于37 ℃、5%CO2培养箱中培养,在生长对数期用0.25%胰蛋白酶消化传代。
奥沙利铂购自齐鲁制药有限公司,逆转录试剂盒和实时荧光定量PCR试剂盒购自美国GeneCopoeia公司,TRIzol试剂盒和Lipofectamine 2000试剂盒购自美国Invitrogen公司,JC-1荧光探针试剂盒购自北京百奥莱博科技有限公司,MTT试剂、Hoechst 33342染色试剂盒及Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒购自上海哈灵生物有限公司,BCA蛋白定量试剂盒和PVDF膜购自上海碧云天生物研究所,兔抗人Pink1、Parkin、LC3-Ⅱ、LC3-Ⅰ及P62单克隆抗体购自英国Abcam公司,辣根过氧化物酶标记山羊抗兔IgG和鼠抗人GAPDH单克隆抗体购自美国Santa Cruz公司,其他试剂均为国产分析纯。miR-221 inhibitor、inhibitor control、siRNA-Parkin及siRNA-NC序列均由上海吉玛制药技术有限公司设计合成。
1.2 实时荧光定量PCR检测miR-221表达水平
采用TRIzol法提取细胞总RNA,Nanodrop检测仪测定提取的总RNA纯度和浓度。采用逆转录试剂盒合成反转录序列,以实时荧光定量PCR试剂盒测定miR-221表达水平,以U6作为内参基因,扩增程序设置为:95 ℃ 10 min,1个循环;95 ℃ 20 s,60 ℃ 30 s,72 ℃ 10 s,共40个循环。引物序列:miR-221上游引物,5’-TCGTGGGAGCTACATTGTCTGC-3’,下游引物,5’-GTGCAGGGTCCGAGGT-3’;U6上游引物,5’-CTCGCTTCGGCAGCACA-3’,下游引物,5’-AACGCTTCAGAAT TTGCGT-3’。扩增结束后,采用2-ΔΔCt法计算miR-221相对表达水平。
1.3 细胞转染
取对数生长期的SGC-7901细胞以1×105个/孔的密度接种于12孔板中,置于37 ℃、5%CO2恒温培养箱中培养,融合度达到80%时,进行转染实验。将细胞随机分为5组:空白对照组、Anti-miR-NC组、Anti-miR-221组、Anti-miR-221+siRNA-NC组、Anti-miR-221+siRNA-Parkin组。空白对照组进行常规培养,利用Lipofectamine 2000脂质体介导法将inhibitor control及miR-221 inhibitor分别转染至Anti-miR-NC组和Anti-miR-221组细胞中,置于培养箱内转染6 h,更换新鲜培养基,继续培养48 h后,通过实时荧光定量PCR检测转染效果;Anti-miR-221+siRNA-NC组和Anti-miR-221+siRNA-Parkin组在转染miR-221 inhibitor后分别转染siRNA阴性对照及siRNA-Parkin至细胞,继续培养48 h后,收集细胞,进行后续实验。
1.4 MTT法检测转染后细胞活性
将各组SGC-7901细胞以2×104个/孔的密度接种至96孔板,置于37 ℃、5%CO2培养箱中培养,分别在0、12、24、48、72 h时每孔加入20 μL MTT(5 mg/mL),继续孵育4 h,弃去培养液,每孔加入150 μL的DMSO,置于摇床振荡至蓝紫色结晶甲瓒完全溶解,通过酶标仪在490 nm处检测各孔细胞的吸光度值(A值)。
1.5 JC-1荧光探针检测线粒体膜电位
将各组SGC-7901细胞以1×104个/孔的密度接种至12孔板中培养过夜,加入JC-1荧光探针工作液(1 μg/mL),置于37 ℃、5% CO2培养箱中避光孵育30 min,PBS洗涤细胞,以1 000 r/min离心5 min,弃上清液,加入PBS重悬细胞,倒置荧光显微镜下观察各组细胞荧光表达情况。
1.6 Western blot检测自噬相关蛋白表达水平
利用RIPA裂解液提取各组SGC-7901细胞总蛋白,BCA法检测提取的蛋白浓度。取各组蛋白样品50 μg上样通过10% SDS-PAGE电泳(电压90 V,时间20 min,后上调电压至120 V,时间60 min)进行分离,电转移(电压25 V,时间25 min)至PVDF膜,在5%脱脂奶粉中室温封闭1 h,加入一抗,4 ℃孵育过夜;次日弃一抗液,TBST洗膜,并加入对应二抗,室温孵育2 h,TBST洗膜,ECL显色,凝胶成像系统中曝光,Image J软件分析各条带灰度值,以GAPDH作为内参蛋白。
1.7 Hoechst 33342染色和Annexin Ⅴ-FITC/PI双染法检测细胞凋亡水平
收集各组SGC-7901细胞,用4%多聚甲醛进行固定,滴加0.5%Triton X-100透化15 min,PBS洗涤细胞,滴加终浓度5 mg/L的Hoechst 33342染色,室温避光孵育30 min,PBS再次洗涤细胞,脱水后封片干燥,荧光显微镜下观察细胞凋亡情况。
用PBS洗涤各组SGC-7901细胞,以1 000 r/min 离心3 min,弃上清液,加入适量 1×binding buffer重悬,调节浓度为1×106/mL,取100 μL细胞悬液并加入5 μL Annexin V-FITC,混匀,室温避光孵育5 min,再加10 μL PI,混匀,继续孵育10 min后,采用流式细胞仪检测各组细胞的凋亡情况。
1.8 MTT法检测各组细胞对奥沙利铂的敏感性
SGC-7901细胞转染48 h后,使用不同浓度奥沙利铂(2.5、5、10、20、40、80 μg/mL)分别处理空白对照组、Anti-miR-NC组、Anti-miR-221组、Anti-miR-221+siRNA-NC组、Anti-miR-221+siRNA-Parkin组的SGC-7901细胞48 h,MTT法检测各组SGC-7901细胞的半数抑制浓度(IC50),使用SPSS 23.0软件分析各组SGC-7901细胞IC50。药物处理结束后,每孔加入20 μL MTT(5 mg/mL)孵育4 h,加入150 μL DMSO摇床振荡至蓝紫色结晶甲瓒完全溶解后,使用酶标仪在490 nm处检测各孔细胞的A值,计算细胞增殖抑制率,增殖抑制率(%)=(1-实验组A值/对照组A值)×100%。
1.9 统计学分析
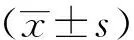
2 结果
2.1 正常胃黏膜上皮细胞与胃癌细胞miR-221表达
实时荧光定量PCR检测结果显示,与正常胃黏膜上皮细胞NGEC比较,4种胃癌细胞系SGC-7901、BGC-823、MGC803、MKN-28的miR-221相对表达水平明显升高,差异均具有统计学意义(P<0.05),见图1。4种胃癌细胞系中SGC-7901的miR-221表达水平最高,因此选择该细胞系进行后续实验。
2.2 转染后胃癌细胞miR-221表达及活性变化
实时荧光定量PCR检测转染后SGC-7901细胞中miR-221表达,结果显示,Anti-miR-221组SGC-7901细胞中miR-221表达水平较空白对照组下降,差异具有统计学意义(P<0.05);而Anti-miR-NC组与空白对照组miR-221表达水平比较差异无统计学意义(P>0.05),见图2。
MTT法结果显示,在转染24、48、72 h时,Anti-miR-221组SGC-7901细胞活性较空白对照组下降,差异具有统计学意义(P<0.05),Anti-miR-NC组与空白对照组比较差异无统计学意义(P>0.05);与Anti-miR-221组比较,在转染48 h和72 h时Anti-miR-221+siRNA-Parkin组细胞活性升高,差异具有统计学意义(P<0.05),而Anti-miR-221组与Anti-miR-221+siRNA-NC组比较差异无统计学意义(P>0.05),见图3。
2.3 下调miR-221表达对Parkin介导胃癌细胞线粒体膜电位的影响
JC-1荧光探针检测发现,与空白对照组比较,Anti-miR-221组SGC-7901细胞红色荧光减弱而绿色荧光增加(P<0.05),线粒体膜电位下降(P<0.05);Anti-miR-NC组细胞红色荧光和绿色荧光与空白对照组比较差异无统计学意义(P>0.05);与Anti-miR-221组比较,Anti-miR-221+siRNA-Parkin组红色荧光增加(P<0.05),绿色荧光有所减弱(P<0.05),线粒体膜电位升高(P<0.05),Anti-miR-221+siRNA-NC组细胞荧光强度未发生明显变化,见图4。

图4 各组SGC-7901细胞线粒体膜电位(JC-1荧光探针,×100)
2.4 下调miR-221表达对Parkin介导胃癌细胞自噬相关蛋白表达的影响
Western blot检测结果显示,与空白对照组比较,Anti-miR-221组SGC-7901细胞Pink1、Parkin蛋白表达水平升高,LC3-Ⅱ/LC3-Ⅰ比值上调,P62蛋白表达水平下降,差异均具有统计学意义(P<0.05),Anti-miR-NC组各蛋白表达水平与空白对照组比较差异无统计学意义(P>0.05);与Anti-miR-221组比较,Anti-miR-221+siRNA-Parkin组细胞Pink1、Parkin蛋白表达水平下降,LC3-Ⅱ/LC3-Ⅰ比值下调,P62蛋白表达水平升高,差异均具有统计学意义(P<0.05),而Anti-miR-221+siRNA-NC组各蛋白表达水平与Anti-miR-221组比较差异无统计学意义(P>0.05),见图5。
1:空白对照组;2:Anti-miR-NC组;3:Anti-miR-221组;4:Anti-miR-221+siRNA-NC组;5:Anti-miR-221+siRNA-Parkin组 *:与空白对照组比较,P<0.05;#:与Anti-miR-221组比较,P<0.05
2.5 下调miR-221表达对Parkin介导胃癌细胞凋亡的影响
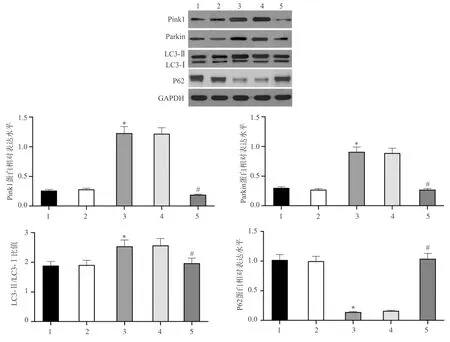
Hoechst 33342染色结果显示,空白对照组和Anti-miR-NC组SGC-7901细胞胞核外围轮廓较为清晰,大小一致,无明显核浓缩现象;Anti-miR-221组和Anti-miR-221+siRNA-NC组细胞出现较多核浓缩、碎裂的蓝色凋亡体,说明凋亡细胞数目较多;而Anti-miR-221+siRNA-Parkin组细胞中核浓缩现象较Anti-miR-221组减少,说明凋亡细胞数目减少,见图6。
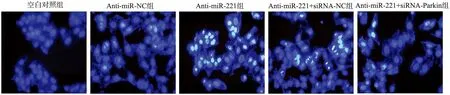
图6 各组SGC-7901细胞凋亡情况(Hoechst 33342染色,×200)
Annexin Ⅴ-FITC/PI双染法检测结果显示,Anti-miR-221组SGC-7901细胞凋亡率较空白对照组明显升高,差异具有统计学意义(P<0.05),而Anti-miR-NC组细胞凋亡率与空白对照组比较差异无统计学意义(P>0.05);Anti-miR-221+siRNA-Parkin组细胞凋亡率较Anti-miR-221组降低,差异具有统计学意义(P<0.05),Anti-miR-221+siRNA-NC组与Anti-miR-221组细胞凋亡率比较差异无统计学意义(P>0.05),见图7。
*:与空白对照组比较,P<0.05;#:与Anti-miR-221组比较,P<0.05
2.6 下调miR-221表达对胃癌细胞化疗敏感性的影响
不同浓度奥沙利铂(2.5、5、10、20、40、80 μg/mL)处理各组SGC-7901细胞后,经MTT法检测发现,各组细胞存活率均呈下降趋势,IC50分别为8.14、8.07、4.79、4.74、7.23 μg/mL,差异具有统计学意义(P<0.05)。与空白对照组比较,Anti-miR-221组细胞增殖抑制率升高,IC50下降,差异具有统计学意义(P<0.05),Anti-miR-NC组与空白对照组比较,差异无统计学意义(P>0.05);Anti-miR-221+siRNA-Parkin组的SGC-7901细胞增殖抑制率较Anti-miR-221组有所下降,IC50较Anti-miR-221组升高,差异均具有统计学意义(P<0.05),Anti-miR-221+siRNA-NC组与Anti-miR-221组细胞增殖抑制率、IC50比较差异无统计学意义(P>0.05),见表1。
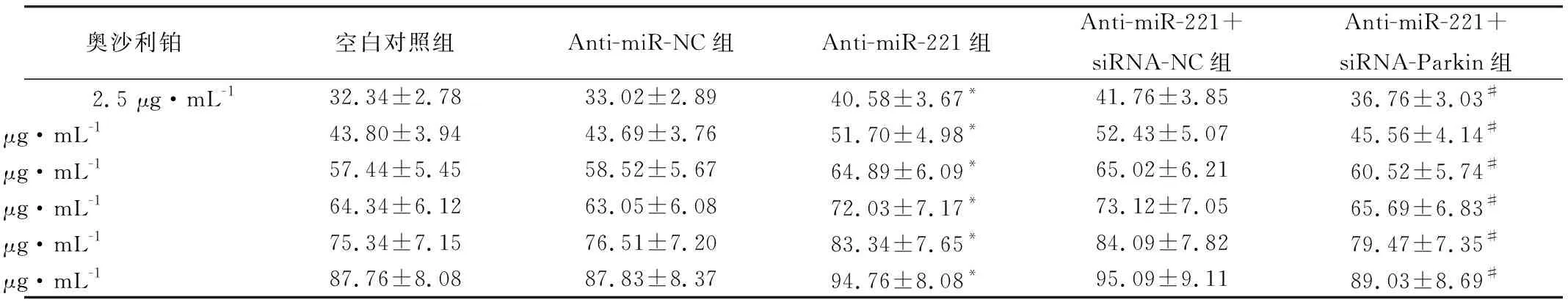
表1 不同浓度奥沙利铂对各组SGC-7901细胞的增殖抑制率(%)
3 讨论
胃癌的发生过程十分复杂,涉及肿瘤相关基因的结构变异和表达变化。miRNA在肿瘤的发生发展中起着重要作用,对于不同类型的癌症来说其可能是非侵入性诊断和预后的生物标志物。以往研究表明,miRNA诱导的基因沉默与癌变之间的相互作用是胃癌研究中的热点之一,胃癌中异常表达的miRNA在癌症诊治中具有重要价值[9]。目前已发现多种miRNA在胃癌患者组织或血液中存在异常表达,如胃癌患者血清中miR-21、miR-146a和miR-148a的水平与胃癌pN分期密切相关,这些miRNA水平可能是预测淋巴结转移的生物标志物[10];miR-6778-5p通过靶向YWHAE来反馈调节宿主基因SHMT1的表达水平,从而增强胃癌干细胞的干性,使肿瘤细胞维持恶性生物学特性[11];miR-374-5p通过靶向SRCIN1和RECK基因来促进胃癌细胞的增殖、迁移和侵袭[12-13]。
本研究通过检测正常胃黏膜上皮细胞NGEC和4种胃癌细胞系SGC-7901、BGC-823、MGC803、MKN-28中miR-221表达水平发现,miR-221在4种胃癌细胞系中均呈现异常高表达,因此推测miR-221可能参与胃癌的发生发展。目前,关于miR-221在其他肿瘤中的作用研究逐渐增加,如Gramantieri等[14]研究发现在肝细胞癌及复发的肝细胞癌患者中miRNA-221表达升高,揭示miRNA-221通过靶向Bmf参与肝细胞癌的发生,并与肿瘤大小、组织病理学分级、肿瘤多灶性等相关;Lu等[15]指出miR-221通过抑制肿瘤抑制因子TIMP2从而在肾癌细胞的增殖、迁移和侵袭中充当致癌基因;Teixeira等[16]研究表明血浆样本中miR-221的过表达与肾细胞癌患者的总生存期缩短有关。由此可见,miR-221高表达可能促进一些肿瘤的恶性进展。胃癌作为恶性程度较高的肿瘤,一方面,由于缺乏典型的早期症状,大多数胃癌患者被诊断时已为晚期;另一方面,在治疗过程中耐药性的产生使得患者的治疗效果降低,预后较差[2]。尽管目前已有大量研究分析了胃癌发生和发展的分子机制,但要确定用于胃癌检测治疗的特异性新靶标并克服肿瘤细胞的耐药性仍然是一项巨大挑战。
大量研究表明,miRNA参与调控癌症化疗过程,这为克服胃癌细胞耐药性提供了潜在的靶点。如miR-197和miR-130b分别通过靶向信号转导和转录激活因子3与Wnt/β-catenin途径导致非小细胞肺癌细胞产生顺铂耐药性[17-18],相反,miR-125a-5p能够通过靶向信号转导和转录激活因子3减少其水平来逆转食管鳞状细胞癌的顺铂耐药性[19];与邻近正常组织相比,胰腺癌组织及胰腺癌顺铂耐药细胞中的miR-374b-5p表达水平均降低,而miR-374b-5p通过直接靶向抗凋亡蛋白Bcl-2、BIRC3和XIAP增强肿瘤细胞的化学敏感性[20]。此外,已有研究表明miRNA-221参与调控胃癌细胞的放射抗性[21]。奥沙利铂是胃癌的一线化疗药物,与5-氟尿嘧啶联合使用具有协同作用。本研究通过转染miRNA-221 inhibitor抑制胃癌细胞中miRNA-221表达后发现胃癌细胞对奥沙利铂的化疗敏感性增加,提示miRNA-221可能参与调节胃癌细胞的化疗敏感性。
凋亡是受基因控制的自主而有序的细胞死亡过程,在生物体进化、内环境稳定性以及多种系统的发展中均起着重要作用。凋亡途径主要分为两种,一种是细胞死亡受体介导的外源信号传导途径,细胞死亡受体可以诱导Caspase-8和Caspase-10激活,鉴于一些Bcl-2家族成员蛋白触发了与线粒体相关的内在凋亡途径,且随后激活了Caspase-9和Caspase-3,从而导致细胞死亡;另一种是线粒体内质网相关的内源信号传导途径,随着过度的内质网应激、超载的自由基和Ca2+在雌激素受体管腔中产生并转化为细胞质和线粒体,使得线粒体受到这些超负荷压力的干扰,触发下游一系列反应而诱导细胞凋亡[22-23]。内源性途径可以由线粒体膜电位的丧失触发,线粒体膜电位下降是细胞死亡的早期事件。当线粒体受损时,蛋白激酶Pink1聚集于线粒体外膜同时激活Parkin,并将Parkin招募到受损线粒体上,通过一系列作用启动线粒体自噬途径[24]。本研究结果显示,在下调miRNA-221表达的胃癌细胞中检测到线粒体膜电位下降,促进了细胞凋亡的发生。为了进一步探讨该作用的可能机制,本研究通过在下调miRNA-221的胃癌细胞中转染siRNA-Parkin抑制细胞线粒体自噬途径后发现,Pink1、Parkin蛋白表达水平下降,LC3-Ⅱ/LC3-Ⅰ比值下调,P62蛋白表达水平升高,同时,线粒体膜电位升高,抑制了细胞的凋亡,并且降低了胃癌细胞的化疗敏感性。
综上所述,miRNA-221参与调控Parkin介导的线粒体自噬途径,从而影响胃癌细胞的凋亡与化疗敏感性,下调miRNA-221表达可激活Parkin介导的胃癌细胞线粒体自噬途径进而诱导细胞凋亡,增加胃癌细胞对奥沙利铂的化疗敏感性。这一结果提示,miRNA-221可能是胃癌治疗的一个潜在靶点,线粒体途径可能是miRNA-221调控胃癌细胞凋亡与化疗敏感性的途径之一,这将有助于阐明胃癌的发病机制,并为克服胃癌化疗耐药性的研究提供参考。
