梨木虱化学感受蛋白CchiCSP8与梨树挥发物的结合特性分析
2022-08-13姚玮宸徐继伟朱秀云张亚楠
姚玮宸, 徐继伟, 徐 鹿, 朱秀云, 张亚楠,*
(1. 淮北师范大学生命科学学院,安徽省特色资源植物利用工程实验室,安徽淮北 235000;2. 江苏省农业科学院植物保护研究所, 省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室, 南京 210014)
通常,环境中的气味分子会通过昆虫嗅觉感器表皮上的小孔进入其内,并与气味结合蛋白(odorant-binding protein, OBP)/化学感受蛋白(chemosensory protein, CSP)结合成复合物,扩散到嗅觉感器的淋巴液中,随后与树突膜上的气味受体(odorant receptor, OR)结合,OR对气味分子进行识别和编码,这使得神经元细胞膜的通透性发生变化,导致产生动作电位,然后投射到中枢神经系统,进而引发昆虫相关的行为反应。当传递完成后,有气味降解酶(odorant-degrading enzyme, ODE)降解掉多余的气味分子,从而恢复嗅觉神经元的敏感性,以接受新的信号刺激(Leal, 2013; 杜立啸等, 2016)。CSP是一类分子量小、水溶性大,能够结合运输脂溶性信息化合物的可溶性蛋白(Wanneretal., 2004),广泛分布于昆虫各种嗅觉感受器,感受传导外界化学因子刺激。CSP通常编码110~115个氨基酸,比OBP编码的长度要短。CSP编码氨基酸序列中有4个保守的半胱氨酸(cysteine, Cys),这4个Cys形成两个不互相连锁的二硫桥。在进化上,CSP比OBP更加保守,不同昆虫的CSP的同源性在40%~60%之间(Wanneretal., 2004)。CSP不仅在触角中表达,同时也在昆虫身体的其他部位表达,如在喙、足、下唇须及性腺中表达(刘孝贺等, 2020)。与CSP分布广泛相对应的是其具有功能多样性,已得到证实的功能为:(1)结合并且运输脂溶性的气味分子(Pelosietal., 2018);(2)结合并运输性信息素气味分子(Zhangetal., 2014);(3)调节昆虫生长发育,免疫作用(Gongetal., 2012);(4)参与化学农药的抗性形成(Inghametal., 2020)。
目前对梨木虱的研究主要停留在表观生理生态水平及对若虫分泌物的研究,有关其取食的嗅觉分子机制研究匮乏。本课题组前期成功构建了梨木虱头部转录组数据库,并从中鉴定到11个CSP基因,其中CchiCSP8在若虫头部的表达显著高于成虫头部的(Xuetal., 2019)。本研究克隆了CchiCSP8全长开放ORF序列,并对其序列和进化特征进行了分析,随后借助大肠杆菌Escherichiacoli进行原核表达和纯化,采用荧光竞争结合实验分析了体外重组CchiCSP8蛋白与41种梨树挥发物的结合特征,并使用同源建模和分子对接预测了CchiCSP8与气味分子结合的关键氨基酸位点。研究CchiCSP8与梨树挥发物的结合特性,可为明晰梨木虱在定位梨树过程中的嗅觉机制提供理论基础,并为开发基于扰乱嗅觉行为的新型梨木虱行为调控技术提供新思路。
1 材料与方法
1.1 供试昆虫
梨木虱采集于安徽省宿州市砀山县(34°27′42.62″N, 116°31′40.72″E)梨园,若虫饲养于一次性无菌透明饭盒中。饲养条件为温度26±1℃,相对湿度40%~60%,光周期14L∶10D。用新鲜采摘且未接触杀虫剂的砀山酥梨PyrusbretschneideriRehd. cv. Dangshansuli叶片进行饲喂。在体式显微镜下用无菌手术刀切取若虫头部后迅速放到液氮中冷冻,于-80℃保存备用。
1.2 总RNA提取和cDNA合成
将收集后的100头梨木虱若虫头部于液氮中速冻并迅速研磨,按照MiniBEST Universal RNA Extraction(TaKaRa,日本)提供的说明书提取总RNA,用超微量分光光度计(MD2000D,Biofuture,英国)测定RNA的浓度及质量,再采用Prime ScriptTMRT Reagent Kit with gDNA Eraser试剂盒(TaKaRa,日本)进行反转录,合成cDNA第1链,-20℃保存备用。
1.3 目的基因的克隆和序列分析
根据本课题组前期所获得的序列信息(Xuetal., 2019),利用Primer Premier 5.0设计CchiCSP8的特异性扩增引物,并在引物前端加上BamHⅠ和XhoⅠ酶切位点(下划线表示),上游引物:5′-GGATCCGCATCAGTTACACCCAAACCAA-3′;下游引物:5′-CTCGAGCTAGTTTCCTGTAAACTGTTGAATGA TTT-3′。 使用PrimeSTAR Max DNA聚合酶(TaKaRa,日本)进行PCR。扩增程序: 98℃ 2 min; 98℃ 10 s, 59℃ 10 s, 72℃ 30 s, 35个循环;72℃ 2 min。用1.0%琼脂糖凝胶电泳检测扩增产物,按照普通琼脂糖凝胶回收试剂盒(Axygen,美国)说明书对PCR产物进行纯化回收。利用在线网站(https:∥web.expasy.org/compute_pi/)预测CchiCSP8的分子量和等电点,利用SignalP 4.1软件(https:∥www.cbs.dtu.dk/services/SignalP/)预测CchiCSP8的信号肽序列。利用ClustalX 2.0(Larkinetal., 2007)将CchiCSP8与其他昆虫的CSP进行多序列比对,通过MEGA11(Tamuraetal., 2021)软件中的邻接法构建系统进化树。
1.4 体外重组蛋白的原核表达与纯化
将纯化回收的PCR产物克隆到pEASY-Blunt3克隆载体(全式金,北京)上,重组克隆质粒测序[通用生物(安徽)股份有限公司,滁州]成功后,使用FastDigest®限制性内切酶BamHⅠ和XhoⅠ(Fermentas,上海)对pEASY-Blunt3-CchiCSP8和表达载体pET-30a(+)进行双酶切。 将目的片段和载体分别进行胶回收后,用T4 DNA连接酶(莫纳,武汉)连接目的片段和表达载体。将连接产物转化进大肠杆菌Trans 5α感受态细胞(全式金,上海)中,送公司测序。测序正确的质粒pET30a(+)-CchiCSP8要求公司返还。将返还的正确质粒pET30a(+)-CchiCSP8转化进大肠杆菌BL 21(DE3)(鼎国,南京),挑取单克隆,将阳性菌落接种到1 mL的具有卡那霉素抗性的LB液体培养基中,于37℃ 250 r/min的振荡箱中培育至OD600=0.6~0.8,吸取500 μL的菌液于无菌离心管中,另一半等比例加甘油保存于-80℃。往离心管中加入终浓度为100 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG)进行预诱导,37℃孵育5 h,用SDS-PAGE检测。蛋白胶的相应位置出现目的条带后,将保留的原始菌液扩大培养,诱导,7 000 r/min离心10 min收集菌体。随后进行超声破碎,设置超声3 s,间歇3 s,破碎10 min。使用组氨酸标签蛋白镍磁珠纯化技术Beaver BeadsTMHis-tag Protein Purification Kit(金斯瑞,南京)对融合蛋白进行纯化,用尿素梯度递减的透析方式复性蛋白,并于-20℃保存备用。
1.5 目的蛋白的荧光竞争结合实验分析
选择N-苯基-1-萘胺(N-phenyl-1-naphthylamine, 1-NPN)为结合实验的探针,共测定了重组蛋白CchiCSP8与41种梨树挥发物(Luetal., 2012; Najar-Rodriguezetal., 2013)的结合特性。以色谱级甲醇为溶剂将1-NPN和梨树挥发物配制成1 mmol/L的工作液。设定激发光波长Ex=337 nm,扫描发射光波长范围Em=400~500 nm。在反应总体积为250 μL Tris-HCl缓冲液中加入2 μmol/L重组蛋白CchiCSP8,随后在反应液里依次加入终浓度为0~20 μmol/L 1-NPN。将配制好的梨树挥发物工作液依次加入CchiCSP8蛋白与1-NPN的混合体系中,使终浓度由2 μmol/L递增至40 μmol/L。所有挥发物纯度>95%。
利用GraphPad Prism 7.0用最大发射峰处的荧光强度对配基浓度作图,根据公式Ki=[IC50]/(l+[1-NPN]/Kl-NPN)计算出目的蛋白CchiCSP8与配体的结合常数Ki。[IC50]为CchiCSP8/1-NPN复合物的荧光强度下降到50%的配体浓度。[1-NPN]为未结合时1-NPN的浓度。Kl-NPN是利用Scatchard方程计算的目的蛋白与1-NPN的解离常数。
1.6 同源建模与分子对接
建模和分子对接方法参考本课题组前期已有研究(Zhangetal., 2020a, 2020b)。描述如下:将CchiCSP8的氨基酸序列提交到NCBI BLASTp服务器(http:∥blast.ncbi.nlm.nih.gov)进行同源比对,并在PDB蛋白数据库(https:∥www.rcsb.org)中搜索合适的建模模板。选择甘蓝夜蛾Mamestrabrassicae化学感受蛋白 MbraCSP2(PDB ID: 1K19)作为CchiCSP8同源建模的合适模板,采用MODELER v.9.25(http:∥salilab.org/modeller/)进行同源建模。利用AutoDock Vina v.1.1.2(Trottetal., 2010)研究CchiCSP8与配体结合模式。选取荧光竞争结合实验中与CchiCSP8有结合力的18种梨树挥发物开展分子对接分析。利用ChemDraw 20.0绘制配体的二维结构,然后通过Chem3D 20.0软件将其转换为三维结构。选择AutoDock Vina的默认参数进行对接分析,并根据Vina对接评分,对排名最高的构象使用PyMOL v.1.9.0(http:∥www.pymol.org/)进行可视化分析。
采用新办法摸清农村家底。创新运用“天地网”同查法,全面排查农村“三资”,把“糊涂账”弄清楚,把“家底子”搞明白。“天”指对国土等部门航拍图和确权地块定位图进行分析,初步计算出村集体资源总面积;“地”指对照村集体资源分类分布区域图,到村组实地测绘、勘查核查;“网”指对新测绘数据进行汇总绘图,实行一村一图、一组一表、集中公示的“网格化”管理,做到账实、账款、账证、账账、账表“五相符”,各类自然资源信息面积、四至、现状、管理人“四清晰”。通过“天地网”同查,全县共核查出被占用和闲置的村级集体土地3万亩,为集体增收创造了条件。
1.7 数据分析
CchiCSP8和不同配体的结合力数据由1/Ki的平均值±标准误表示,采用SPSS17.0软件(美国)按照单因素方差分析(ANOVA)中的最小显著性差异法(LSD)进行平均值的比较分析。
2 结果
2.1 CchiCSP8的克隆及序列特征
CchiCSP8的开放阅读框全长426 bp,编码141个氨基酸,N端有一个包含21个氨基酸的信号肽。成熟的CchiCSP8蛋白的预测分子量和等电点分别为15.02 kD和9.77;将CchiCSP8与同目昆虫(柑橘木虱Diaphorinacitri、烟粉虱Bemisiatabaci、豆荚草盲蝽Lygushesperus和绿盲蝽Apolyguslucorum)CSP的氨基酸序列进行比对,结果发现CchiCSP8具有4个保守的半胱氨酸位点(图1: A);进一步构建系统发育树,结果显示CchiCSP8与柑橘木虱DcitCSP11的进化关系最近(图1: B)。
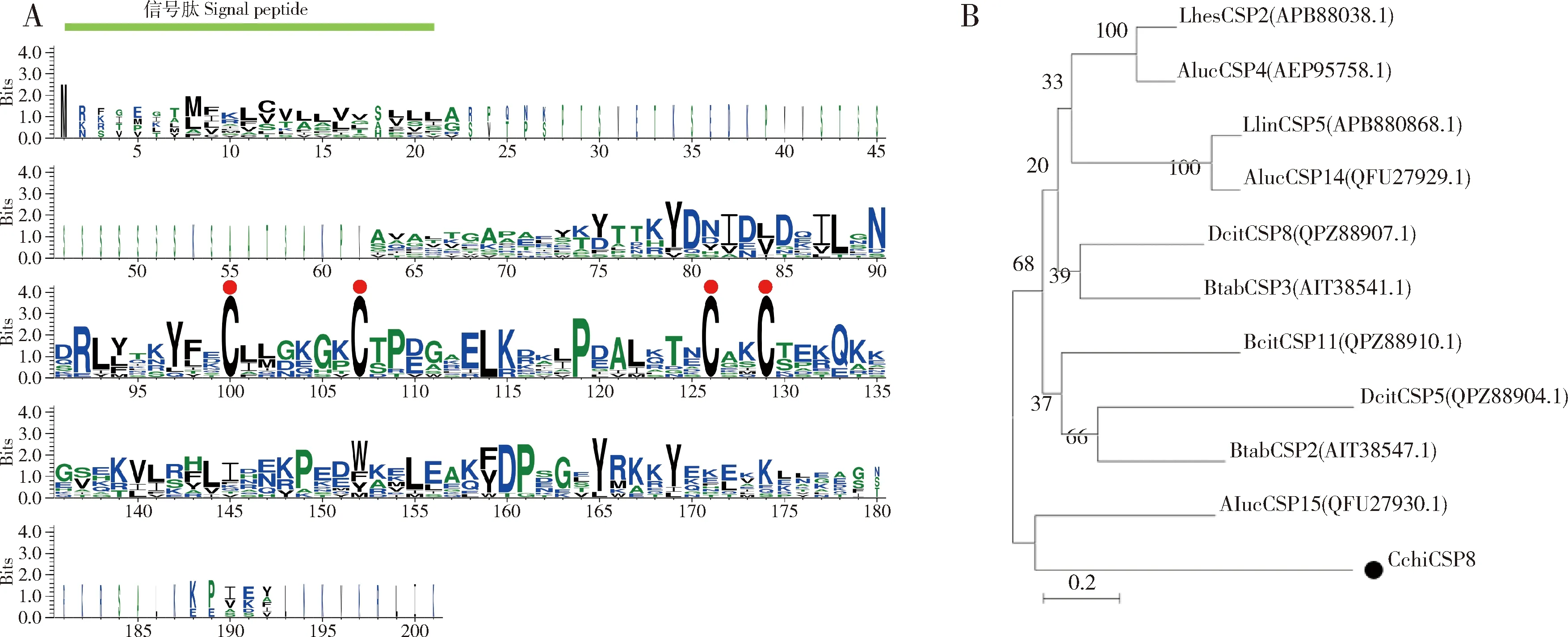
图1 CchiCSP8与其他半翅目昆虫CSPs的氨基酸序列比对(A)及其基于氨基酸序列构建的系统发育树(B)Fig. 1 Amino acid sequence alignment between CchiCSP8 and CPSs from other hemipteran insects (A)and their phylogenetic tree based on amino acid sequence (B)A图中堆叠的整体高度表示该位置的序列保守性,堆叠内符号的高度表示每个氨基酸在该位置的相对频率。红点表示保守的半胱氨酸。In Fig. A, the overall height of the stack indicates the sequence conservation at that position, and the height of the symbols within the stack suggests the relative frequency of each amino acid at that position. Red dots indicate the conserved cysteines. CSPs来源物种Origin species of CSPs: Llin: 美国牧草盲蝽Lygus lineolaris; Aluc: 绿盲蝽Apolygus lucorum; Lhes: 豆荚草盲蝽Lygus hesperus; Dcit: 柑橘木虱Diaphorina citri; Btab: 烟粉虱Bemisia tabaci; Cchi: 梨木虱Cacopsylla chinensis.
2.2 CchiCSP8重组蛋白的表达和纯化
将含有pET-30a(+)-CchiCSP8质粒的大肠杆菌BL21(DE3)单克隆菌落接种培养后,用终浓度为1 mmol/L IPTG进行诱导,SDS-PAGE电泳显示,在21 kD左右出现了蛋白条带,这与预测含有His标签的重组蛋白分子量大小一致,且CchiCSP8重组蛋白主要在包涵体中表达,因此对包涵体复性处理后用镍磁珠纯化得到单一条带的目的蛋白,并经电泳证实符合CchiCSP8蛋白的分子量大小(图2)。
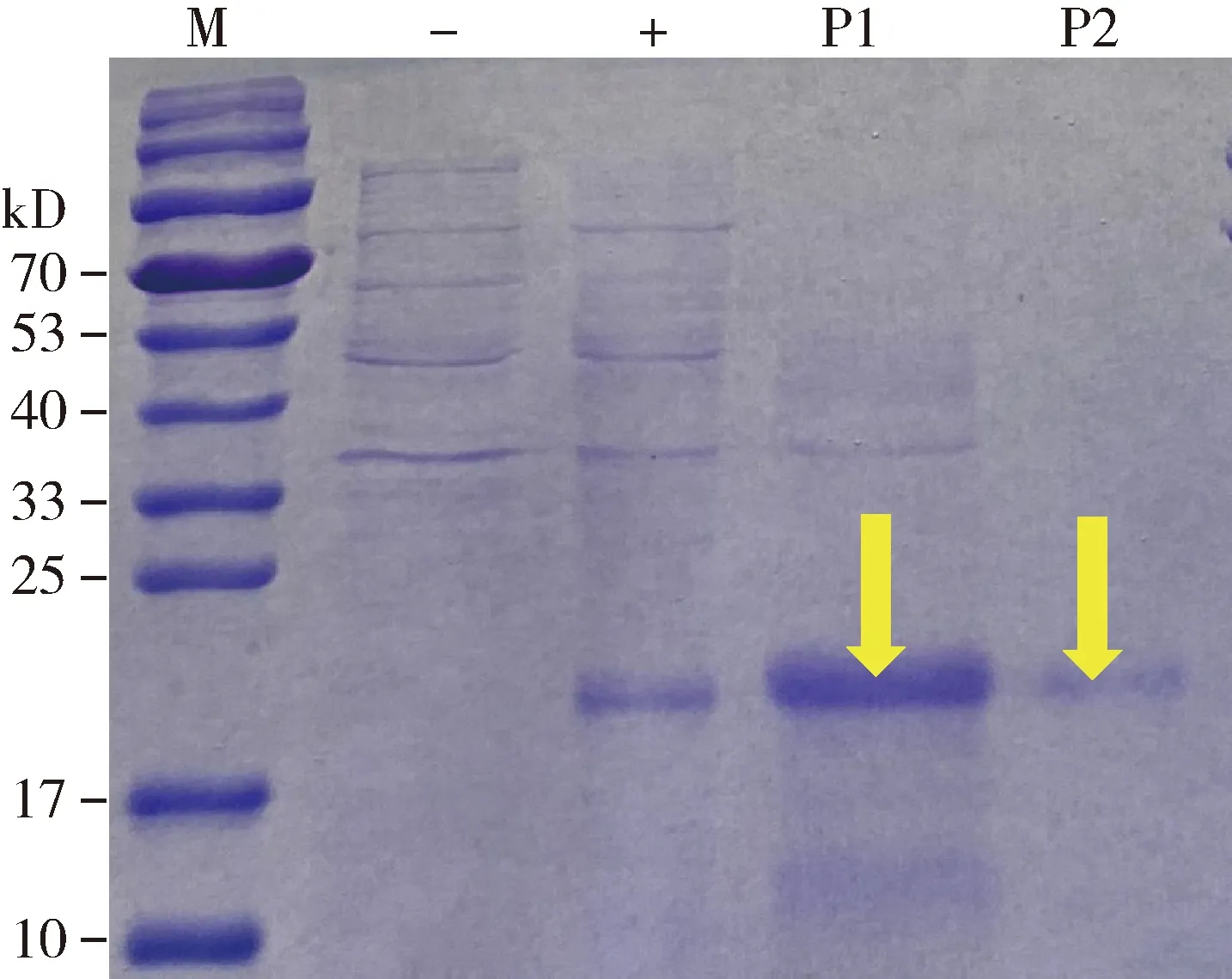
图2 CchiCSP8重组蛋白的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of the recombinant CchiCSP8M: 蛋白分子量标准Protein molecular weight marker; -: 未诱导的pET30a-CchiCSP8大肠杆菌菌体Non-induced pET30a-CchiCSP8 in Escherichia coli; +: 经过IPTG诱导表达的pET30a-CchiCSP8蛋白Expressed protein pET30a-CchiCSP8 after induction by IPTG; P1: 经过镍磁珠纯化获得的CchiCSP8蛋白Purified protein CchiCSP8 through nickel magnetic bead; P2: 再次纯化获得的CchiCSP8蛋白Repurified protein CchiCSP8.
2.3 CchiCSP8与梨树挥发物的结合特性
在337 nm激发光下,纯化后的CchiCSP8蛋白与荧光探针1-NPN的荧光值随着1-NPN浓度的增加逐渐达到饱和,具有良好的亲和力,因此1-NPN可用于测定CchiCSP8与不同配体的结合特性。利用Scatchard方程可计算出CchiCSP8与1-NPN的解离常数(Ki)为15.58±3.45 μmol/L(图3: A)。
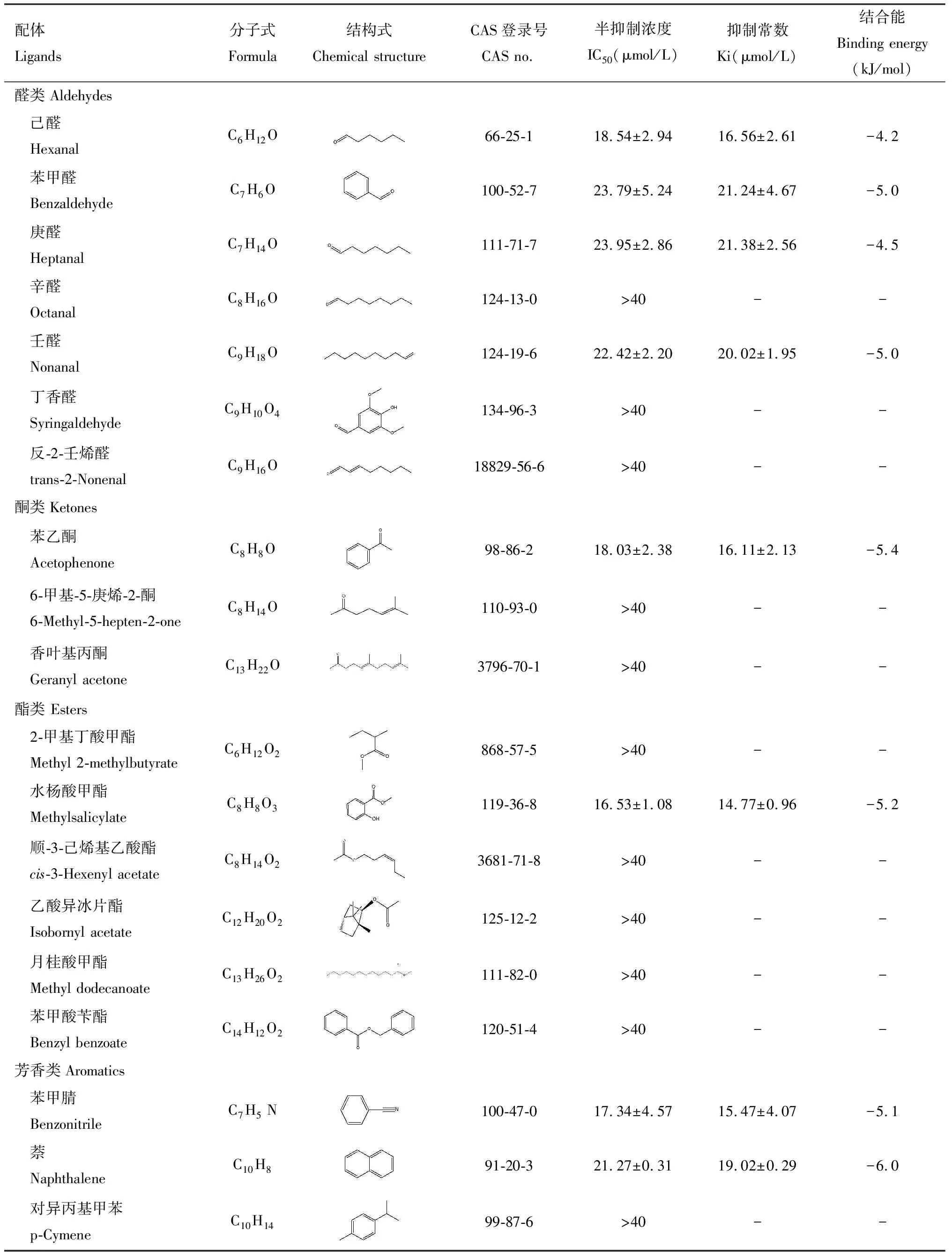
为探究CchiCSP8与梨树挥发物的识别对应特征,本研究选择41种梨树挥发物作为配体,采用荧光竞争性结合实验分析CchiCSP8的结合特性。结果显示,CchiCSP8对18种梨树植物挥发物具有不同程度的结合能力(Ki=4~30 μmol/L),包括4种烯烃(1-庚烯、1-壬烯、莰烯和桧烯)(Ki=25~29 μmol/L,6种醇(3-甲基-2-丁烯-1-醇、顺-3-己烯醇、正己醇、正庚醇、正辛醇和1-十一醇)(Ki=17~28 μmol/L),4种醛(己醛、苯甲醛、庚醛和壬醛)(Ki=16~22 μmol/L),1种酮(苯乙酮)(Ki=16.11±2.13 μmol/L),1种酯(水杨酸甲酯)(Ki=14.77±0.96 μmol/L),2种芳香类化合物[苯甲腈(Ki=15.47±4.07 μmol/L)和萘(Ki=19.02±0.29 μmol/L)](图3: B-E; 表1)。
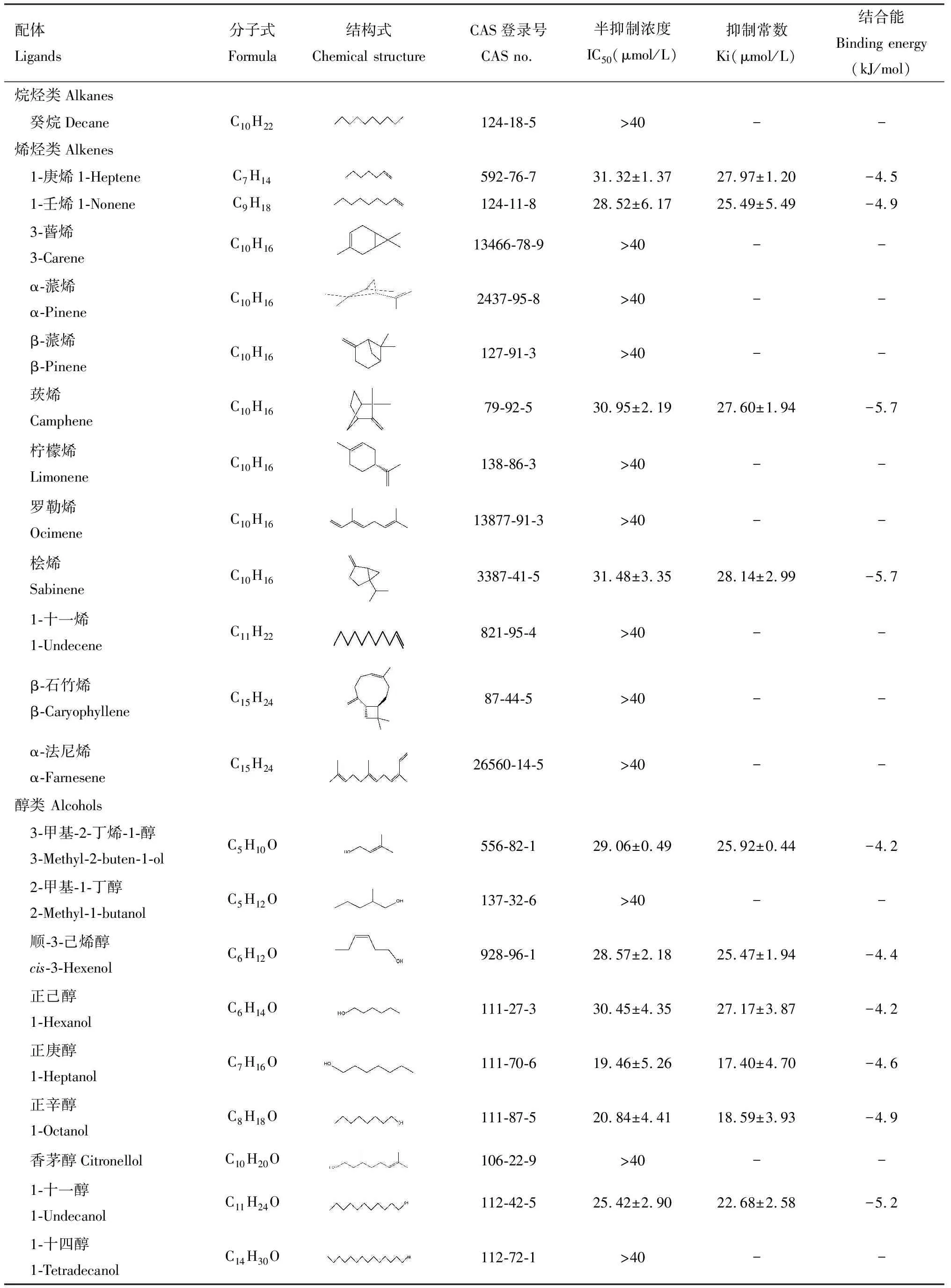
表1 重组蛋白CchiCSP8与不同梨树挥发物(配体)的结合特性Table 1 Binding properties of the recombinant CchiCSP8 with different pear tree volatiles (ligands)
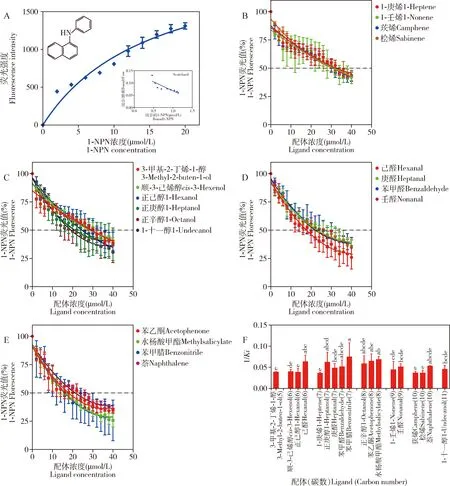
图3 重组蛋白CchiCSP8与配体结合实验Fig. 3 Ligand-binding assay for the recombinant CchiCSP8A: CchiCSP8和1-NPN的结合曲线以及Scatchard方程Binding curve and Scatchard plots of CchiCSP8 and 1-NPN; B: CchiCSP8与4种烯烃类挥发物的结合曲线Binding curves of CchiCSP8 to four alkene volatiles; C: CchiCSP8与6种醇类挥发物的结合曲线Binding curves of CchiCSP8 to six alcohol volatiles; D: CchiCSP8与4种醛类挥发物的结合曲线Binding curves of CchiCSP8 to four aldehyde volatiles; E: CchiCSP8与4种挥发物的结合曲线Binding curves of CchiCSP8 to four volatiles; F: CchiCSP8对不同配体的结合力(以1/Ki表示)的比较 Comparison of the binding affinities (indicated by 1/Ki) of CchiCSP8 with different ligands. 图中数据为平均值±标准误; 柱上不同字母表示差异显著(P<0.05, LSD检验); 图4同。Data in the figure are mean±SE. Different letters above bars indicate significant difference (P<0.05, LSD test). The same for Fig. 4. 结合曲线上的误差线表示标准误。Error bars on binding curves represent standard errors.
进一步分析显示CchiCSP8与酮类、酯类、芳香类物质的结合能力高于与烯烃类、醇类和醛类物质的结合能力(图4: A)。 在分类相同的配体中,CchiCSP8与配体的结合力表现出了随碳原子数不同而变化的特点。在烯烃组(7-10C)中,CchiCSP8对1-壬烯(9C)的结合力最高(图4: B);在醇类(5-11C)中,对正庚醇(7C)的结合力最高(图4: C);在醛类(6-9C)中,对己醛(6C)的结合力最高(图4: D)。
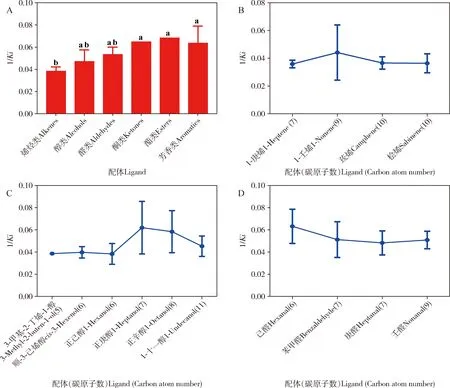
图4 重组蛋白CchiCSP8结合力与配体的关系Fig. 4 Relationship between the binding affinities of the recombinant CchiCSP8 and ligandsA: CchiCSP8对不同类别配体的结合力(以1/Ki表示)的比较Comparison of the binding affinities (indicated by 1/Ki) of CchiCSP8 with different types of ligands; B: CchiCSP8与烯烃类结合力与碳原子数之间的关系Relationship between the binding affinities of CchiCSP8 with alkenes and the number of carbon atoms; C: CchiCSP8与醇类结合力与碳原子数之间的关系Relationship between the binding affinities of CchiCSP8 with alcohols and the number of carbon atoms; D: CchiCSP8与醛类结合力与碳原子数之间的关系Relationship between the binding affinities of CchiCSP8 with aldehydes and the number of carbon atoms.
2.4 CchiCSP8同源建模与分子对接
鉴定CchiCSP8与不同配体相互作用的关键氨基酸残基是分析CchiCSP8与配体结合机制的重要步骤。根据蛋白质数据库的搜索结果,选择甘蓝夜蛾的化学感受蛋白MbraCSP2(PDB ID:1K19)作为模板,对CchiCSP8蛋白的三维结构进行建模。如图5所示,CchiCSP8同MbraCSP2相似,均有6个α螺旋结构(α1-α6),这符合昆虫CSP的结构特征(Pelosietal., 2018)。这些表明,CchiCSP8和MbraCSP2的配体结合机制可能是相似的,构建的CchiCSP8的三维结构是可靠的,可以用于后续的分子对接分析。
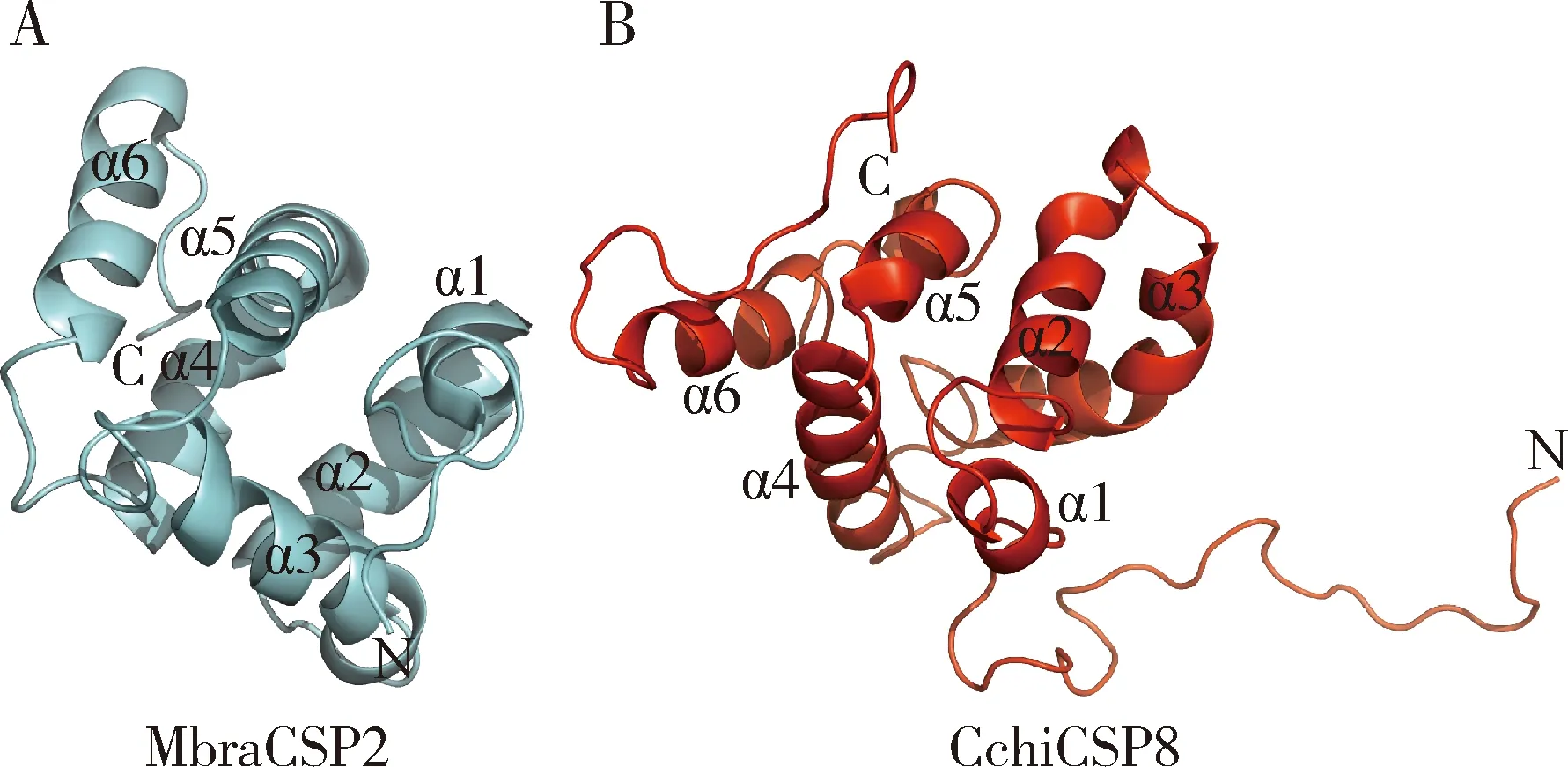
图5 CchiCSP8的三维模型Fig. 5 Three-dimensional (3D) structure of CchiCSP8A: 甘蓝夜蛾MbraCSP2(PDB:1K19)的三维结构模型作为模板Three-dimensional structure of MbraCSP2(PDB:1K19) of Mamestra brassicae used as a template; B: CchiCSP8的三维结构模型Three-dimensional structure of CchiCSP8.
随后计算CchiCSP8和每个配体之间的结合能(表2),结果显示,所有配体的结合能相差不大(-4.2~6.0 kJ/mol), 且所有潜在的交互氨基酸残基的距离均小于4 Å(图6),表明CchiCSP8和18种不同配体之间结合能力存在差异,这与上述荧光竞争结合实验的结果一致。此外,我们发现在CchiCSP8与不同配体结合过程中,存在多个共有氨基酸残基(表2),5个非极性残基:丙氨酸Ala38(A38, 对应13个配体),丙氨酸Ala42(A42, 对应13个配体),亮氨酸Leu93(L93, 对应17个配体),亮氨酸Leu99(L99, 对应14个配体),缬氨酸Val100(V100, 对应16个配体);2个极性残基:谷氨酰胺Gln107(Q107,对应9个配体),赖氨酸Lys46(K46, 对应17个配体)。
续表1 Table 1 continued
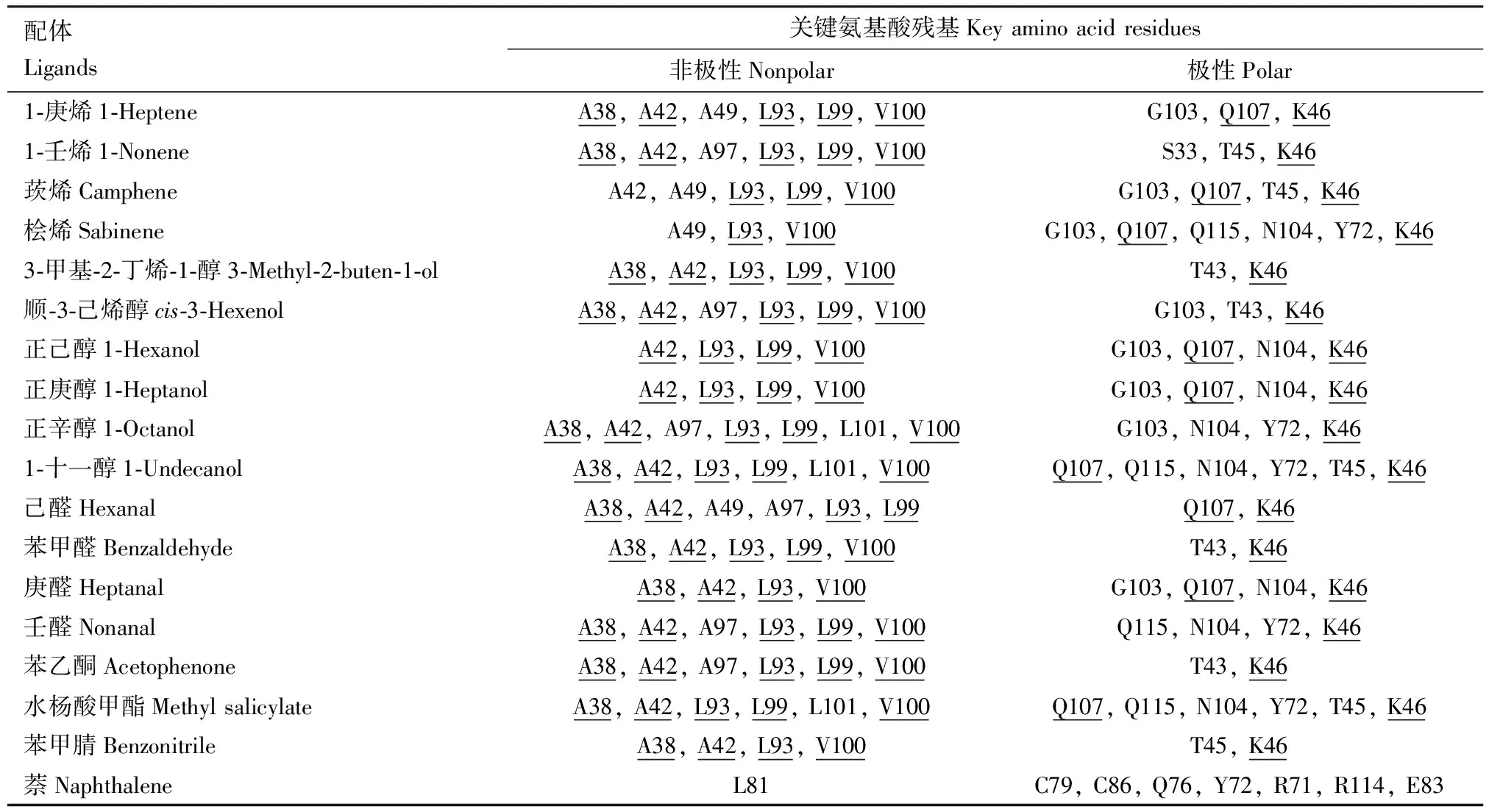
表2 重组蛋白CchiCSP8与不同配体对接过程中的关键氨基酸残基Table 2 Key amino acid residues of the recombinant CchiCSP8 during the docking to different ligands
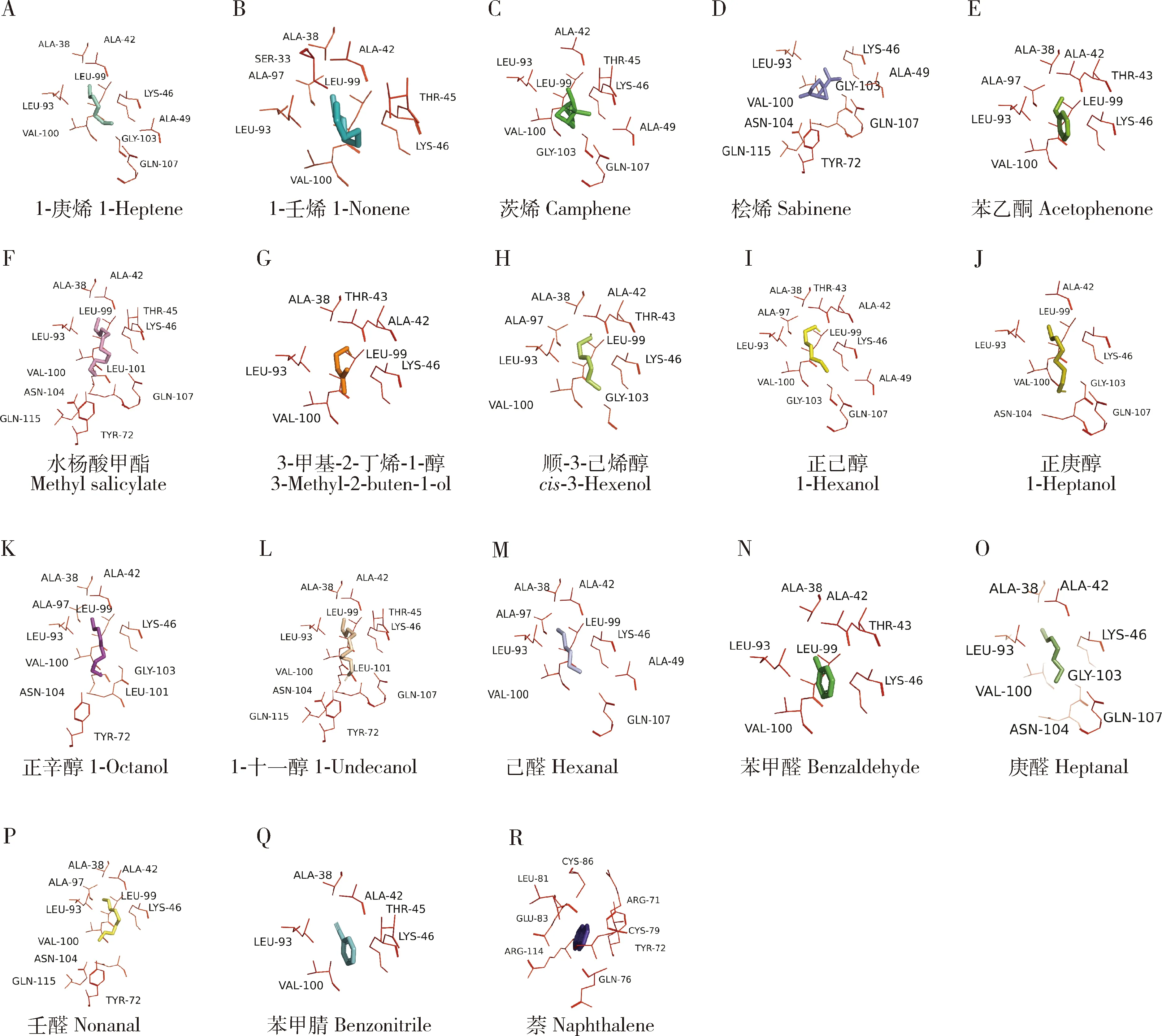
图6 重组蛋白CchiCSP8与不同配体相互作用的关键氨基酸残基Fig. 6 Key amino acid residues of the recombinant CchiCSP8 interacting with different ligandsA-D: 烯烃Alkenes; E: 酮Ketone; F: 酯Ester; G-L: 醇Alcohols; M-P: 醛Aldehydes; Q-R: 芳香类Aromatics.
3 讨论
同其他昆虫一样,梨木虱搜寻并取食梨树枝叶会借助其精细发达的嗅觉感受系统,这其中主要依赖于嗅觉蛋白和梨树挥发物的识别互作,而CSP则是确保梨木虱这一行为准确发生的重要保障。本研究在前期基础上,克隆了CchiCSP8的全长ORF序列,其编码的氨基酸具有信号肽序列,4个保守的半胱氨酸,表明CchiCSP8具有昆虫CSP的典型特征(Wanneretal., 2004)。结合进化树分析的结果也再次证实CchiCSP8属于昆虫CSP家族,在梨木虱定位梨树过程中可能存在重要作用。随后,我们借助大肠杆菌原核表达、包涵体复性、镍磁珠纯化等技术得到了高纯的CchiCSP8蛋白,与荧光探针1-NPN的结合检测也表明CchiCSP8蛋白具有与天然蛋白一致的活性,因此可以用于分析其与不同梨树挥发物结合特征的荧光竞争结合检测。
植食性昆虫在寻找寄主植物、产卵地点、合适配偶和躲避天敌等过程中,必须应对复杂的外界气味环境。研究发现,喀木虱属Cacypsylla侵染梨树后能够诱导梨树释放挥发性化合物水杨酸甲酯,这一物质能够引诱欧原花蝽Anthocorisnemorum(Drukkeretal., 1995; Scutareanuetal., 2003);对于处于交配时期的梨小食心虫Cydiamolesta雌蛾,顺-3-己烯基乙酸酯、顺-3-己烯醇和苯甲醛按照4∶1∶1人工合成的混合物与寄主挥发的混合物具有相似的引诱效果(Nataleetal., 2003);壬醛和苯甲醛对苹果蠹蛾Cydiapomonella的幼虫有驱避作用(Vallat and Dorn, 2005);微量挥发的苯甲腈能够吸引处于交配期的梨小食心虫雌蛾(Pieroetal., 2008);梨树挥发物1-己醇、己醛、庚醛、壬醛、苯甲醛和萘对梨小食心虫具有一定的引诱作用(Luetal., 2012; Najar-Rodriguezetal., 2013)。这些发现表明植物挥发物能够影响植食性昆虫定位寄主的行为,包括引诱、驱避作用等(Meiners, 2016)。
本研究选取了41种梨树挥发物进行荧光竞争结合实验分析,CchiCSP8与其中的18种配体物质表现出不同的结合能力,表明CchiCSP8在梨木虱识别梨树挥发物的过程中应当具有重要的作用。18种具结合力的物质中,醇类和芳香类物质均占所测定同类物质的66.67%,其次是醛类57.14%,酮类33.33%,烃类30.76%,而酯类占比最少为16.67%,表明CchiCSP8更趋向于结合醇和芳香类物质,而对酯类结合能力较弱,因此配体物质的官能团特征能够对CchiCSP8的结合力产生影响。相似的研究在其他昆虫的嗅觉蛋白研究中也有报道,如:苜蓿盲蝽AdelphocorislineolatusAlinCSP1-3对酸类不结合,可与其他类型官能团的物质结合(Guetal., 2012);铜绿丽金龟AnomalacorpulentaAcorOBP11只与酮、酯、烯、酸类结合,而不与醇和酚类物质结合(秦健辉等, 2021);白背飞虱SfurCSP5只与酮和萜烯类结合,而不与醇、醛、酯类物质结合(Chenetal., 2018)。此外,已有研究表明,配体物质的碳数能够影响物质与嗅觉蛋白的结合能力,如豌豆蚜AcyrthosiphonpisumApisOBP9对16个碳的醇和醛类物质具有高结合力(D′Onofrioetal., 2012),亦有研究发现昆虫嗅觉蛋白的结合能力与碳的数目之间不存在对应的线性关系(Lietal., 2016)。本研究发现CchiCSP8与配体的结合力表现出了随碳原子数不同而变化的特点,在同类物质中特别对1-壬烯(9C)、1-庚醇(7C)、己醛(6C)的结合力最高(图4),但未表现出明显的与碳原子数相关的线性关系,说明配体物质的官能团是影响CchiCSP8结合能力的关键因素,同时也表明CchiCSP8在梨木虱体内具有选择识别不同梨树挥发物的能力,可能会与梨木虱其他CSP协同作用以帮助梨木虱准确区分不同的气味物质,确保做出及时正确的行为反应。
为更好阐释CchiCSP8与上述18个配体物质的结合特性,本研究借助同源建模和分子对接的方法分别分析了CchiCSP8与不同配体相互作用时的结合自由能和关键氨基酸类别,结果显示,所有结合自由能均为负值,这与已报道的斜纹夜蛾(Liuetal., 2012)、苹果蠹蛾(Tianetal., 2016)、桃小食心虫Carposinasasakii(刘孝贺等, 2021)、二点委夜蛾Athetislepigone(Zhangetal., 2020a, 2020b)、白背飞虱(Chenetal., 2018)等其他昆虫嗅觉蛋白类似,表明CchiCSP8与18个配体之间均存在较强的相互作用力。已有很多研究证实昆虫OBP或CSP常通过其疏水性结合腔内的极性或非极性氨基酸残基与不同配体物质进行相互作用(Fuetal., 2018; Heetal., 2019; Liuetal., 2019; Wenetal., 2019; Yangetal., 2019; Zhang XQetal., 2020; Zhang CNetal., 2021)。基于CchiCSP8与所有18个配体物质的结合特性分析,我们也发现CchiCSP8中也有一些重要的极性或非极性氨基酸残基应当参与了其与配体物质的结合过程,这表明CchiCSP8与配体的结合机制与其他昆虫OBP或CSP的(Tianetal., 2016; Chenetal., 2018; Zhangetal., 2020b; 刘孝贺等, 2021)相似。值得注意的是,CchiCSP8中的一些氨基酸残基,如非极性氨基酸丙氨酸A38、丙氨酸A42、亮氨酸L93、亮氨酸L99和缬氨酸V100以及极性残基谷氨酰胺Q107和赖氨酸K46均可以结合多个不同的配体物质,表明这些残基应当在CchiCSP8识别配体过程中发挥重要的作用。因此,本课题组计划今后将这些残基作为研究重点,综合借助CRISPR/Cas9基因编辑(Zhuetal., 2016, 2019)和定点突变(Zhangetal., 2019, 2020b)等技术深入解析关键残基突变后对CchiCSP8配体结合能力的影响情况。
综上,CchiCSP8能结合18种梨树挥发物,表明该蛋白可能参与梨木虱对梨树挥发物的识别过程。分子对接发现有7个氨基酸残基可能是CchiCSP8与配体物质相互作用的关键氨基酸残基。研究结果可为明晰梨木虱在定位梨树过程中的嗅觉机制提供理论基础,并为开发基于扰乱嗅觉行为的新型梨木虱行为调控技术提供新思路。
