以β-半乳糖苷酶脂质体为模型筛选冷冻干燥保护剂的新方法
2022-08-12王保卫马婷婷
张 寅,王保卫,马婷婷
(石家庄市食品药品检验中心,河北石家庄 050000)
脂质体是一种人工制备的磷脂类生化物质,与细胞膜结构类似,具有典型的双亲分子特性,亲水性溶质不能轻易穿过磷脂双分子层,所以脂质体经常被视为理想的人工细胞膜模型。
真空冷冻干燥法由于其包装、运输以及保存上独特的优点,而成为一种有效的菌株保藏方法,而且此方法非常适合长期保藏乳制品及食品发酵剂中的乳酸菌(LAB)。但是如果不添加冷冻干燥保护剂,冻干保藏的细胞很容易失去其自身的活力。研究表明,若直接对乳酸菌进行冷冻干燥,其死亡率将达90%以上。冷冻干燥造成细胞损伤的原因主要包括冰晶形成、盐浓度升高、活性氧自由基(ROS)增加和细胞膜透性改变等。而细胞膜的损伤则被认为是造成细胞在冷冻干燥过程中死亡的主要原因。对于绝大多数菌株来说,冷冻干燥保藏法成功的关键在于有效保护剂的使用。研究证明,一些多糖和双糖(如海藻糖和透明质酸)能够在冷冻干燥时对菌株起到保护作用。冻干保护剂可以改变菌株冷冻干燥时的物理化学环境,减轻或抑制冷冻干燥或复水对细胞膜的损害,保护蛋白的结构及其生理活性,尽可能保持菌株原有的各种生理生化特性和生物活性。不同的保护剂有着各自的特点,使用单一的保护剂不足以为菌株提供抵抗外界恶劣环境的条件。因此,在乳酸菌(LAB)的冷冻干燥保存过程中,复配保护剂的使用效果优于单一保护剂的使用效果。但是,目前依然采用极其复杂的方法筛选合适的乳酸菌冷冻干燥保护剂,效率极低,耗费了大量的人力物力。该研究首次提出一种可以快速筛选出最优冷冻干燥保护剂的方法,以便于在冷冻干燥保藏时有效保存LAB发酵剂的活性。试验选取最佳的条件制备脂质体,并以脂质体包埋β-半乳糖苷酶作为细胞膜模型,添加不同的冷冻干燥保护剂,然后对其进行冷冻干燥保存。通过测定β-半乳糖苷酶渗透速度,评价不同冷冻干燥保护剂在冻干条件下对脂质体的保护效果,并选取瑞士乳杆菌9(LH-9)对上述试验结果进行验证,从而确定此快速筛选方法的可行性。
1 材料与方法
试剂。邻硝基苯β-D-半乳吡喃糖苷(ONPG)、大豆卵磷脂、β-半乳糖苷酶、胆固醇、十八胺,以上试剂均购自Sigma-Aldrich公司(St.Louis,MO);海藻糖、透明质酸(HA)、氯仿、Tris溶液、10×磷酸盐缓冲溶液(PBS),以上试剂均购自Fisher Scientific公司(Pittsburgh,PA);带Formva膜的40目铜网;牛血清白蛋白、葡聚糖凝胶G-200,均为分析纯。
设备。旋转蒸发器,R-201,上海申顺生物科技有限公司;超声波清洗器,KQ-500E,昆山市超声仪器有限公司;超声波细胞粉碎机,JAC-IV型,济宁市奥波超声波电气有限公司;Zetasizer Nano ZS90激光粒度仪,马尔文帕纳科技公司;TEM-1010透射电子显微镜,日本电子公司;自动液相色谱分离层析仪,MC99-3,上海沪西分析仪器厂有限公司;紫外分光光度计,752SPECTROPHOTOMETER,美谱达仪器;真空冷冻干燥仪,FD-1,北京德天佑科技发展有限公司;差式扫描量热仪,DSC821,瑞士梅特勒-托利多集团。
菌株。瑞士乳杆菌菌株(9),来自中国工业菌种保藏中心(CICC)。
β-半乳糖苷酶脂质体的制备。卵磷脂和十八胺按10∶1的摩尔比例混合,共计45 μmol,溶于20 mL氯仿中,混合均匀。将混合液体置于50 mL的圆底烧瓶中,并以6 r/min的转速在37 ℃以下对其进行旋转蒸发,直至脂质在瓶壁形成薄膜。然后,在圆底烧瓶中分别加入30 mL氯仿和乙醚,溶解脂质薄膜。在超声的条件下,加入含有β-半乳糖苷酶(1 290 μg/mL)的磷酸钠缓冲液(20 mmol/L,pH 7.0)20 mL。持续超声60 min后,再次对其进行旋转蒸发,除去剩余的氯仿和乙醚,直到形成O/W型乳剂,即可得到脂质体。O/W型乳剂通过超声波细胞粉碎机进行均质处理之后,便会形成粒径均匀的单层脂质体。
最佳超声条件。制备少量的单层脂质体,需确定其合适的超声条件。根据均质机工作时的超声时间和超声功率确定4种制备β-半乳糖苷酶脂质体的超声处理条件(表1)。
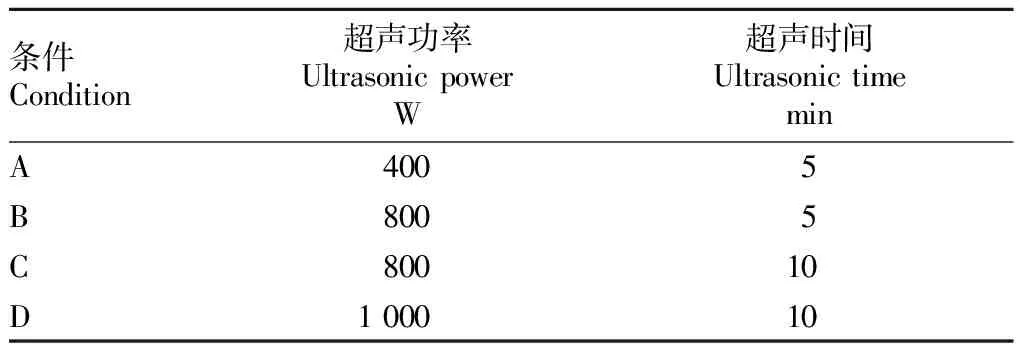
表1 β-半乳糖苷酶脂质体的超声处理条件
β-半乳糖苷酶脂质体的观察。用TEM1010透射电子显微镜观察复染的β-半乳糖苷酶脂质体形貌。样品制备方法:将稀释3倍的β-半乳糖苷酶脂质体混悬液滴于有Formva膜的400目铜网上,用滤纸吸去多余的液体,滴加2%的磷钨酸水溶液进行复染色。然后取出铜网,将其正面朝上置于玻璃皿中,室温下晾干着色。2 min后,用滤纸吸去多余的液体,在透射电子显微镜下仔细观察并照相。
颗粒大小、粒径分布和Zeta电位的测定。使用ZS90激光粒度仪对β-半乳糖苷酶脂质体的颗粒大小、粒径分布和Zeta电位进行表征。首先,用蒸馏水稀释β-半乳糖苷酶脂质体混悬液。然后取2~5 mL样品,注入固定的比色皿中,放入ZS90激光粒度仪中,在25 ℃条件下进行检测。经过4种不同超声条件处理过的β-半乳糖苷酶脂质体,需要分别进行检测。
菌株的培养。使用LH-9验证β-半乳糖苷酶脂质体模型筛选出的冷冻干燥保护剂对菌株冻干保藏的保护效果。将冷冻干燥的LH-9接种在12%的灭菌脱脂乳中,37 ℃下厌氧培养至凝乳。取1%的凝乳放入MRS液体培养基中,37 ℃下厌氧培养24 h。然后将其在6 000 r/min、4 ℃条件下离心15 min获取细胞,备用。
LH-9与β-半乳糖苷酶脂质体的冷冻干燥。选取海藻糖、透明质酸以及海藻糖和透明质酸(HA)的复配体系作为菌株的冷冻干燥保护剂,分别与LH-9和β-半乳糖苷酶脂质体混合。冻干保护剂以及它们的浓度如表2所示。所有的样品都要先在-45 ℃条件下冻存不少于120 min,然后将冷冻的样品放置于冷冻干燥机中真空冻干20 h。冻干后的样品(粉末)装入密封的低温瓶中,于-20 ℃保存备用。
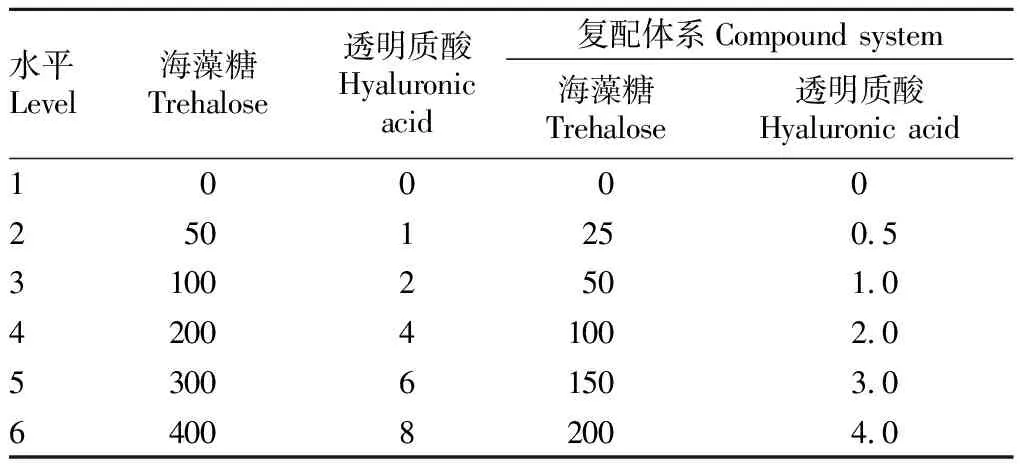
表2 冷冻干燥保护剂及其浓度
溶解冻干β-半乳糖苷酶脂质体,取脂质体悬浮液1 mL过Sephadex-G200凝胶柱,脂质体纯化,收集未包封的β-半乳糖苷酶,采用考马斯亮蓝法,测量其中蛋白质浓度。取1 mL样品于比色管中,准确加入5 mL的G-250染色液,混合均匀,静置5 min后于595 nm处测定其吸光度。根据以下公式计算脂质体中β-半乳糖苷酶的包封率:

对冻干的菌粉进行复溶,15 min后,在6 000 r/min、4 ℃条件下离心15 min,收集菌体。收集的菌体用0.89%的NaCl缓冲液清洗后,再次离心。离心所得菌体沉淀中加入30 mL的缓冲液,然后对菌体细胞进行超声破碎处理。破碎条件:超声1 min,间歇0.5 min,共破碎30 min。最后,采用吸光光度法测定悬浮液中β-半乳糖苷酶的酶活力。根据以下公式计算复溶后瑞士乳杆菌9(LH-9)β-半乳糖苷酶的酶活力保存率:

观察LH-9冻干时的形态。将LH-9冻干粉固定于样品台上,真空下表面喷金。用透射电子显微镜观察冷冻干燥条件下菌体的形态特征。
玻璃化温度的测定。使用DSC821差式扫描量热仪分别测定添加海藻糖、透明质酸以及复配体系冻干保护剂的LH-9冻干粉的玻璃化温度。所谓的玻璃化温度是指无定型聚合物(包括结晶型聚合物中的非结晶部分)由玻璃态向高弹态或者由后者向前者的转变温度。玻璃化温度的测定方法:取含有不同保护剂的LH-9冻干菌粉10 mg放入铝质样品盘中,以铝质空盘作为对照,在氮气环境下进行扫描。氮气流量为50 mL/min,扫描的温度是-20~200 ℃,升温速率为5 ℃/min。根据Ozato等的方法计算其玻璃化温度。
所有试验重复3次。3个数据点用于计算标准偏差,并通过误差线来表示不确定性。数据使用单因素方差分析。均值之间的差异在SPSS软件中使用duncan检验。
2 结果与分析
脂质体的大小是评价脂质体形成最重要的指标。测定的脂质体直径、分散系数和Zeta电位如表3所示。已有研究表明,脂质体在形成过程中有聚集的倾向。低浓度时,脂质体聚集趋势不明显;随浓度升高,脂质体聚集趋势明显增强,导致更大的聚合体的形成。一般来说,脂质体的平均直径、分散系数和Zeta电位越小,脂质体的稳定性越好。该试验中,在条件C(800 W超声功率,10 min)下脂质体的平均直径、分散系数和Zeta电位最小,脂质体的稳定性最好。最后,用TEM-1010透射电子显微镜观察包埋β-半乳糖苷酶脂质体在条件C(800 W超声功率,10 min)下的破碎情况,结果如图1所示,脂质体呈现为圆形,由TEM照片可估计出脂质体的平均粒径分布在100~200 nm。
冷冻干燥过程中,非晶相的玻璃化温度对于长期储存的微生物活性有至关重要的影响。一般来说,长期处于稳定生长状态的微生物的玻璃化温度高于其贮藏期间的玻璃化温度。利用差示扫描量热法(DSC)检测添加不同保护剂冻干菌粉的玻璃化温度,扫描结果如图2所示。其中,透明质酸保护剂体系的玻璃化温度最高,是140 ℃。海藻糖保护体系玻璃化温度最低,是125 ℃。不同类型的保护剂对冻干菌粉的玻璃化温度有不同的影响。
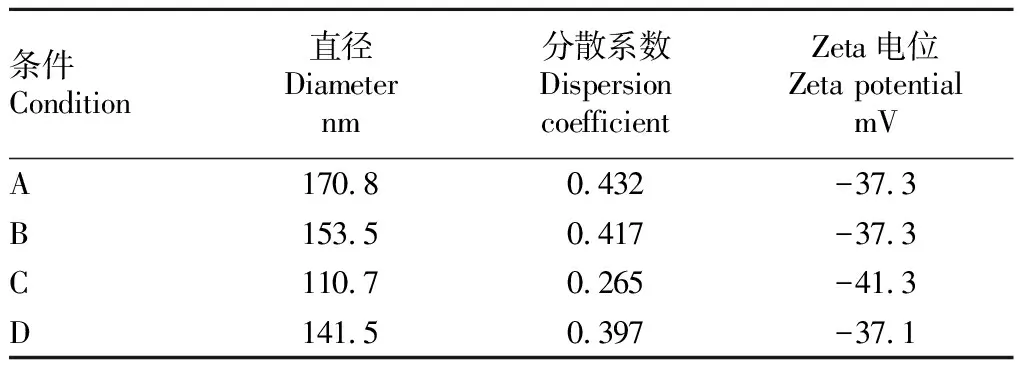
表3 不同超声破碎条件下脂质体悬液的特性
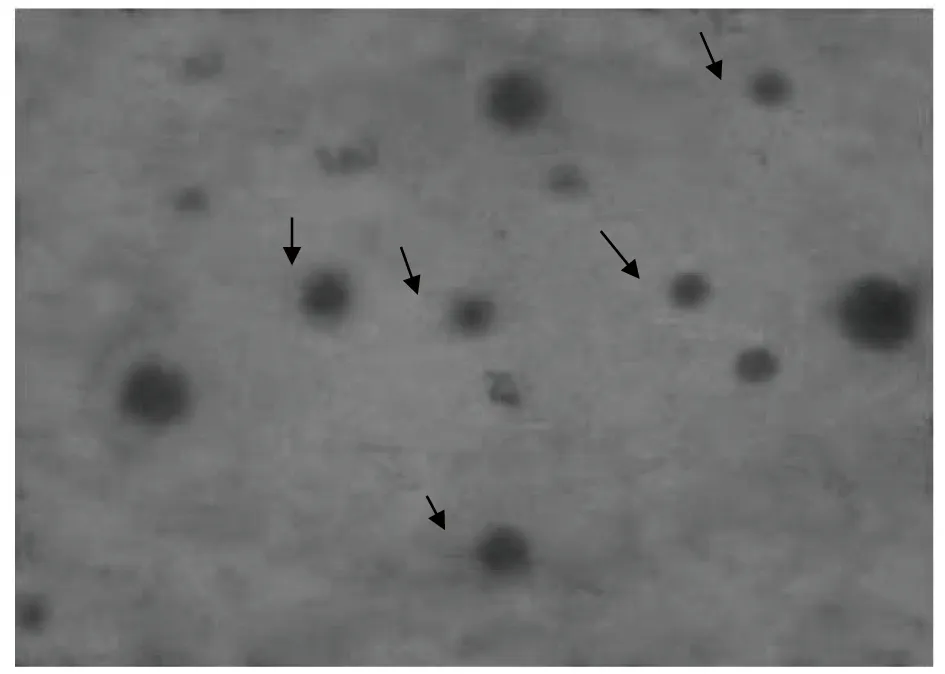
图1 脂质体投射电镜照片(×4 000)Fig.1 TEM images of liposome
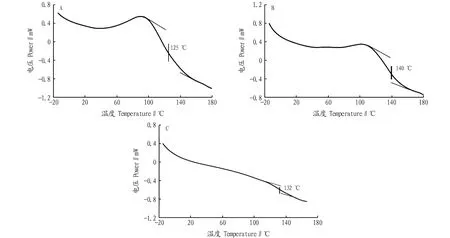
注:A.海藻糖;B.透明质酸;C.海藻糖和透明质酸的复配体系Note:A.Trehalose;B.Hyaluronic acid;C.Trehalose and hyaluronic acid mixture图2 冷冻干燥保护剂的玻璃化温度Fig.2 Glass transition temperature of freeze-drying cryoprotectants
在乳酸菌冷冻保藏过程中,选择海藻糖和透明质酸作为冻干保护剂来提高冻干菌粉的存活率。冻干保护剂的影响结果如图3所示,海藻糖浓度是200 mg/mL时,LH-9 β-半乳糖苷酶的酶活保存率最高,为87.7%;脂质体β-半乳糖苷酶的包封率最高,为55.28%。透明质酸浓度是6 mg/mL时,LH-9 β-半乳糖苷酶的酶活保存率最高,为81.36%;脂质体β-半乳糖苷酶的包封率最高,为50.79%。100 mg/mL海藻糖和2.0 mg/mL透明质酸复配使用(复配体系4)时,LH-9 β-半乳糖苷酶的酶活保存率最高,为83.21%;脂质体β-半乳糖苷酶的包封率最高,为55.35%。从图3可以看出,在达到最大值之前,保存率和包封率都随着保护剂浓度的增加而升高;最大值之后,随着保护剂浓度的增加而降低。脂质体包封率和LH-9酶活保存率的统计结果表明,最佳浓度时冻干保护剂的保护效果与空白对照组(0 mg/L)差异显著。冷冻干燥保护剂的影响结果表明,脂质体包封率和LH-9酶活保存率随保护剂浓度的升高有相同的变化趋势。由此可见,利用脂质体模拟细胞膜筛选乳酸菌冷冻干燥保护剂的方法是可行的。
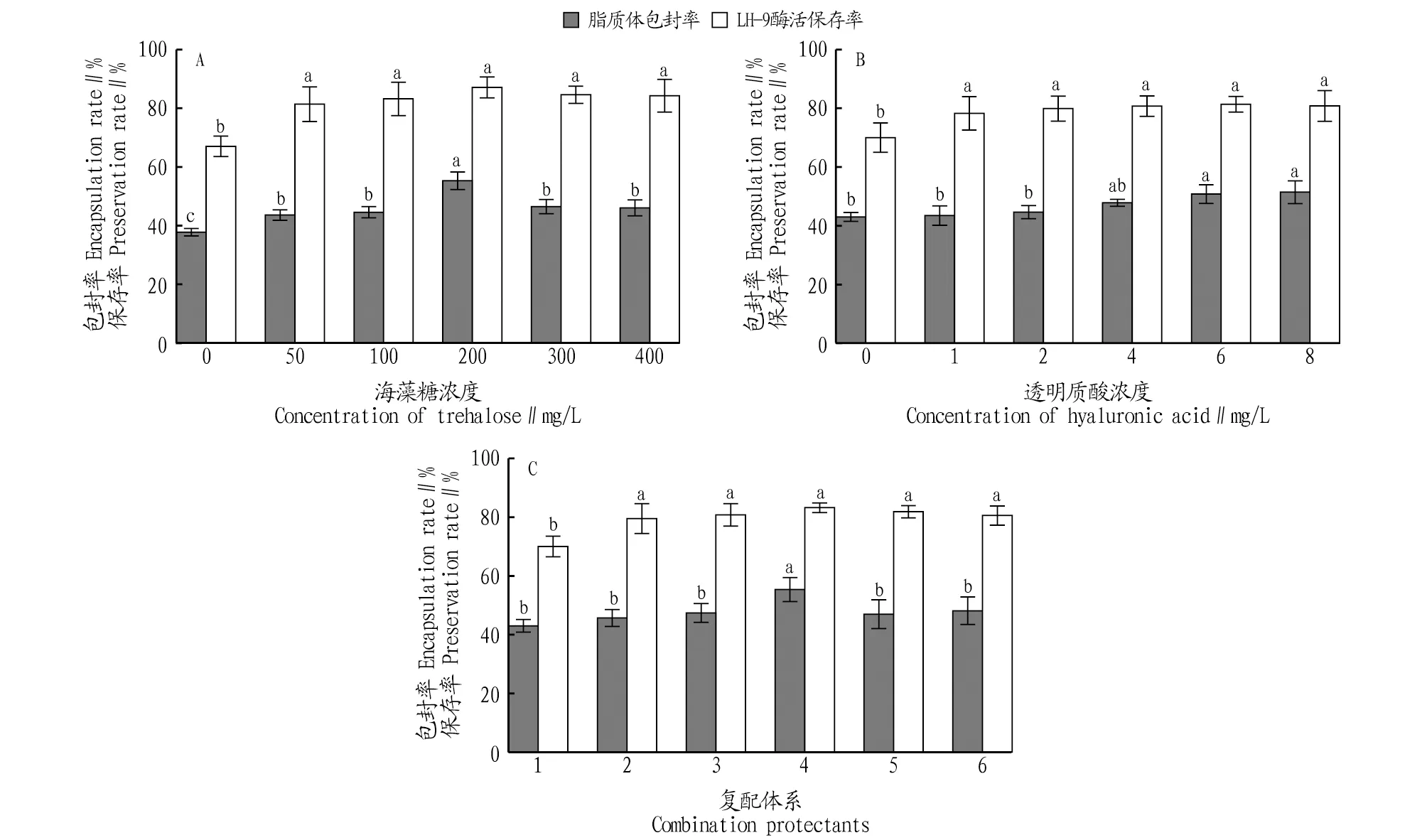
注:不同小写字母表示Duncan检验差异显著(P<0.05)Note:Different lowercase letters indicate significant differences in Duncan’s test(P<0.05)图3 不同浓度海藻糖(A)、透明质酸(B)和复配体系(C)的LH-9 酶活保存率和脂质体β-半乳糖苷酶包封率Fig.3 LH-9 enzyme activity preservation rate and liposomal β-galactosidase encapsulation rate of different concentrations of trehalose(A),hyaluronic acid(B)and compound system(C)
3 讨论与结论
冷冻干燥技术作为有效的菌种保藏手段,在工业生产上有广泛的应用。而冻干保护剂的筛选工作作为冷冻干燥保藏技术的关键所在,决定着保藏菌株活力的大小。可是,目前所采取的保护剂的筛选方法耗费大量人力物力,阻碍了菌种保藏技术的发展。该试验尝试以β-半乳糖苷酶脂质体的直径、分散系数和Zeta电位为检测指标,联合透射电子显微镜法,创建一种利用脂质体模拟细胞膜筛选冷冻干燥保护剂的模型,从而快速筛选出瑞士乳杆菌冷冻干燥保护剂,有效提高乳酸菌冻藏菌种的活性。
截至目前,在使用脂质体模拟细胞膜来承载药物、基因和植物杀虫剂等方面已经进行了大量的研究。但是利用脂质体包埋β-半乳糖苷酶模拟细胞膜来筛选乳酸菌冻干保护剂的相关研究鲜见报道。该试验以β-半乳糖苷酶脂质体的直径、分散系数和Zeta电位为检测指标,建立并优化了脂质体细胞膜模型,结果表明,建立的脂质体细胞膜模型在性质上与真实的细胞膜一样,而且稳定性较高。然后将β-半乳糖苷酶脂质体与冻干保护剂混合冻干,从而以脂质体β-半乳糖苷酶的包封率和瑞士乳杆菌9(LH-9)β-半乳糖苷酶的酶活保存率为指标评价冻干保护剂的保护效果,结果显示,海藻糖和透明质酸的复配体系作为冷冻干燥保护剂时对冻干菌粉有最佳的保护效果;而且LH-9玻璃化温度测定所得到的数据以及LH-9形态特征的评价也证明了这一结果。
已有研究表明,冷冻干燥对微生物造成破坏的原因主要有2个:①细胞膜机械损伤;②细胞中敏感蛋白的结构破坏。截至目前,冷冻干燥保护剂在乳酸菌冻干保藏过程的保护机理尚不明确。但是也有研究表明,冻干保护剂之所以可以保护微生物活性,是由于冻干保护剂在微生物冷冻干燥保藏过程起到了“玻璃化”和“水置换”的作用。该试验关于利用脂质体包埋β-半乳糖苷酶模拟细胞膜筛选冻干保护剂的研究成果,为今后乳酸菌冻干保护剂的筛选研究工作带来了新的思路。但是这种方法仍然存在许多问题,需要对其进行更加深入细致的研究。
