18F-FDG PET/CT 对化疗中期弥漫性大B 细胞淋巴瘤患者预后判断的价值
2022-08-10刘文静赵新明吴冯春
刘文静 赵新明 吴冯春
河北医科大学第四医院核医学科,石家庄 050011
弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤最常见的类型之一,近年来,利妥昔单抗的使用在一定程度上改善了患者的预后。但是,由于DLBCL 具有较高的异质性,部分患者预后较差,目前仍有30%~40%的患者在治疗过程中出现疾病进展或复发[1]。18F-FDG PET/CT 具有分子影像和解剖结构显像的双重优势,广泛应用于淋巴瘤的诊断、分期、疗效监测和预后评估。已有不少研究结果证实,PET/CT Deauville 评分对化疗中期DLBCL 患者的生存有预测价值[2-4]。 PET/CT 代谢参数中, SUVmax、全身所有病灶总的代谢肿瘤体积(total metabolic tumor volume, TMTV)、总 的 糖 酵 解 总 量(total of total lesion glycolysis, TTLG)对DLBCL 患者预后的预测价值一直是研究的热点,但是,对于化疗中期的评估结果仍存在争议[5]。本研究通过分析18F-FDG PET/CT 参数及临床相关因素与化疗中期DLBCL患者无进展生存(progress-free survival, PFS)期和总生存(overall survival, OS)期的关系,探讨临床因素和18F-FDG PET/CT 代谢参数及解剖测量参数对DLBCL 患者预后判断的价值。
1 资料与方法
1.1 一般资料
回顾性分析2011 年1 月至2020 年1 月于河北医科大学第四医院经组织病理学检查确诊的112 例DLBCL 患者的临床资料和影像学资料,其中男性60 例、女性52 例,年龄16~79(49.5±16.6)岁。所有患者均进行了3~4 个周期化疗,其中采用利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松(R-CHOP)方案治疗29 例、利妥昔单抗+依托泊苷+强的松+长春新碱+环磷酰胺+表柔霉素(R-EPOCH)方案治疗22 例、利妥昔单抗+环磷酰胺+脂质体阿霉素+长春新碱+强的松(R-CDOP)方案治疗40 例、其他方案治疗21 例。纳入标准:(1)经组织病理学检查确诊为DLBCL;(2)经3~4周期化疗后(中期)行18F-FDG PET/CT 检查;(3)临床数据和影像学资料完整。排除标准:(1)转化型DLBCL 或组织病理学不能分型者;(2)伴有其他恶性肿瘤或严重慢性疾病;(3)中期PET/CT 检查前行手术切除病灶者。
所有患者均签署了知情同意书。本研究已获得河北医科大学第四医院伦理委员会的批准(批准号:2022KY228)。
1.2 显像方法
应用荷兰Philips 公司GEMINI GXL16 PET/CT显像仪,18F-FDG 由河北安迪科正电子技术有限公司提供,放射化学纯度>95%。患者检查前禁食禁水6 h 以上,测量身高(cm)、体重(kg),空腹血糖水平控制在8 mmol/l 以下。按体重经静脉注射18F-FDG,剂量为3.70~5.55 MBq/kg(0.10~0.15 mCi/kg)。患者安静休息60 min 后,排空膀胱上机检查。扫描期间患者取仰卧位,双臂上举,扫描范围自颅底至双侧股骨上段。先进行螺旋CT 扫描,采集条件:管电流160 mA、管电压120 kV、矩阵512×512、螺距0.813、层厚5 mm、球管单圈旋转时间0.5 s;CT 图像采用标准重建法,重建层厚为5 mm。PET采集条件: 三维模式采集,共采集8~10 个床位,2.5 min/床位。应用CT 数据进行衰减校正,校正后的PET 图像与CT 图像融合,最终得到横断面、矢状面和冠状面的PET、CT 及PET/CT 融合图像。PET 图像处理应用荷兰Philips 公司的Extended Brilliance TM workspace 软件以及Medex 工作站,并将图像导入LEFX 软件进行代谢参数的相关测量。
1.3 图像分析
由3 位具有5 年以上工作经验的核医学科医师进行图像处理分析。先经最大密度投影图(MIP)初步判断显像剂在全身的分布情况,然后从横断面、冠状面和矢状面观察病灶位置、形态、大小及代谢情况。以SUVmax的40%(40%SUVmax)为阈值勾画ROI,获得病灶的SUVmax、TMTV 和TTLG;在CT 图像上测量6 个靶病灶最大垂直径乘积之和(sum of products of greatest diameters, SPD)。依据Deauville 评分[6]:病灶18F-FDG 摄取不超过背景放射性分布为1 分;残留病灶18F-FDG 摄取≤纵隔血池摄取为2 分;纵隔血池残留病灶18F-FDG 摄取≤肝血池摄取为3 分;任何部位病灶18F-FDG 摄取相对于肝血池摄取有轻度或中度增高为4 分;任何部位的残留病灶18F-FDG 摄取相对于肝血池摄取有显著增高(SUVmax>2 倍肝血池摄取或出现新发病灶)为5 分;新发病灶有18F-FDG 摄取,但与淋巴瘤无关的记为X。1~3 分为PET/CT 阴性(阴性组),4~5分及X 为PET/CT 阳性(阳性组)。
1.4 随访
随访起始时间为患者第一次行PET/CT 显像日期,截止时间为2020 年12 月31 日。以PFS 期和OS 期为研究终点。PFS 期定义为从疾病确诊日期到出现疾病进展、复发、疾病相关死亡或至随访截止日期。OS 期定义为从疾病确诊日期至患者死亡或随访截止日期。通过面谈、电话以及查阅患者在本院诊治信息等方式进行随访,随访内容主要包括患者的症状、体征、影像学检查、实验室检查以及组织病理学检查、免疫学检查等。
1.5 统计学处理
应用IBM SPSS Statistics 21 软件进行统计学分析。将所有连续变量均转化为二分类变量。以出现疾病进展和死亡为阳性事件,根据ROC 曲线计算PET/CT 代谢参数和解剖测量参数SUVmax、TMTV、TTLG 和SPD 预测预后的最佳临界值,AUC>0.5且P<0.05 的参数对患者预后有意义。采用Kaplan-Meier 法对患者的PFS 期和OS 期进行生存分析。单因素分析采用Log-rank 检验;多因素分析采用Cox 比例风险模型。P<0.05 为差异有统计学意义。
2 结果
2.1 临床特征
112 例DLBCL 患者中,Ⅰ期和Ⅱ期50 例,Ⅲ期和Ⅳ期62 例;乳酸脱氧酶(lactate dehydrogenase,LDH)水平升高者55 例,LDH 水平正常者57 例。其他临床特征见表1。患者无失访,中位随访时间为36(6~93)个月。112 例DLBCL 患者中,25 例(22.3%)出现疾病进展、14 例(12.5%)死亡。

表1 112 例化疗中期DLBCL 患者PFS 期和OS 期的临床特征分析Table 1 Analysis of clinical characteristics of progress-free survival and overall survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
2.2 18F-FDG PET/CT 参数预测化疗中期DLBCL 患者PFS 期和OS 期的临界值
由表2 可知,18F-FDG PET/CT 参数SUVmax、TMTV、TTLG、SPD 预测DLBCL 患者PFS 期的最佳界值分别为1.75、6.40 cm3、9.30 g 和3.53 cm2,AUC 分别为0.712、0.652、0.680、0.728(95%CI:0.596~0.829、0.518~0.787、0.549~0.811、0.619~0.837,均P<0.05)。由表3 可知,18F-FDG PET/CT 参数SUVmax、TMTV、TTLG、SPD预测OS 期的最佳临界值分别为3.75、17.80 cm3、19.05 g 和5.67 cm2,AUC 分别为0.727、0.686、0.727、0.757(95%CI:0.578~0.877、 0.512~0.861、 0.559~0.896、 0.622~0.891,均P<0.05)。

表2 18F-FDG PET/CT 参数预测112 例化疗中期DLBCL 患者PFS 期的临界值Table 2 Cut-off values of 18F-FDG PET/CT parameters for predicting progress-free survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy

表3 18F-FDG PET/CT 参数预测112 例化疗中期DLBCL 患者OS 期的临界值Table 3 Cut-off values of 18F-FDG PET/CT parameters for predicting overall survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
2.3 Deauville 评分对DLBCL 患者预后的生存分析
Deauville 评分结果显示,112 例DLBCL 患者中,4~5 分阳性组32 例,1~3 分阴性组80 例(其中1 分63 例、2 分7 例、3 分10 例),评分X 的患者0 例。如图1 所示,以PFS 期为研究终点,阳性组患者的PFS期与阴性组患者PFS 期比较,差异有统计学意义(P<0.001);以OS 期为研究终点,2 组OS 期的差异有统计学意义(P=0.009)。
2.4 影响DLBCL 患者PFS 期和OS 期临床预后因素的单因素分析
单因素分析结果显示,年龄、美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、国际预后指数(International Prognostic Index,IPI)评分、美国国家综合癌症网络-国际预后指数(NCCN-IPI)评分是DLBCL 患者PFS 期和OS 期的预后影响因素(均P<0.05);LDH 水平是OS 期的预后影响因素(P=0.042),但不是PFS 期的预后影响因素(P=0.136) (表1)。
2.5 18F-FDG PET/CT 参数对化疗中期DLBCL 患者PFS 期和OS 期的单因素分析
将18F-FDG PET/CT 代谢参数SUVmax、TMTV、TTLG 和解剖测量参数SPD 纳入单因素生存分析,结果显示,4 个参数均是DLBCL 患者PFS 期和OS 期的预后影响因素(均P<0.01,图2)。
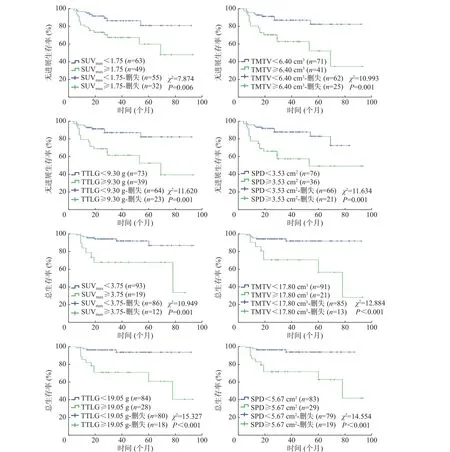
图2 18F-FDG PET/CT 参数对112 例化疗中期DLBCL 患者PFS 期和OS 期预后分析的Kaplan-Meier 生存曲线 FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;DLBCL 为弥漫性大B 细胞淋巴瘤;PFS 为无进展生存;OS 为总生存;SUVmax 为最大标准化摄取值;TMTV 为总的代谢肿瘤体积;TTLG 为总的糖酵解总量;SPD 为最大垂直径乘积之和Figure 2 Kaplan-Meier survival curves of 18F-FDG PET/CT parameters for progress-free survival and overall survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
2.6 DLBLC 患者预后的多因素分析
将单因素分析中对DLBCL 患者预后有统计学意义的临床因素和化疗中期18F-FDG PET/CT 参数进行多因素分析,结果显示:年龄、ECOG 评分、TTLG 是影响DLBCL 患者PFS 期的独立危险因素(均P<0.01,表4) ;SPD、LDH 水平是影响DLBCL患者OS 期的独立危险因素(均P<0.05,表5)。

表4 影响112 例化疗中期DLBCL 患者PFS 期的多因素分析Table 4 Multivariate analysis of progression-free survival of 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
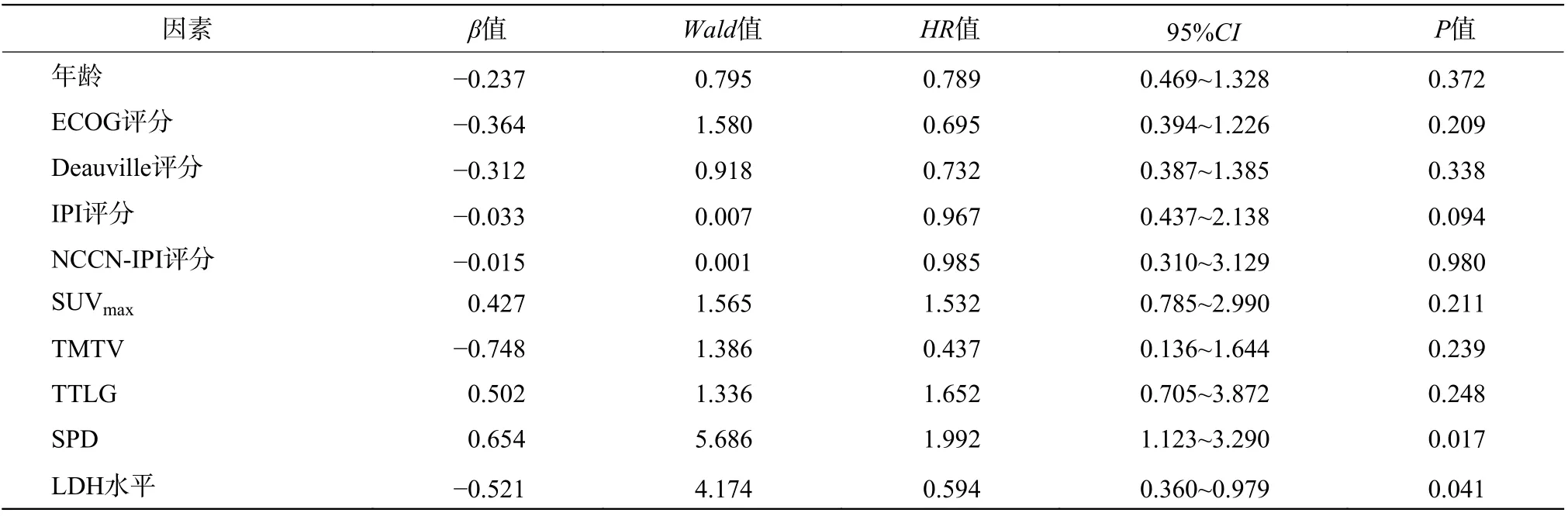
表5 影响112 例化疗中期DLBCL 患者OS 期的多因素分析Table 5 Multivariate analysis of overall survival of 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
3 讨论
DLBCL 是非霍奇金淋巴瘤最常见的类型之一,具有较高的异质性和较强的侵袭性,不同生物学特征对化疗反应的敏感性不同,部分化疗中期PET/CT 显像结果阳性的患者出现疾病进展或死亡,故需要结合临床、影像学、组织病理学特征及分子生物学特征等相关预后因素,对患者进行准确的危险分层和预后评估,帮助改善患者预后。目前,Deauville 评分和化疗中期PET/CT 多个代谢参数常被用于DLBCL 的预后评估[7-9]。Yim 等[7]的研究结果显示,Deauville 评分为5 分的患者较1~4 分的患者预后差,以Deauville 评分4 分为临界值,可以提高对患者的危险分层。本研究中,Deauville 评分阳性组中位PFS 期和OS 期均低于阴性组。Zucca等[9]研究基线和化疗中期PET/CT 代谢参数与DLBCL 患者预后的关系,结果显示,化疗中期PET/CT 参数SUVmax、代谢肿瘤体积(metabolic tumor volume, MTV)和糖酵解总量高临界值组患者预后较差;多因素分析结果显示,ΔSUVmax和基线MTV 为独立预后因素。Islam 等[10]评估化疗中期和治疗后PET/CT 代谢参数与DLBCL患者预后的关系,Kaplan-Meier 生存分析结果显示,全身所有病灶的TMTV 和TTLG均与患者的PFS 期密切相关;研究结果还表明,化疗中期PET/CT 代谢参数MTV 对治疗后MTV有一定的预测价值。本研究单因素分析结果显示, SUVmax、TMTV、 TTLG、SPD 对 DLBCL 患者 PFS 期和 OS 期均具有很好的预测价值,以最佳临界值为界,高 SUVmax、TMTV、TTLG 、SPD 组患者的预后较差。有研究结果表明,治疗前18F-FDG PET/CT 代谢参数糖酵解总量是影响Ⅱ~Ⅲ期DLBCL 患者PFS 期和OS 期的独立预后因素[11]。本研究多因素分析结果显示,年龄、ECOG 评分、TTLG 是影响DLBCL 患者PFS期的独立危险因素,LDH 水平和SPD 是影响OS期的独立危险因素。本研究中不同化疗方案的DLBCL 患者预后差异无统计学意义,分析原因在于:(1)纳入研究的病例多数都采用了联合化疗方案,缺乏单纯环磷酰胺+脂质体阿霉素+长春新碱+强的松(CHOP)方案与利妥昔单抗+环磷酰胺+脂质体阿霉素+长春新碱+强的松(R-CHOP)等方案之间的对比;(2)不同方案组的样本量较少;(3)本研究局限于化疗3~4 周期的中期患者的PET/CT,未研究化疗1~2 周期和5~8 周期的患者,可能导致患者之间的疗效差异较小。
Yim 等[7]将化疗3 周期后DLBCL 患者的中期PET/CT Deauville 评分与基线IPI 评分结合,将患者分为3 组:低风险组(Deauville 评分1~3 分和低/中低IPI 评分)、中风险组(Deauville 评分1~3 分和高/中高IPI 评分或Deauville 评分4~5 分和低/中低IPI 评分)和高风险组(Deauville 评分4~5 分和高/中高IPI 评分),结果显示,低风险组、中风险组、高风险组的5 年PFS 率分别为84.5%、58.7%、14.3%,这些结果提示结合化疗中期PET/CT 中的Deauville 评分和IPI 评分进行早期风险分层可以预测DLBCL 患者的疾病进展或死亡风险。我们单独分析了各因素对DLBCL 患者预后的判断价值,并未将不同因素两两结合研究对患者危险分层的判断价值,且纳入研究的PET/CT 参数较为局限,SUV峰值(SUVpeak)、病灶代谢率随时间变化率等与DLBCL 患者预后的关系将成为今后研究的重点。本研究为回顾性、小样本研究,随访时间较短,导致某些参数的高于最佳临界值组患者的PFS 期或OS 期与低于最佳临界值组患者的PFS 期和OS 期的差值较小,但差异均有统计学意义。本研究中,我们仅分析了PET/CT 代谢参数对化疗中期DLBCL患者预后的影响,未能分析治疗前后各参数的变化率与预后的关系,且未能对不同化疗周期(3 周期或4 周期)患者进一步分组,经过不同治疗周期的患者,化疗中期PET/CT 影像学表现不同,这可能是本研究中部分PET/CT 代谢参数预测患者预后灵敏度和特异度较低的原因。新的预后因素如分子生物学特征、B 细胞淋巴瘤2(BCL-2)基因、B 细胞淋巴瘤6(BCL-6)基因、细胞增殖核抗原Ki-67 表达和C-MYC 基因重排、免疫治疗相关的预后程序性死亡受体-1(PD-1)、程序性死亡配体-1(PD-L1)以及肿瘤微环境等与PET/CT 参数结合对DLBCL患者预后的影响越来越成为研究的热点。国外研究者认为,趋化因子受体4(CXCR4)表达是DLBCL患者预后不良的标志[12]。也有研究者发现,循环肿瘤DNA 水平与IPI 评分和TMTV 呈高度相关,此外,预处理循环肿瘤DNA 是DLBCL 患者的独立预后因素[13]。
综上所述,化疗中期DLBCL 患者的18F-FDG PET/CT 代谢参数SUVmax、TMTV、TTLG 和解剖测量参数SPD 对其预后具有一定的预测价值,年龄、ECOG 评分、TTLG 是影响DLBCL 患者PFS 期的独立危险因素;SPD、LDH 水平是影响DLBCL患者OS 期的独立危险因素。
利益冲突所有作者声明无利益冲突
作者贡献声明刘文静负责研究命题的提出与设计、数据的收集、统计与分析、病例的随访、论文的撰写与修改;赵新明负责研究命题的提出与设计、论文的审阅与最终版本的修订;吴冯春负责数据的收集、统计与分析、论文的修订
