TIPS联合PTVE治疗自身免疫性肝硬化曲张静脉出血疗效分析
2022-08-09吴军政施海彬周海峰周卫忠
吴军政,刘 圣,施海彬,杨 魏,田 伟,周海峰,周卫忠
南京医科大学第一附属医院介入放射科,江苏 南京 210029
典型的自身免疫性肝病(autoimmune liver dis⁃eases,AILD)包括原发性胆汁性肝硬化(primary bili⁃ary cirrhosis,PBC)、原发性硬化性胆管炎(prima⁃ry sclerosing cholangitis,PSC)和自身免疫性肝炎(au⁃toimmune hepatitis,AIH)3类。AIH的病理特点是肝细胞的损伤,而PBC 和PSC 则以损伤胆道上皮细胞为特征[1]。约10%的AIH 或PBC 患者兼具AIH 和PBC的临床特征,即PBC/AIH重叠综合征。AILD的病因及发病机制复杂,当前的研究尚未完全阐明,其诊断与治疗在临床上仍具有挑战性。
AILD 持续的慢性肝损伤会造成难以消除的炎症、细胞增殖和细胞外基质蛋白沉积,并逐渐进展至肝硬化[2]。肝硬化导致的门脉高压和/或肝功能障碍等相关并发症会导致患者的病情迅速恶化。约1/3的肝硬化失代偿患者会出现食管胃底曲张静脉破裂出血,出血的患者3 个月病死率高达35%,2年病死率高达70%[3]。过去几十年来,内镜下治疗被广泛应用并作为肝硬化食管胃底曲张静脉破裂出血的一线治疗措施。然而,内镜止血后1 年内再出血率高达60%,且部分大量出血患者无法行内镜止血[4]。经颈静脉肝内门体分流术(transjugular in⁃trahepatic portosystemic stent shunt,TIPS)可以通过降低门脉压力及术中联合曲张静脉栓塞(percutane⁃ous transhepatic variceal embolization,PTVE)有效地治疗食管胃底曲张静脉破裂出血[5-6]。然而,既往却鲜有TIPS 应用在AILD 后肝硬化患者的报道。因此,本研究通过回顾性分析探讨TIPS 联合PTVE 治疗AILD 后肝硬化患者食管胃底曲张静脉破裂出血的安全性和有效性。
1 对象和方法
1.1 对象
本研究回顾性分析了2015年8月—2021年9月南京医科大学第一附属医院收治的23 例由AILD 引起的肝硬化合并食管胃底静脉曲张破裂出血患者的临床资料。所有患者均符合以下标准:①根据临床特征、实验室、影像学及病理学检查确诊为AILD 引起的肝硬化(AIH、PBC 和PBC/AIH 重叠综合征分别根据国际自身免疫性肝炎的简化诊断标准[7]、2017 EASL 临床实践指南[7]和巴黎标准[9]进行诊断);②经内镜或选择性血管造影证实为首次或复发性食管胃底曲张静脉破裂出血;③保守和/或内镜治疗未能有效控制出血;④无肝移植适应证或患者拒绝肝移植。
本研究方案符合1975 年赫尔辛基宣言的伦理准则,并获得南京医科大学第一附属医院伦理委员会批准,所有纳入研究的患者均签署知情同意书。
1.2 方法
1.2.1 TIPS及PTVE
术前分析患者的增强CT 和/或MRI 影像学表现,明确肝静脉与门静脉的位置关系,并选择合适的术中穿刺路径。在麻醉评估后,对所有患者进行全身麻醉。通过肠系膜上动脉造影行间接门静脉造影。按Seldinger 法穿刺右颈内静脉,将穿刺套件(RUPS⁃100,Cook 公司,美国)置入肝静脉。在血管造影的引导下经肝实质穿刺肝内门静脉分支后,经导丝引入“猪尾巴”导管行直接门静脉造影并测定门静脉压力。根据术中造影显示的食管胃底曲张静脉的数量和大小,采用不同规格的弹簧圈、医用组织胶等材料将其完全栓塞。根据患者门静脉压力和血流动力学情况,选择不同直径的球囊扩张分流道(常规使用7 mm×80 mm球囊)。再根据分流道的长短,置入不同规格的TIPS专用支架(Viatorr,W L Gore&Asso⁃ciates公司,美国)。行门静脉造影,确保支架位置准确,展开良好,随后测量分流后门静脉压力(图1)。术后住院期间采用低分子肝素皮下注射抗凝,出院后继续口服利伐沙班抗凝治疗1 年。术后联合口服0.5 g熊去氧胆酸,每天1次,根据胆红素的复查结果调整用药。所有患者TIPS术后均因经济条件限制或个人选择未接受免疫治疗。
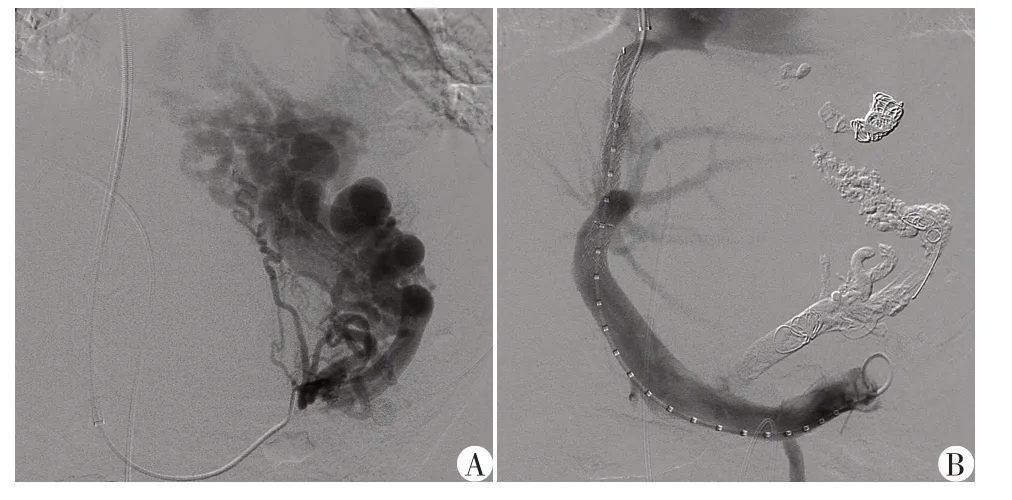
图1 1例59岁的PBC女性患者的术中造影Figure 1 Intra⁃operative fluoroscopy images of a 59⁃year⁃old female patient with PBC
1.2.2 并发症
并发症分为短期并发症和长期并发症。短期并发症定义为术后2周内发生的并发症。长期并发症定义为在后续随访中观察到的并发症。使用West Haven标准[10]进行肝性脑病的诊断和严重程度评估。其他并发症根据不良事件通用术语标准5.0(common terminology criteria for adverse events V5.0,NCI⁃CTCAE V5.0)进行评估,大于及等于Ⅲ级的定义为严重并发症。
1.2.3 研究终点
主要终点是患者的即刻出血控制率(术后1 d内无再出血)。次要终点是累计再出血率、总生存期和无再出血生存期。总生存期定义为患者从TIPS手术治疗到因任何原因死亡或最后1次随访的时间。无再出血生存期定义为患者从TIPS 手术治疗到出现曲张静脉出血事件或最后1 次随访的时间。如果患者随访直至死亡未发生曲张静脉出血事件,则认为无再出血生存期与总生存期的时间相同。此外,对术前及术后3个月的白蛋白水平、总胆红素、碱性磷酸酶(alkaline phosphatase,ALP)、γ⁃谷氨酰转肽酶(gamma⁃glutamyl transpeptidase,GGT)、国际标准化比值、Child⁃Pugh评分、终末期肝病模型(model for end stage liver disease,MELD)评分和腹水进行比较。腹水主要通过计算机断层扫描及腹部多普勒超声进行评估。
1.2.4 随访
所有患者均定期随访至2021 年12 月或直到患者死亡。术后第1、3、6、12个月进行门诊随访,然后每6个月门诊随访1次。随访内容包括患者的临床表现、肝肾功能、凝血功能、血氨水平、腹部增强CT检查。对疑似分流道或支架功能障碍的患者进行直接门静脉造影检查,当有明确分流道或支架功能障碍时,建议患者进行TIPS修正术治疗。
1.3 统计学方法
所有统计分析均使用SPSS22.0 版软件进行。计量资料均呈正态分布,数据以均数±标准差()表示,并采用配对t检验进行比较。生存曲线采用Kaplan⁃Meier法计算。P<0.05为差异有统计学意义。
2 结果
2.1 基线特征
共23例患者纳入本研究,包括男2例,女21例,年龄57~72岁,中位年龄64岁。所有患者的临床特征见表1。6 例、13 例和4 例患者分别诊断为AIH、PBC和PBC/AIH重叠综合征。

表1 23例自身免疫性肝病患者基线资料Table 1 Characteristics of 23 patients with AILD at admission
2.2 即刻出血控制率、再出血率、无再出血生存期和总生存期
即刻出血控制率为100%。术后1 d 内所有患者均无食管胃底曲张静脉复发出血。随访期间,3例患者再次出现食管胃底曲张静脉出血。1年、2年和3年的累计再出血率分别为9.6%、17.1%和17.1%(图2)。无再出血生存期为70~1 308 d,中位是境455 d。随访结束时,只有1 例患者死亡,死因为肝功能衰竭。1年、2年、3年的累计生存率分别为100%、91.7%和91.7%。中位总生存期为85~1 308 d,中位时间为611 d。

图2 23例患者累计再出血率的Kaplan⁃Meier分析曲线Figure 2 Kaplan⁃Meier overall re⁃bleeding rate curves of 23 patients
2.3 并发症
有2 例患者发生了严重的短期并发症。1 例患者术后2 d 出现腹腔出血,予以腹腔引流、补液、输血等保守治疗后,患者病情好转出院。另1 例患者在术后4 d 出现急性心功能不全,通过吸氧、强心、利尿对症治疗后同样好转出院。在其余21 例患者中,3例患者术后出现腹痛,但均为NCI⁃CTCAE 1级或2 级,经口服止痛药物后症状明显缓解。长期并发症共4 例,均为脑性脑病,1 例为West Haven Ⅲ级,另3例为West Haven Ⅱ级。经促通便、静脉输注及口服门冬氨酸鸟氨酸制剂治疗后,症状均改善。所有患者均无分流道或支架功能障碍。1例患者在手术后525 d死于肝功能衰竭。
2.4 门静脉压力、肝功能和腹水的变化
23 例患者TIPS 术前的门静脉压力为(39.4 ±7.2)mmH2O,TIPS 术后降至(27.8±5.4)mmH2O(P<0.05)。TIPS 术后3 个月,患者ALP 水平明显高于TIPS 术前[(198.2±94.8)U/Lvs.(137.0±65.3)U/L,P<0.05]。患者白蛋白水平、总胆红素、国际标准化比值、Child⁃Pugh 评分、MELD 评分术前和术后3 个月比较差异无统计学意义(表2)。15例在TIPS前有腹水的患者,术后3 个月,随访CT 检查显示其腹水基本吸收(图3)。

图3 1例64岁的AIH女性患者的腹部增强CT图像Figure 3 Enhanced CT images of a 64⁃year⁃old female patient with AIH
表2 患者TIPS术前及术后3个月检验指标比较Table 2 The comparison of clinical indicators in two groups preoperative and 3 months post⁃TIPS()

表2 患者TIPS术前及术后3个月检验指标比较Table 2 The comparison of clinical indicators in two groups preoperative and 3 months post⁃TIPS()
3 讨论
AILD是一种少见疾病,其病因及发病机制尚未完全阐明,限制了其诊断和治疗。对于已经进展至肝硬化失代偿合并曲张静脉破裂出血的患者,目前临床主要的治疗方法仍是内镜下治疗。对于内镜治疗失败及合并难治性腹水的患者,TIPS手术治疗可能是一种更好的选择。目前已有的TIPS治疗失代偿肝硬化的研究中,其研究对象多为乙型肝炎肝硬化及酒精性肝硬化患者,即使研究对象中包含部分自身免疫性肝硬化患者,也因为例数较少等原因并未对其进行单独分析[11-12]。因为AILD 后肝硬化的病理生理机制、药物治疗策略及预后与其他病因引起的肝硬化不尽相同,探索TIPS手术治疗其疗效具有重要意义。
1997 年,Schlitt 等[13]首次报道了1 例TIPS 治疗自身免疫性肝炎后肝硬化合并急性曲张静脉出血的病例。在该病例报告中,患者因肝功能明显受损,在TIPS手术后又接受了肝移植治疗。2016年,张玮等[14]报道了26 例失代偿期原发性胆汁性肝硬化患者行TIPS 手术治疗的临床结果。患者术后的6、12个月生存率均为92.3%,短中期疗效良好。然而,TIPS手术治疗这类患者的长期预后还未见报道,其结果也有待探索。
本研究纳入的AILD后肝硬化患者均因保守和/或内镜治疗无效的食管胃底静脉曲张破裂出血而接受TIPS手术治疗。所有患者均能即刻控制出血,且术后3年的累计再出血率仅为17.1%。患者经TIPS治疗后门静脉压力显著下降,随访结果显示术后患者腹水程度明显改善,这与其他病因引起的失代偿期肝硬化经TIPS 治疗后结果相仿[5-6]。本研究中患者的3 年累计生存率高达91.7%,这表明TIPS 治疗自身免疫性肝硬化患者可能具有良好的长期预后。
AILD的预后与ALP、GGT的水平相关[1]。本研究中,患者TIPS 术后3 个月的ALP 较术前明显升高,这可能是因为TIPS术后门体分流道的存在导致入肝血流减少,并对患者的肝功能有所影响[15]。此外,TIPS 手术并不能延缓患者的自身免疫性损伤,其肝硬化进程不可逆转[16]。本研究中患者术后3个月的胆红素水平较术前并无显著上升,可能与术后联合口服熊去氧胆酸治疗有关。
在术后并发症方面,1 例患者术后短期出现了腹腔出血,考虑与术中穿刺损伤门静脉周围血管有关,术后监测生命体征,及时发现出血并处理后好转出院。1 例患者术后出现急性心功能不全,可能为术后分流道增加回心血量所致。在长期随访中,肝性脑病发生率为17.4%,略低于其他病因引起失代偿期肝硬化经TIPS治疗的报道(24%~53%)[17]。本研究中所有患者术后均无分流道或支架功能障碍。这可能是因为本研究中使用的支架均为Viatorr 专用支架,其与裸支架相比,具有更高的分流道通畅率,且不会增加肝性脑病的发生率[18]。
本研究还存在一定局限性。首先,这是一项针对少数患者的回顾性研究,无法进一步进行分层分析。其次,原发性硬化性胆管炎的患者并没有纳入本研究。
综上所述,本研究表明TIPS 联合PTVE 治疗AILD 后肝硬化患者的食管胃底曲张静脉破裂出血可能是安全有效的。
