枯草芽孢杆菌KC-WQ 发酵液中抗菌脂肽的分离鉴定及发酵条件优化
2022-08-06续晓琪许宗奇罗正山
钱 荣,续晓琪,许宗奇,徐 虹,李 莎,徐 铮,罗正山
(南京工业大学食品与轻工学院,江苏南京 211816)
沙门氏菌、大肠杆菌以及金黄色葡萄球菌作为常见的食源性致病菌,危害着公共食品安全[1],寻找安全有效的抗菌物质刻不容缓。脂肽作为一种来源于微生物的表面活性剂,具有抗菌、抗病毒等多种功效[2]。与传统抗生素不同,抗菌脂肽具有易降解、热稳定性高、不易形成耐药性、绿色安全等优势[3]。高晓平等[4]研究表明,表面活性素具有抑制乳中大肠埃希菌O157 的功效,延长乳的保质期。具有环状结构的抗菌脂肽防腐剂可以抑制其本身对蛋白酶的敏感性,同时抑制病原菌如黄曲霉等生长繁殖[5],有效控制食品中有害微生物的滋生,具有一定食品防腐保鲜功能[6]。
自然界中酵母菌、真菌、细菌等多种微生物都可以产生脂肽,目前已发现的主要有隐杆菌属、类芽孢杆菌属、梭菌属、游动放线菌属、芽孢杆菌属、假单胞菌属、沙雷氏菌属、镰孢霉属、链霉菌属、节杆菌属、分支杆菌属、短杆菌属和解硫胺素芽孢杆菌属[7−13]等,包含陆地和海洋微生物。枯草芽孢杆菌(Bacillus subtilis)能产生多种抗菌脂肽[14],主要包括伊枯草菌素(Iturin)、芬荠素(Fengycin)和表面活性素(Surfactin)三大家族;其中Iturin 和Fengycin 相比于其他抗菌脂肽,有较强的抗菌活性;而Surfactin 在抑制病毒、支原体等方面有较好的效果[15−18]。这些抗菌脂肽大多可以通过发酵条件优化实现增产[19]。目前,喻钢等[20]建立了基于制备型反相色谱柱分离纯化枯草芽孢杆菌细菌素类抗菌活性物质方法。抗菌脂肽的分离纯化主要通过电荷差异、疏水性质以及分子量不同实现杂质去除,从而达到纯化的目的[21]。
抗菌脂肽作为一种天然的抗菌成分,目前仍面临产率低、成本高等问题[22],在食品、医疗的应用缺少进一步的研究。本实验自主筛选得到一株枯草芽孢杆菌KC-WQ 作为出发菌株,考察其胞外发酵产物的抑菌特性,分离其中的抗菌脂肽并解析其结构,通过耐高温测试评价其用于食品加工[23]的潜力。最后优化发酵条件,建立响应面预测模型,旨在提高产量,并为生产流程、实际应用提供理论基础。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌KC-WQ 从发酵豆粕中分离得到,经16S 鉴定后保藏于中国典型培养物保藏中心(武汉大学保藏中心,保藏号CCTCC NO:M 2021799);BL21 大肠杆菌(Escherichia coliBL21)、鼠伤寒沙门氏菌TA97a(SalmonellaTA97a)和嗜水气单胞菌ATCC35654(Aeromonas hydrophilaATCC35654)均由南京工业大学微生物实验室提供;三氯甲烷 上海凌峰化学试剂有限公司;甲醇 上海迈瑞尔化学技术有限公司;盐酸 永华化学科技有限公司;Surfactin标准品 上海麦克林生化科技有限公司;LB 液体培养基、PDA 培养基 青岛海博生物技术有限公司。
D-78532 隔水式培养箱 上海一恒科学仪器有限公司;UNIVERSAL320(R)离心机 德祥科技有限公司;BKQ-B100II 高压蒸汽灭菌锅 赛锶钛氪贸易有限公司;ZQZY-88CN 振荡培养箱 上海知楚仪器有限公司;DH100-2 干式恒温器 杭州瑞诚仪器有限公司;S210 pH计梅特勒-托利多仪器有限公司;RE-52AA 旋转蒸发器 上海亚荣生化仪器厂;752S 紫外可见分光光度计 上海棱光技术有限公司。
1.2 实验方法
1.2.1 菌株活化和培养 将枯草芽孢杆菌KC-WQ接种于LB 液体培养基37 ℃、200 r/min 条件下培养24 h 作为种子液,将种子液以3%浓度接种在Landy改良培养基[19]内,37 ℃、200 r/min 条件下发酵48 h。Landy 改进培养基:葡萄糖20.0 g,谷氨酸钠5.0 g,酵母提取物1.0 g,MgSO40.5 g,KCl 0.5 g,KH2PO41.0 g,FeSO40.15 mg,MnSO40.5 mg,CuSO40.16 mg,蒸馏水定容至1.0 L。
1.2.2 牛津杯抑菌圈实验 取出提前制备的平板,划分区域,将50 μL 活化接种量为1.5%的沙门氏菌作为指示菌液滴加于PDA 平板上,用一次性涂布棒涂布均匀。取出灭菌后的牛津杯放置在平板四个区域,设置只添加100 μL LB 培养基作为空白对照,其余三个牛津杯中分别滴加除去菌体的KC-WQ 发酵液,加样体积依次为50、100、150 μL。随后平板置于37 ℃培养箱内培养12 h 后,观察并测量抑菌圈大小,重复三次,取平均值。
1.2.3 抗菌脂肽的制备 在灭完菌的Landy 培养基里按照3%接种量接种,200 r/min,37 ℃发酵48 h,发酵液8000 r/min,4 ℃离心10 min,取上层清夜备用。用6 mol/L HCl 调节上层清液pH 至4.0,4 ℃、12 h过夜沉淀,8000 r/min,4 ℃离心10 min。离心弃去上层清液,收集沉淀,将得到的沉淀加入过量甲醇溶解。将溶解后的液体过有机膜抽滤除去杂质,45 ℃旋转蒸发浓缩,得到甲醇粗提液。将粗提液用65 ℃烘箱烘干,收集黄色沉淀,即为抗菌脂肽粗提物[22]。
1.2.4 粗提物成分和结构分析
1.2.4.1 TLC 薄层色谱分析 称取脂肽粗提物50 mg,溶于1500 μL 甲醇作为待测样品溶液。取一块硅胶薄层板,在距离一边1 cm 处用铅笔画线,作为样品起始点,设置A、B 两组平行实验。按照薄层色谱法,使用毛细管蘸取溶液,分别点于两点上,每次10 μL,点样5 次,每次点完用吹风机吹干,备用。配置展开剂为甲醇:三氯甲烷:水=25:65:4。将展开剂、薄层板放入展缸中展开、挥干,观察在紫外灯下的条带。
1.2.4.2 高效液相色谱分析 本部分采用安捷伦1260 高效液相色谱仪和ZORBAX Eclipse XDBC18 色谱柱(5 μm,150 mm×4.6 mm)进行分析,样品与标准品均溶于20%乙腈水溶液,流动相A 为乙腈(含0.1% 三氟乙酸),流动相B 为超纯水(含0.1%三氟乙酸),流动相比例A:B 为8:2,流速为1 mL/min,检测波长为214 nm,样品浓度为5 mg/mL,进样体积为60 μL。
1.2.4.3 MALDI-TOF-MS 质谱分析 质谱检测条件:粗提物10 mg 溶于10 mL 甲醇溶剂,正离子检测,DHB 基质。使用UltrafleXtreme MALDI-TOF质谱仪(Bruker Daltonics)在反射正离子模式下进行MALDI 仪器质谱分析。用智能束激光辐照产生的离子在100~1700 Da 的质量范围内获得了质谱,照射频率为1000 Hz,PIE 为120 ns,透镜电压为7 kV。第一离子源电压为20 kV,第二离子源电压为17.65 kV。每个光谱由平均1000 次激光发射产生,并且激光辐照度被设置为50%~55%。使用FlexAnalysis 软件(version:3.3,Bruker)处理质谱图。
1.2.5 耐热性测定 将用上述方法提取的抗菌脂肽配制成1.0 mg/mL 的溶液,在45、65、85、105 ℃条件下加热20 min,以未经处理的原样品作为对照组,以沙门氏菌为指示菌评价其抑菌效果,测量抑菌圈直径,重复三次,取平均值。
1.2.6 最小抑菌浓度测定 将由方法1.2.3 提取的抗菌脂肽样品做浓度递减稀释,分别为25、12.2、6.2、3.1、1.6、0.8、0.4 mg/mL,对沙门氏菌做抑菌试验,以抑菌圈大于10 mm 为依据确定最小抑菌浓度[21],重复三次,取平均值。
1.2.7 发酵条件优化
1.2.7.1 碳源优化 根据初始发酵培养基,以添加2%碳源进行优化实验,分别选取单一碳源葡萄糖、麦芽糖、蔗糖和混合碳源(葡萄糖1%+淀粉1%)进行单因素实验,保持其余发酵条件一致。使用紫外可见分光光度计测在600 nm 处测定OD 并按照方法1.2.3 所述测定抗菌脂肽粗提物产量,以OD600和抗菌脂肽粗提物产量作为实验评价指标,重复三次,取平均值。
1.2.7.2 氮源优化 在初始发酵培养基的基础上加入0.25%的不同氮源进行单因素实验设计。选取尿素,胰蛋白胨作为氮源,另外设计无氮源对照组同步进行,实验保持其余发酵条件一致。评价方法同上,重复三次,取平均值。
1.2.7.3 摇床转速优化 选择发酵温度为37 ℃,pH 为7,装液量为200 mL,发酵时间为48 h,选择转速分别为150、180、200、250 r/min,其余条件保持一致。评价方法同上,重复三次,取平均值。
1.2.7.4 发酵温度优化 选择发酵pH 为7,装液量为200 mL,发酵时间为48 h,转速为200 r/min,温度分别为30、33、35、37 ℃,其余条件保持一致。评价方法同上,重复三次,取平均值。
1.2.7.5 发酵初始pH 优化 选择发酵温度为37 ℃,装液量为200 mL,发酵时间为48 h,转速为200 r/min,初始pH 为5.0、6.0、7.0、8.0,其余条件保持一致。评价方法同上,重复三次,取平均值。
1.2.7.6 响应面试验 在单因素实验培养基优化的基础之上,以抗菌脂肽粗产量Y 作为响应值,对初始pH(X1)、发酵温度(X2)、摇床转速(X3)构建三因素三水平的响应面优化分析(表1)。

表1 各变量及其高低水平设计Table 1 Variables and their high and low level design
1.3 数据处理
数据分统计学析实验重复3 次,数据结果用“平均值±标准差”表示,IBM SPSS Statistics 19.0 软件进行分析,方差分析(ANOVA)判断多重平均值的显着性,显著性水平P<0.05 表示具有统计学意义。
2 结果与分析
2.1 抑菌活性验证
如图1 所示,枯草芽孢杆菌KC-WQ 发酵液对三种致病菌增殖具有明显的抑菌效果。对比抑菌圈平均值直径的大小发现(表2),发酵液抑菌效果与剂量呈正相关,相同剂量下的发酵液对沙门氏菌的抑制效果最为显著,抑菌圈直径最高达到了(16.50±2.18)mm;对大肠杆菌和嗜水气单胞菌也有较好的抑制效果,最大抑菌圈直径分别为(12.83±2.37)mm 和(15.77±1.57)mm。相比白杰等[21]报道的枯草B3菌株,KC-WQ 发酵液抑菌效果更为明显,因此为进一步验证抑菌效果,采用沙门氏菌作为指示菌进行后续评价实验。

图1 枯草芽孢杆菌KC-WQ 胞外发酵液抑菌图Fig.1 Antibacterial diagram of extracellular fermentation broth of Bacillus subtilis KC-WQ

表2 枯草芽孢杆菌KC-WQ 抑菌圈直径Table 2 Inhibition zone diameter of Bacillus subtilis KC-WQ
2.2 脂肽粗提物产量及结构分析
将上述枯草菌株发酵培养,酸沉淀法制得抗菌脂肽,产量为(0.763±0.03)g/L。TCL 法对脂肽粗提物进行初步分析,紫外灯下显色后在a、b 之间有多段活性成分的显色印迹(图2),表明其组分较为复杂。
2.3 HPLC 结果分析
对比KC-WQ 的抗菌脂肽样品和Surfactin 标准品的液相图谱出峰时间(图3)发现,该菌株粗提物的保留时间在9~20 min 之间。抗菌脂肽样品在9~11 min,13~16 min 和19~21 min 的保留时间与标准品一致,可以证实该抗菌脂肽中含有Surfactin 的同系物。

图3 脂肽粗提物与标准品HPLC 保留时间对比Fig.3 Comparison of HPLC retention time between crude lipopeptide extract and standard product
表3 结果显示,KC-WQ 菌株的脂肽粗提物在HPLC 中的保留时间范围为9.977~20.897 min。与Surfactin 标准品对比,抗菌脂肽样品中同样保留时间的峰面积占据整个出峰面积的46.315%,表明该抗菌脂肽中有近50%的Surfactin 成分,其余脂肽尚无商品化纯品做对照,进一步采用MALDI-TOF-MS鉴定分析。
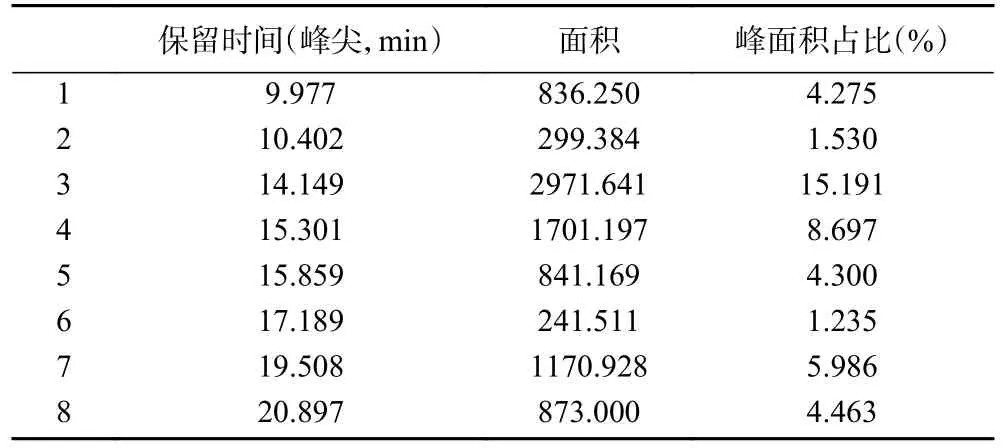
表3 脂肽粗提物样品HPLC 保留时间及面积Table 3 HPLC retention time and area of crude lipopeptide extract sample
2.4 MALDI-TOF-MS 分析结果
进一步采用质谱分析抗菌脂肽组成,根据黄君[24]的文献报道,采用m/z 对脂肽进行分类。m/z 在1030.4~1059.4 的范围属于Iturin 族,在994.4~1036.4属于Surfactin 族(图4a),在1449.4~1491.4 为Fengycin 族(图4b)。由于抗菌脂肽主要由1 个疏水脂肪烃链与7~10 个氨基酸构成的环肽相连,其结构差异主要表现在脂肪烃链的碳原子个数[25],而脂肪烃链的长短不同,导致了每增加或减少一个碳原子,m/z 相差14。本实验得到的抗菌脂肽的主要成分为C13~C16 Iturin、Iturin 族中的C13~C15 Bacillomycin D、C12~C15 Surfactin 以及少量的C15~C18 Fengycin A(表4)。结果证明这些粗提物的主要成分是三种抗菌脂肽的混合物,有良好的抑菌表现,同时该类抗菌脂肽已被证明具有生物安全性[26],可开发应用于食品加工环节中对有害微生物的控制、防腐保鲜等方面[27]。

表4 MS 结果分析Table 4 MS result analysis

图4 脂肽粗提物MALDI-TOF 结果Fig.4 MALDI-TOF analysis results of crude lipopeptide extract
2.5 抗菌脂肽理化性质分析
2.5.1 温度对抗菌脂肽的影响 牛津杯法抑菌实验的结果发现(图5),枯草KC-WQ 的脂肽粗提物经45、65、85、105 ℃处理20 min 后,抑菌效果并未出现明显变化。抑菌圈直径随着温度的上升略有数值降低但不显著(P<0.05),说明该脂肽粗提物中的抑菌成分可耐高温。这些短链多肽具有热稳定性,可进行喷干等涉及高温处理的工艺[28],具有较好的加工特性。

图5 抗菌脂肽耐热效果评价Fig.5 Evaluation of the heat resistance of lipopeptides
2.5.2 最小抑菌浓度测定 由表5 可知,该抗菌脂肽在较低浓度时仍对沙门氏菌有抑菌效果,最小抑菌质量浓度为0.8 mg/mL。

表5 不同浓度的KC-WQ 抗菌脂肽对沙门氏菌的抑菌效果Table 5 Inhibition of different concentrations of KC-WQ crude lipopeptide against Salmonella
2.6 发酵条件优化结果
2.6.1 碳源优化结果 实验得到的脂肽粗产物及OD 值如图6(a)所示。在对碳源的优化中,发现葡萄糖和淀粉以1:1,共20 g/L 的浓度时抗菌脂肽粗产量实现最大,同时在600 nm 波长处的吸光值也是同组实验最大值。在发酵过程中,碳源的选择直接影响到细菌的繁殖及代谢速率,在一定范围内,发酵液菌群浓度与其在600 nm 波长处的吸光值成正比[29],且在吸光度最大时,抗菌脂肽产量最高。根据以上结果,可以选取葡萄糖+淀粉作为最佳碳源。

图6 碳源(a)、氮源(b)优化对脂肽粗产量及OD600nm 的影响Fig.6 The influence of carbon source (a) and nitrogen source (b) optimization on the crude lipopeptide yield and OD600nm
2.6.2 氮源优化结果 实验得到的粗产物质量及OD值如图6(b)所示。从结果中可以看出,添加胰蛋白胨时该菌的粗产物产量最高,并且发酵菌液在600 nm的吸光度为最高,由于氮源包含大量菌体在生长代谢过程中所需物质,不仅影响菌体繁殖生长,也会影响后期的抗菌脂肽的产量。胰蛋白胨含有丰富的氮源和氨基酸,促进菌体的生长代谢,因此可以作为KCWQ 枯草芽孢杆菌最佳氮源。
2.6.3 摇床发酵条件优化结果 摇床转速是决定发酵过程中通气量的关键因素,通气量对菌体的氧化分解作用有着显著的影响。优化结果如图7a 所示。在转速达到200 r/min 时,得到的粗产物产量及OD 值均为最大。当转速变高或者降低时,都会导致反应产物及OD 值减少,枯草芽孢杆菌属于好氧菌,适当提高转速有利于其增殖和脂肽积累,因此选用200 r/min 的转速作为适宜摇床转速。
初始pH 对菌体生长有显著的影响,pH 过高或过低都会影响发酵速度和发酵产量。优化结果如图7b 所示。当pH 为5 时,脂肽粗产量最低;之后随pH 的升高,产量上升;当环境呈现略碱性时(pH8),产量反而下降,但仍高于pH5 时的产量。因此综合考虑适宜发酵初始pH 为7.0 进行后续试验。
温度是影响菌体发酵的重要因素,温度过高会加快菌体的代谢反应速率,缩短生长周期,菌体提前衰老影响发酵。温度太低则会导致氧化还原速率降低,菌体生长周期变长,抗菌脂肽产量下降。优化结果如图7c 所示。随着温度的升高,粗产物产量和OD值稳步提高,到达35 ℃时达到顶峰,随后下降。因此可以选取35 ℃作为发酵的适宜温度。

图7 摇床发酵条件优化结果Fig.7 Optimized results of shaker fermentation conditions
2.7 响应面试验
利用Design-Expert 软件建立回归方程进行结果分析,以抗菌脂肽粗产量Y 值作为响应值,得出多元拟合二项式模型,并对模型的显著性进行评估,最终预测出最佳发酵条件,根据预测值进行实验验证,判断模型的契合度。
利用Design-Expert 软件对表6 的数据进行分析设计,得出脂肽粗产量(Y)对初始pH(X1)、发酵温度(X2)和摇床转速(X3)的二次多项回归模型方程为:

表6 响应值试验及结果Table 6 Response value test and results

从表7 得知,模型的F值为15.15,P值为0.0008,达到了显著水平,失拟项为0.0954>0.05,不显著。发酵条件X1的P<0.001,说明初始pH 对发酵影响非常显著;X2的P<0.01,说明发酵温度对发酵高度显著;X3表现出不显著。模型的决定系数R2=0.9512>0.9,说明模型的线性关系显著,校正决定系数R2Adj=0.8884,说明模型与实验数据契合度较高,因此可以用模型预测发酵条件对枯草芽孢杆菌抗菌脂肽产量的影响。

表7 二次多项回归模型方差结果Table 7 Quadratic polynomial regression model variance results
2.7.1 构建响应面分析结果 根据回归模型并利用Design-Expert 软件绘制出响应面优化结果,得到了发酵温度、摇床转速、初始pH 三个因素之间的3D 模型图,图8a 反应了摇床转速与初始pH 对脂肽粗产量的交互关系,图8b 反应了发酵温度与初始pH 对脂肽粗产量的交互关系,图8c 反应了摇床转速与发酵温度对脂肽粗产量的交互关系。经过软件进一步的结果分析,得出响应面分析结果优化后的预测发酵条件:初始pH=6.0,发酵温度为36 ℃,摇床转速为208 r/min,预测产物产量为1.311 g/L。

图8 脂肽粗产量的响应面曲线图及等高线图Fig.8 Response surface curve and contour plot of crude lipopeptide yield
2.7.2 回归模型的验证 为了检验模型的准确性,对模型预测的数值进行检测实验。为便于实验的操作性,所有预测值取整数,因此取发酵温度为36 ℃,初始pH=6.0,摇床转速为208 r/min。设置三个平行组,选用优化培养基进行发酵实验,最后得到抗菌脂肽粗产量为1.236 g/L,达到了预测值的94.28%,数值较为接近预测值,说明模型预测可靠性高,可以较好地反映发酵条件各个因素对产物的影响。
3 结论
枯草芽孢杆菌是一种天然的益生菌,分泌纯天然的抗菌脂肽,在食品、医疗等领域有着较好的开发前景。本实验以筛选到的枯草KC-WQ 为研究对象,其胞外产物具有抑菌特性,对肠道类致病菌有着较好的抑菌效果;酸沉淀法获得抗菌脂肽,结合TLC、MALDI-TOF-MSL 和HPLC,鉴定其主要成分为Iturin、Bacillomycin D、Surfactin 和Fengycin A。该抑菌脂肽具有较好的耐热性,对沙门氏菌的最小抑菌浓度为0.8 mg/mL。最后,针对该菌株进行发酵条件优化,设计响应面和回归方程,得到最适发酵条件:初始pH6.0,发酵温度为36 ℃,摇床转速为208 r/min,预测产量为1.311 g/L,经实验验证,最后实际得到的抗菌脂肽产量为1.236 g/L。本研究获得的枯草芽孢杆菌KC-WQ,其胞外所产抗菌脂肽对Salmonellaentericasubsp.enterica、Aeromonas hydrophila和Escherichia coli等常见食源性污染菌具有显著抑菌效果,理化性质稳定,在食品加工行业具备应用潜质。
