两种香花芥属植物叶片结构及光合特性研究
2022-08-05董梦宇王金鑫吴萌周子瑶程顺李彦慧
董梦宇,王金鑫,吴萌,周子瑶,程顺,李彦慧*
(1. 河北农业大学园林与旅游学院,河北保定 071000;2. 河北省塞罕坝机械林场,河北 承德 067000)
近年来,随着我国城市化进程的加快和对生态环境改善的需要,园林观赏植物作为营建城市生态系统的基础要素,被赋予了更高更广的要求[1]。但当前国内园林绿化材料大多依赖进口,同时易受环境限制,因此开发具有独立知识产权、适应性强的植物品种,迫在眉睫[2]。野生花卉具有观赏价值高和抗性强等优势,是培育花卉新品种的重要来源[3]。而我国野生花卉资源丰富,素有“世界园林之母”的美誉[4],为国内育种工作者提供了更多的选择。近年来,国内学者利用牡丹(Paeonia suffruticosa)、芍药(Paeonia lactiflora)[5]、金花茶(Camellia petelotii)、铁线莲(Clematis florida)[6]等野生植物资源优选培育出一批优良品种,部分已得到推广应用。
欧亚香花芥(Hesperis matronalis),俗称蓝香芥,十字花科香花芥属二年至多年生草本,为欧洲常见的园艺花卉,具有花量大、花色亮丽的特点,景观应用效果佳[7]。雾灵香花芥(Hesperis sibirica),正名北香花芥[8],是河北省重要的野生花卉资源[9]。其植株挺直,花量大、花色清新亮丽,群体效果佳,具有较高的观赏价值和园林应用前景,但目前缺乏引种适应性方面的研究报道。植物叶片功能性状及其相关生理代谢活动是常见的适应性评价指标[10]。植物主要通过调节叶片功能性状以提高生态适应性[11],同时以叶片为主要载体的光合作用是植物生长发育的生理基础[12],二者长期相互适应,共同反映了植物的生长策略及对资源的获取能力,对解释植物在异质环境下的生理生态响应具有重要意义[13-14]。因此本研究以保定地区栽植的欧亚香花芥及河北雾灵山、塞罕坝2 个野生型雾灵香花芥为供试材料,研究其叶片形态、解剖结构、色素含量、叶绿素荧光及光合参数等,以期评估两种香花芥属植物的引种适应性,并借助相关性分析(Pearson)和冗余分析(redundancy analusis,RDA)探究其叶片结构与光合生理间的内在联系,为香花芥属植物栽培、新品种开发及园林应用提供理论依据。
1 材料与方法
1.1 试验地概况及试验材料
试验场地位于河北省保定市河北农业大学教学试验场三分场(38°49′38″N,115°26′51″E)。保定市属暖温带亚湿润气候区,年均温13 ℃,平均降水量532 mm,日照2500~2900 h,无霜期165~210 d。雾灵香花芥种子采集自河北省承德市雾灵山国家级自然保护区(40°35′41″N,117°29′4″E)和塞罕坝国家森林公园(42°19′30″N,117°27′9″E),分别以雾灵香花芥(雾)、雾灵香花芥(塞)表示,欧亚香花芥商品种子购于北京一花园艺有限公司,三者均于2020 年8 月露地条播,常规水肥管理。
1.2 指标测定及方法
1.2.1叶片样品采集 于花期,选择长势一致的健壮植株,取中部功能叶片用以研究其形态、解剖结构、色素含量、叶绿素荧光及光合参数等。每种材料4 次重复。
1.2.2测定方法 使用HP Deskjet 1050 扫描仪(美国)扫描叶形(分辨率300 dpi),并利用LEAFSHAPES 软件测定叶面积(leaf area,LA)、周长(leaf perimeter,LP)和纵横比(leaf length/leaf width,LL/LW)等。采用95%乙醇提取法[15]测定叶绿素a(chlorophyll a,Chl a)、叶绿素b(chlorophyll b,Chl b)和类胡萝卜素(carotenoid,Car)含量,计算叶绿素a/b(Chl a/b)和总叶绿素含量(Chl a+b)。花青苷(anthocyanidin,Ant)含量测定采用盐酸乙醇提取法[16]。
叶表皮特征采用次氯酸钠离析法[17],待叶片完全脱色后撕取下表皮制片,显微观察叶表气孔及表皮毛分布情况,计算气孔长宽比(stomata length/stomata width,SL/SW)、气孔密度(stomata density,SD)和表皮毛密度(epidermal trichome density,ETD)。叶片解剖结构采用石蜡切片[18]及徒手切片法[19]。本研究石蜡切片采用8 μm厚度制片,番红-固绿联染,可清晰观测到叶表皮、叶脉结构,而叶肉结构无法辨认,故结合徒手切片对其叶肉结构进行解剖、观察。显微观察并测量叶脉维管束直径(vascular bundles diameter,VBD)、导管直径(vessel diameter,VD)、筛管直径(sieve tube diameter,STD)、叶片厚度(leaf thickness,LT)、上表皮厚度(upper epidermal thickness,UET)、下表皮厚度(lower epidermal thickness,LET)、栅栏组织厚度(palisade parenchyma thickness,PPT)和海绵组织厚度(spongy parenchyma thickness,SPT),计算组织结构紧密度(cell tense ratio,CTR,PPT/LT)、组织结构疏松度(spongy ratio,SR,SPT/LT)和栅海比(PPT/SPT)。
利用Li-6400 光合仪(美国)测定叶片光合参数,选择无风的晴天,连续3 d 于9:00-11:00 测定净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、水蒸气压亏损(vapor pressure deficit,VPD)、胞间CO2浓度(intercellular CO2concentration,Ci)和气孔导度(stomatal conductance,Gs),计算水分利用效率(water use efficiency,WUE,Pn/Tr)。于同一时段,叶片暗适应20 min 后利用Pocket PEA 荧光仪(英国)测定叶绿素荧光参数,包括初始荧光(initial fluorescence,Fo)、最大荧光(maximum fluorescence,Fm)、可变荧光(variable fluorescence,Fv)、PSⅡ反应中心最大光化学效率(the maximal PSⅡphotochemical efficiency,Fv/Fm)、PSⅡ量子效率(PSⅡpotential activity,Fv/Fo)和PSⅡ电子传递情况(PSⅡelectron transport activity,Fm/Fo)以及PSⅡ单位反应中心吸收的光能(light energy absorbed by PSⅡunit reaction center,ABS/RC)、捕获的用于还原初级醌受体的能量(PSⅡunit reaction center used to reduce the primary quinone acceptor,TRo/RC)、捕获的用于电子传递的能量(PSⅡunit reaction center used for electron transfer,ETo/RC)和 热 耗 散的 能 量(heat dissipation energy by PS Ⅱunit reaction center,DIo/RC)。
1.3 数据处理
采用Excel 2010 汇总试验数据、制作图表,利用SPSS 22.0 对数据进行单因素方差分析,以Duncan’s 法比较不同处理间差异,利用R 4.1.0 进行相关性分析(Pearson)并绘图,采用Canoco 5.0 进行冗余分析。图表中数据为平均值±标准差。
2 结果与分析
2.1 两种香花芥属植物叶片形态比较
图1为两种香花芥属植物叶形扫描图。雾灵香花芥(雾)叶片为阔椭圆形,基部近截形,叶尖渐尖,边缘具波状齿,雾灵香花芥(塞)叶片为窄椭圆形,基部近楔形,叶尖锐尖,边缘具尖齿;欧亚香花芥为披针形叶,基部近心形,叶尖渐尖,边缘具浅齿。由图2 可知,2 个野生型雾灵香花芥叶面积和叶纵横比均存在显著差异(P<0.05),其中雾灵香花芥(雾)叶面积较雾灵香花芥(塞)提高了28.32%,而叶纵横比方面,前者较后者降低了17.27%;二者叶周长无显著差异。欧亚香花芥叶面积较雾灵香花芥(雾)显著降低了18.63%(P<0.05),与雾灵香花芥(塞)差异不显著;两种香花芥属植物的叶周长、叶纵横比均无显著差异。

图1 两种香花芥属植物叶片扫描图Fig.1 Scanned image of leaves of two species of Hesperis
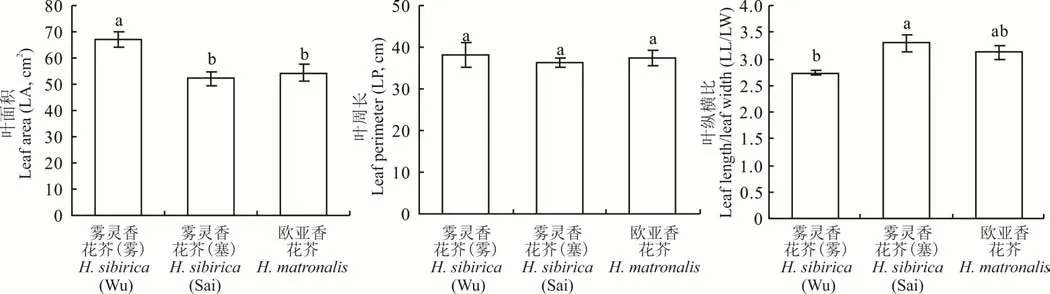
图2 两种香花芥属植物叶形特征比较Fig.2 Comparison of leaf shape characteristics of two species of Hesperis
2.2 两种香花芥属植物叶片解剖结构比较
雾灵香花芥及欧亚香花芥叶下表皮均分布大量气孔及毛状体;毛状体共3 种类型,其中单毛、腺毛为2 个野生型雾灵香花芥共有,欧亚香花芥具分叉毛(图3)。由图4 可知,2 个野生型雾灵香花芥气孔长宽比及表皮毛密度均无显著差异;气孔密度方面,雾灵香花芥(塞)为152 个·mm-2,显著高出雾灵香花芥(雾)38.32 个百分点(P<0.05)。欧亚香花芥气孔长宽比、气孔密度与2 个野生型雾灵香花芥均无显著差异,其表皮毛密度为21 个·mm-2,较雾灵香花芥(雾)显著提高了49.43%(P<0.05),与雾灵香花芥(塞)无显著差异。
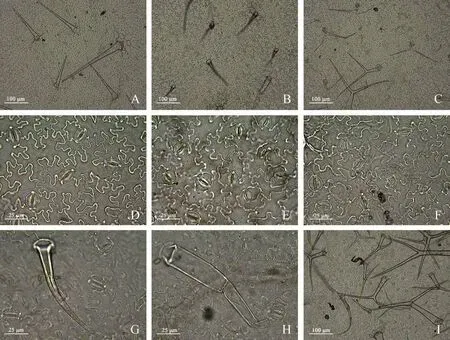
图3 两种香花芥属植物叶表皮气孔及表皮毛分布Fig.3 The distribution of leaf epidermal stomata and trichomes of two species of Hesperis

图4 两种香花芥属植物叶表皮特征比较Fig.4 Comparison of leaf epidermal characteristics of two species of Hesperis
图5为两种香花芥属植物的叶片解剖图。由图5 可知,雾灵香花芥和欧亚香花芥植物叶片结构均可划分为叶表皮、叶肉和叶脉3 部分,其中叶肉由栅栏组织和海绵组织两部分构成,栅栏组织位于上表皮内侧,由排列紧密的单层细胞组成,海绵组织介于栅栏组织和下表皮之间,细胞排列松散、间隙大;主叶脉内存在1~3 个维管束,导管、筛管则分别位于维管束内的韧皮部、木质部。由表1 可知,2 个野生型雾灵香花芥叶片厚度及上、下表皮厚度均无显著差异;雾灵香花芥(雾)栅栏组织厚度较雾灵香花芥(塞)显著提高了19.14%,而海绵组织厚度较后者显著降低了8.69%(P<0.05);雾灵香花芥(雾)的组织结构紧密度、栅海比较雾灵香花芥(塞)分别提高了18.66%、30.95%,而组织结构疏松度降低了9.06%,差异显著(P<0.05);雾灵香花芥(雾)维管束直径较雾灵香花芥(塞)显著提高,而导管及筛管直径显著降低(P<0.05),表明雾灵香花芥(雾)的维管束密度较雾灵香花芥(塞)有所提高。欧亚香花芥的叶片厚度较雾灵香花芥(雾)、雾灵香花芥(塞)分别显著降低了18.80%、18.43%(P<0.05),上、下表皮厚度方面,与2 个野生型雾灵香花芥无显著差异;欧亚香花芥的栅栏组织厚度与2 个野生型雾灵香花芥无显著差异,而海绵组织厚度、组织结构疏松度均较后两者显著降低(P<0.05);组织结构紧密度和栅海比方面,欧亚香花芥较雾灵香花芥(雾)、雾灵香花芥(塞)分别显著提高了16.48%、38.21%和36.36%、78.57%(P<0.05);欧亚香花芥维管束直径与2 个野生型雾灵香花芥无显著差异,而其导管及筛管直径均低于后两者,其中导管直径差异达到显著水平(P<0.05),表明欧亚香花芥的维管束密度较2 个野生型雾灵香花芥有所降低。
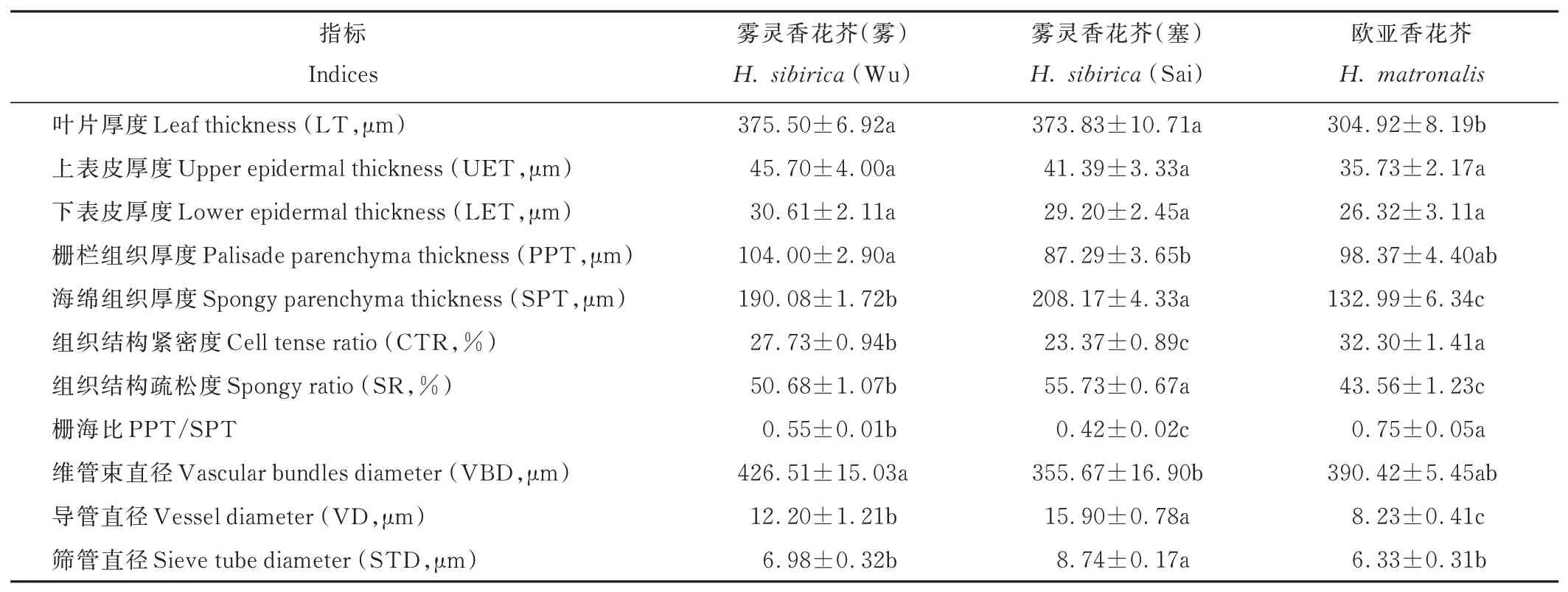
表1 两种香花芥属植物叶片解剖特征比较Table 1 Comparison of leaf anatomical characteristics of two species of Hesperis
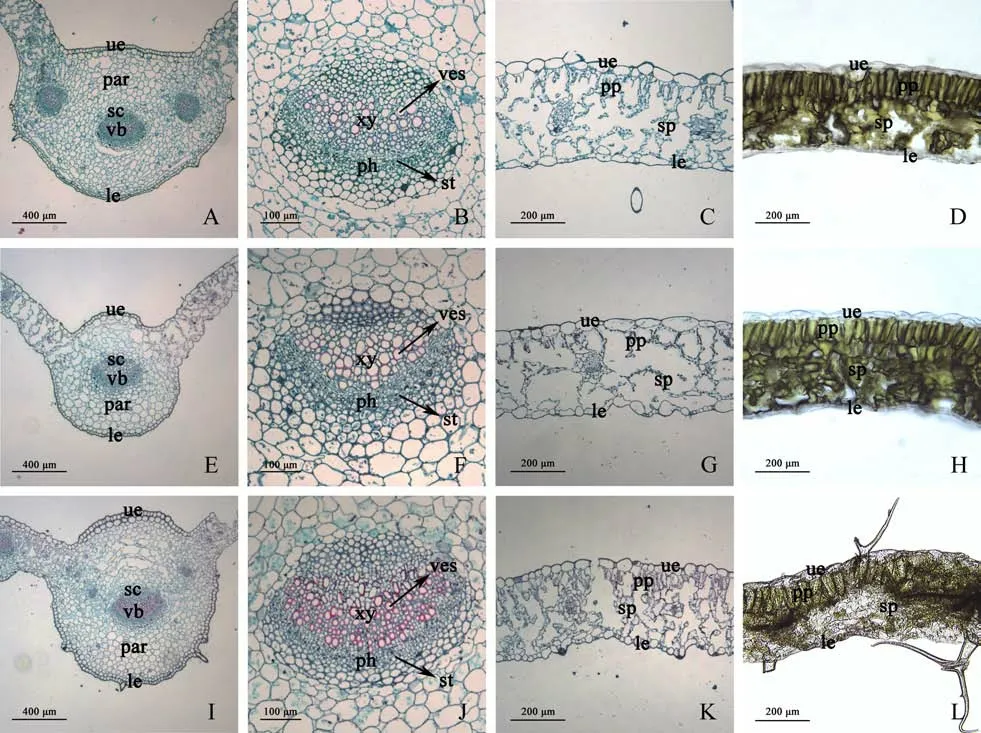
图5 两种香花芥属植物叶片解剖结构比较Fig.5 Comparison of leaf anatomical structure of two species of Hesperis
2.3 两种香花芥属叶片色素含量比较
两种香花芥属植物叶片色素含量存在差异(表2)。雾灵香花芥(雾)Chl a、Chl b、Chl a+b 和Ant 含量较雾灵香花芥(塞)分别提高了15.71%、33.33%、19.15%和58.82%,均差异显著(P<0.05),而二者间Car 含量和Chl a/b 无显著差异。欧亚香花芥与雾灵香花芥(雾)叶片色素含量均无显著差异,而欧亚香花芥的Chl a、Chl b、Chl a+b 和Ant 含量均显著高于雾灵香花芥(塞)(P<0.05)。
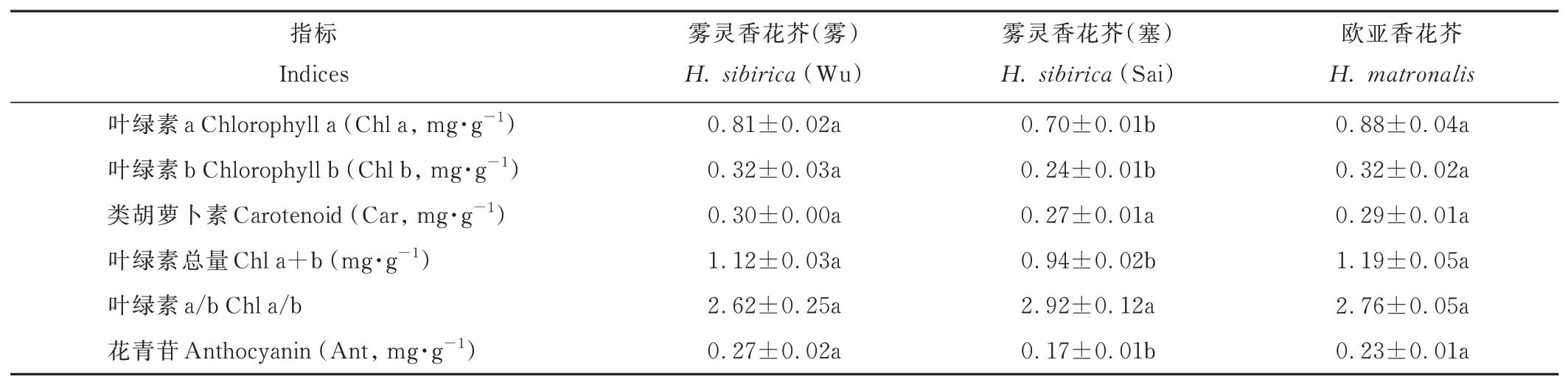
表2 两种香花芥属植物叶片色素含量比较Table 2 Comparison of leaf pigment content of two species of Hesperis
2.4 两种香花芥属植物叶绿素荧光参数比较
两种香花芥属植物叶绿素荧光参数见表3。2 个野生型雾灵香花芥的基本荧光参数均无明显差异。欧亚香花芥Fo、Fv和Fm参数值均显著高于2 个野生型雾灵香花芥(P<0.05),而Fv/Fm、Fv/Fo和Fm/Fo参数值均与后两者无显著差异。PSⅡ反应中心活性参数方面,雾灵香花芥(塞)ABS/RC、TRo/RC和ETo/RC参数值均显著高于雾灵香花芥(雾)(P<0.05),DIo/RC参数值则无显著差异;欧亚香花芥ABS/RC、TRo/RC、ETo/RC和DIo/RC参数值均显著低于雾灵香花芥(塞)(P<0.05),较雾灵香花芥(雾)而言,欧亚香花芥ETo/RC参数值显著降低了12.50%(P<0.05),其余参数间则无显著差异。
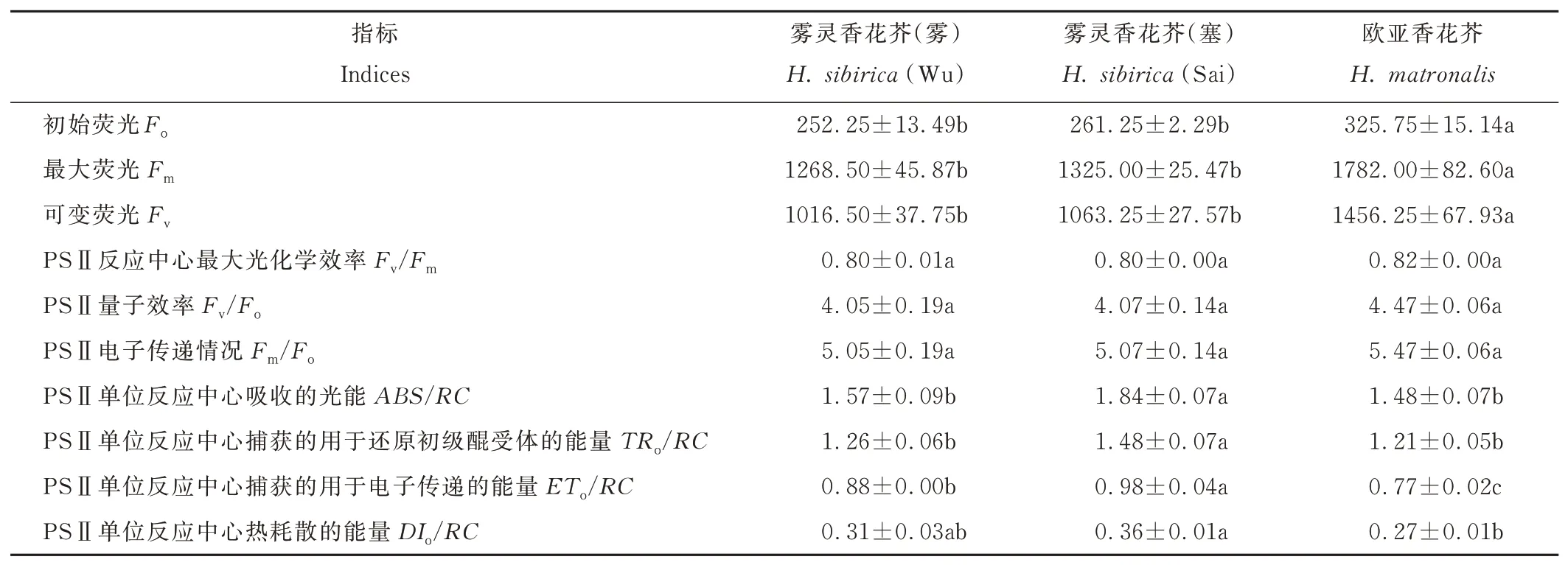
表3 两种香花芥属植物叶绿素荧光参数Table 3 Chlorophyll fluorescence parameters of two species of Hesperis
2.5 两种香花芥属植物光合参数比较
由表4 可知,2 个野生型雾灵香花芥的Pn、Tr、VPD、Gs、Ci和WUE 均无显著差异。欧亚香花芥Gs和WUE 均显著高于2 个野生型雾灵香花芥,Tr和VPD 显著低于后两者(P<0.05),而Ci与之无显著差异;欧亚香花芥Pn为34.75 μmol·m-2·s-1,为雾灵香花芥(塞)的1.22 倍,差异显著(P<0.05),欧亚香花芥与雾灵香花芥(雾)则差异不显著。

表4 两种香花芥属植物光合参数Table 4 Photosynthetic parameters of two species of Hesperis
2.6 两种香花芥属植物叶片结构与光合生理关系分析
图6为两种香花芥属植物叶片结构与光合生理的相关性分析(Pearson)热图。由图6 可知,两种香花芥属植物的叶片结构参数与光合生理参数间存在较强的相关性,其中SPT、SR、CTR、PPT/SPT、VD、STD 等叶片结构性状与色素含量、叶绿素荧光参数和光合参数均存在显著相关性,LT、ETD、SL/SW 与叶绿素荧光和光合参数均存在显著相关性,PPT 与色素含量和叶绿素荧光参数均存在显著相关性,LA、LP、LL/LW、VBD 与色素含量存在显著相关性,LET 与光合参数存在显著相关性(P<0.05),而SD、UET 与光合生理参数均无显著相关性。

图6 两种香花芥属植物叶片结构与光合生理的相关性分析热图Fig.6 The heat map of correlation analysis between leaf structure and photosynthetic physiology of two species of Hesperis
为进一步从多个叶片结构变量中优选对光合生理变化影响最为重要的变量,利用冗余分析(RDA)以17 个叶片结构指标作为解释变量,22 个光合生理指标作为响应变量,对两个变量组进行排序分析。降趋势对应分析(detrended correspondence analysis,DCA)得到的梯度长度小于3,因此选择RDA 模型排序。借助Canoco 软件内置算法筛选出10 个重要的解释变量,并对这些变量进行重分析。分析结果显示,叶片结构对光合生理变化的解释变量达98.70%,调整后的解释变量为86.00%;第1 轴和第2 轴的解释变量分别为53.76%和17.70%,表明前两轴共解释了两种香花芥属植物光合生理71.46%的变异。由图7 可知,PPT/SPT、SPT、ETD、LA、SR、VD、PPT 和VBD 等8 个叶片结构性状的箭头长度较长,表明它们能够较好地解释两种香花芥属植物光合生理的变异,其中PPT/SPT(解释度为48.30%,调整后的P值为0.02)的箭头长度最长,对光合生理的影响达到显著水平(P<0.05)。PPT/SPT 与Pn、WUE 的箭头方向夹角小(锐角),而SPT、SR、VD 与Pn、WUE 的夹角较大(钝角),表明PPT/SPT 与Pn、WUE 具较强的正相关性,而SPT、SR、VD 与Pn、WUE 负相关性较强;ETD 与Fv/Fm夹角较小(锐角),表明二者间正相关性较强;LA、VBD、PPT 与Ant、Chl b、Car、Chl a+b、Chl a 等色素参数均为锐角,表明此类指标与色素含量存在正向相关性。由此可见,RDA 与Pearson 分析结果具有一致性。
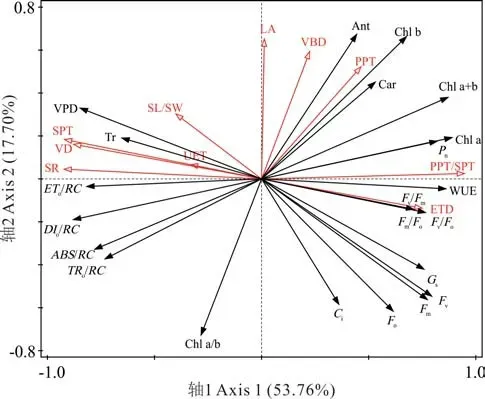
图7 两种香花芥属植物叶片结构与光合生理的RDA 图Fig. 7 RDA diagrams of leaf structure and photosynthetic physiology of two species of Hesperis
3 讨论
叶片是联系植物生理和外环境的桥梁,对异质环境感知能力较强,通过调整叶片功能性状以应对不同生境,是植物适应环境变化的一种生存策略[20]。叶片形态可影响叶光合面积,叶面积大小、叶宽等形态指标反映了植物对光的截获能力[21]。本研究选取了两种香花芥属植株的中部功能叶片作为研究对象,该植株基部叶片老化且受光不足,形态和功能影响较大,新生幼叶形态不稳定且代谢能力弱,均不宜作为研究对象,而中部功能叶片形态和功能性状稳定,研究结果更具参考性。研究结果显示,雾灵香花芥(雾)叶面积最大、叶片纵横比最小,其光合面积最大,利于光能的捕获。叶表皮毛不仅对植物具有物理保护作用,对其代谢过程也具有重要意义[22-23]。叶片表皮毛的存在显著增大了两种香花芥属植物叶表面积及叶片厚度,有利于减少水分损失、提高水分利用率,同时具有抵御强光伤害和保温等作用;雾灵香花芥叶表面大量分布的腺毛可以分泌次生代谢物抵抗昆虫及病原菌。叶表气孔密度及叶脉维管束密度决定植物水分亏损及光合效率[21,24]。雾灵香花芥(雾)的维管束密度大且气孔分布密度小,其水分疏导能力高而耗散少,表现出一定的抗旱性;雾灵香花芥(塞)叶表气孔密集分布,同时维管束内导管、筛管增粗,利于CO2和H2O 光合反应原料的供应传输;欧亚香花芥叶表气孔分布密度及叶脉维管束密度均较大,有利于维持较高的光合及水分利用水平。植物叶片栅栏、海绵组织二者的分化程度可直接反映其对外界水分及光照的适应程度,一般而言,栅海比、细胞紧密度越高,植物的光合效率越高,抗旱能力愈强[14]。雾灵香花芥(雾)的栅海比、组织结构紧密度较高,叶片结构相对稳定,具备一定的干旱适应性;雾灵香花芥(塞)海绵组织的厚度较厚,栅海比也较低,组织结构相对松散,适应水分充足环境;欧亚香花芥栅栏比高,叶肉组织结构紧密,较抗旱。总体而言,2 个野生型雾灵香花芥于保定地区长势良好,其叶片功能性状能够保障植物体光合、呼吸及蒸腾等代谢活动的正常运转[25],表现出较强的环境适应性;2 个野生型雾灵香花芥的叶片结构均表现出一定的抗寒及耐强光辐射特征,且雾灵香花芥(雾)的耐旱特征更为明显,这些特征性状与其原始生境是相匹配的。欧亚香花芥品性优良,长期应用于园林绿化,其叶片结构稳定,光合性能佳,适应性强。
光合色素是植物光合作用的基础。叶绿素a、b 分别反映了植物对光照的利用、捕获能力,两者比值用以衡量光能利用效率,类胡萝卜素在植物光利用和捕获过程中起辅助作用[26-27]。多数研究发现,光合色素含量和植物光合性能呈正相关[28-29]。本研究中,欧亚香花芥及雾灵香花芥(雾)的光合色素含量显著高于雾灵香花芥(塞),有利于欧亚香花芥和雾灵香花芥(雾)叶片光能的捕捉及转化,进而提高其光合性能。叶绿素荧光参数反映了植物叶片的光合效率和潜在能力[10]。Fv/Fm表示PSⅡ反应中心最大光化学量子产量,在非胁迫条件下,Fv/Fm的值较为稳定,与植物种类无关[30]。本研究中,两种香花芥属植物的Fv/Fm无明显差异,表明其健康状况良好,适应试验地环境。ABS/RC、TRo/RC、ETo/RC和DIo/RC属于PSⅡ单位反应中心的活性参数,分别反映了单位有活性反应中心吸收的光能、捕获的光能、用于电子传递的能量和热耗散的能量[26]。雾灵香花芥(塞)的比活性参数均显著高于雾灵香花芥(雾),表明在引种地环境条件下,其反应中心数量降低,迫使剩余有活性反应中心的功能增加,进而表现出单位反应中心比活性参数的增加。冯芳等[31]、赵佳伟等[32]的研究结果显示,反应中心吸收过剩光能会影响反应中心的运转效率,进而影响光合性能,这可能是导致雾灵香花芥(塞)的光合性能低于雾灵香花芥(雾)的因素之一;同时也有研究发现,花青苷具有过滤、衰减及反射光能的作用[33],雾灵香花芥(雾)叶片内花青苷的存在降低了其光能的吸收比例,从而避免了过剩光能的潜在危害。欧亚香花芥PSⅡ反应中心运转机制与雾灵香花芥(雾)类似。净光合速率是光合系统功能的直接体现,是评价植物光合性能的重要指标[29]。本研究中,雾灵香花芥(塞)的净光合效率低于雾灵香花芥(雾),可能原因是前者蒸腾速率低导致其叶片水汽亏损,气孔导度降低,限制了外界CO2进入,使得净光合速率下降,水分利用效率也随之降低;欧亚香花芥具有较高的净光合速率和较低的蒸腾速率,因而水分利用效率较高,光合性能较强,这与李鑫豪等[34]关于油蒿(Artemisia ordosica)的研究结果一致。
相关性分析(Pearson)是研究两个变量间线性相关关系最常用的方法,冗余分析(RDA)则是研究变量组间关系的方法,是约束化的主成分分析,能够对解释变量进行优选并对其影响重要程度进行排序[35-36]。李娟霞等[14]利用Pearson 和RDA 分析研究兰州市6 种园林植物的叶片形态及光合生理特征二者的关系,优选出叶干物质含量是对光合特性影响最为显著的解释变量,王向英等[37]也借助Pearson 和RDA 分析推测出钾元素在小油菜(Brassica chinensis)生长发育中发挥重要作用。植物光合特性受多个叶片结构性状相互影响[21],同时各性状间可能存在较大的相关性而增加问题分析的复杂性,因此本研究采用Pearson 和RDA 分析方法研究两种香花芥属植物叶片结构与光合生理的关系。Pearson 和RDA 分析结果均显示,PPT/SPT、SPT、ETD、LA、SR、VD、PPT 和VBD 等8 个叶片结构参数与光合生理参数的相关性较强,说明此类指标可作为研究两种香花芥属植物光合生理变异的可靠指标,而PPT/SPT 对光合生理变化作用力最强,表明其是两种香花芥属植物生态适应性及资源获取的主要驱动因素,未来可作为筛选高光效香花芥属种质资源的重要参考指标。
4 结论
本研究以欧亚香花芥和河北省2 个野生型雾灵香花芥为试验材料,系统研究了其叶片形态、解剖结构、色素含量、叶绿素荧光及光合参数等,并进一步探讨了叶片结构与光合生理间的关系。结果表明,2 个野生型雾灵香花芥的叶片结构与光合生理均发生了种内变异,它们二者与欧亚香花芥也存在种间差异,但这两种香花芥属植物叶片组织结构均较为紧密,具备较高的光合效率;Pearson 和RDA 分析结果表明,PPT/SPT 对光合生理的影响最为显著(P<0.05)。总体而言,两种香花芥属植物均在试验地生长状况良好,其中欧亚香花芥表现出良好的品种优势,而2 个野生型雾灵香花芥表现出较高的引种适应性。关于两种香花芥属植物叶片结构及光合生理的基础性研究,为日后香花芥属植物栽培、人工选育新品种及园林应用提供了理论依据。
