运用网络药理学和分子对接技术探究氧化苦参碱治疗骨关节炎的作用机制*
2022-08-05叶柏柏林城王心宁常征辉李林福
叶柏柏,林城,王心宁,常征辉,李林福
1.赣南医学院,江西 赣州 341000; 2.河南中医药大学,河南 郑州 450046
骨关节炎(osteoarthritis,OA)属于膝关节退行性病变,故又称退行性关节炎,通常表现为骨关节软骨变形、破坏及增生等特点,因其患病人数和患病率都位列世界排行首位,被世界卫生组织定义为“第一致残疾病”,致残率高达53%[1]。据报道,OA已经给患者带来了严重的经济负担,目前,我国OA患病率高达5.1%以上,而英国、美国成年人患病率就已高达5%~10%[2]。迄今为止,国内外依旧缺乏有效且经济的治疗方法来治愈OA。
氧化苦参碱(oxymatrine,OM)是苦参碱类生物碱,大量研究表明,其有多种生理药性,如抗心律失常、抗感染、抗肿瘤、调节免疫、保护肝脏、抗病毒、抗氧化等[3-9]。OM有良好的药代动力学(ADME)特性,通过TCMSP数据库查询到OM的OB(Oral Bioavailability)值为0.35,DL(Drug Like)值为0.28,而且OM的碱极性适中,易溶于水和醇类溶剂,方便药物制剂。此外,OM在很多药用植物中存在,具有来源广泛的特性,尤其是苦参、苦豆子、白刺花等豆科植物中含量高达1%以上。基于上述成药性好、经济易得的优势,使其具备良好的药物开发前景。
有报道表明,OM治疗OA具有显著作用[10-11]。相对于其他常见的药理活性,OM在治疗OA方面的研究不多,尤其是机制方面不够明确。网络药理学是一种高效的生物信息学工具,可用于预测活性成分治疗疾病的候选靶点和潜在机制[12-13]。本课题组参照文献[14]中采用的网络药理学方法,对OM治疗OA的作用机制进行系统的预测,并辅以分子对接验证,为后续的研究提供理论基础。
1 材料与方法
1.1 数据库和软件本研究所涉及的一些数据库及软件汇总,见表1。

表1 数据库和软件汇总
1.2 获取化合物目标靶点在TCMSP数据库中以“oxymatrine”为化合物名称项检索词来获取OM的目标靶点。同时,在ZINC数据库检索中以“oxymatrine”为化合物名称项检索词以获取OM的mol2格式,再将OM的mol2格式分子结构上传到Pharm Mapper数据库平台,靶点类型选择“Human Protein Targets Only”,设定靶点数为300,完成在该平台OM目标靶点的预测。最后将两个数据库获取的目标靶点合并去重,得到OM的目标靶点。
1.3 获取OA潜在作用靶点以“osteoarthritis”为疾病项检索词,在OMIM和Gene Cards数据库中检索OA相关基因,合并从这两个数据库中获取的基因,去重,将其相关基因编码的蛋白作为药物治疗OA的潜在作用靶点。
1.4 OM和OA的交集靶点应用Draw Venn Diagram在线服务平台将OM(drug)的目标靶点和OA(disease)的潜在作用靶点进行交集,将两者交集出的靶点作为OM治疗OA的潜在作用靶点。
1.5 构建蛋白互作网络及筛选核心靶点于在线数据库STRING 10.0 (http://string-db.org) 中将获取的交集基因上传至“Multiple Proteins”项,在“Organism”项下选择“Homo sapiens”“minimum required interaction score”选择>0.70,在线生成PPI 网络,计算度值最前的20个核心基因,并绘制其柱状图。
1.6 基因本体(gene ontology,GO)与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析在Dvid V 6.7在线平台(https://david-d.ncifcrf.gov/home.jsp) 对交集所得到的基因进行GO富集分析和KEGG通路富集分析。将阈值设定为P值<0.05后,取排在前20的GO term和KEGG通路,再用R包绘制气泡图进行分析。
1.7 构建交集基因-GO-KEGG网络应用Cytoscape 3.7.1软件 (http://www.Cytoscape.org/) 构建交集基因-GO-KEGG网络,将前面已获取的交集靶点、GO富集分析结果和KEGG富集分析结果导入软件,通过网络节点度值(degree)的大小对网络进行分析以探究苦参碱治疗OA的作用机制。
1.8 分子对接验证先以“oxymatrine”为关键词在PubChem数据库检索下载其2D结构的SDF文件,再从RCSB PDB下载筛选出来的核心靶点蛋白质结构的PDB文件,运行Discovery studio 2019软件将化合物小分子与核心靶点蛋白大分子对接验证。
2 结果
2.1 OM治疗OA的潜在靶点基于数据库平台Pharm Mapper及TCMSP在线检索得到的化合物靶点经合并去重后,共得到155个OM目标靶点;基于数据库平台OMIM和Gene cards在线检索得到的疾病相关基因经合并去重后,共得到3 114个OA相关基因。两者经过韦恩图交集,共得到80个OM治疗OA的潜在靶点,见图1。
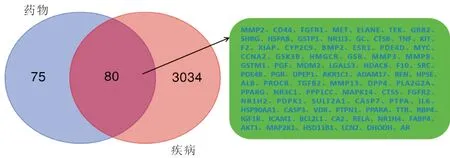
图1 交集后得到的OM治疗OA的潜在靶点
2.2 构建蛋白互作网络及筛选核心靶点将OM和OA的交集靶点导入STRING在线网络平台中,再选择互作评分>0.70,得出PPI网络图,将离散点隐藏,统计得到244条边和72个节点。按照度(degree)值排序筛选出最高的前30个蛋白质节点。核心节点是指某蛋白质拥有的边数为所有蛋白质平均边数两倍以上的节点,即拥有的边数>13.56。由图2B可知,前30个蛋白质均>26,都为核心节点。其中,排名前5位的依此为:AKT1(26)、白细胞介素-6(interleukin-6,IL-6)(26)、SRC(23)、MYC(19)和肿瘤坏死因子(tumor necrosis factor,TNF)(18),见图2。
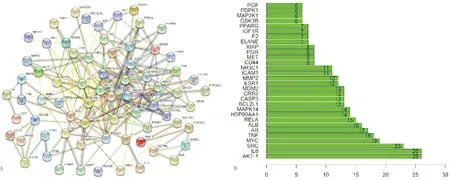
注:A:交集基因的PPI网络图;B:前30个核心交集基因柱状图图2 交集基因PPI网络图和前30个核心交集基因柱状图
2.3 GO term富集分析采用DAVID在线服务平台对OM治疗OA涉及的80个蛋白质的GO term进行富集分析。对分析所得的结果进行筛选,设定 p.adjust<0.05以及FDR<0.05,涉及到分子功能的条目共有119个,再按照P值列出前20个较为显著的条目,见图3。由图3可知,OM治疗OA时涉及的基因功能主要有:endopeptidase activity(内肽酶活性)、DNA-binding transcription factor binding(DNA结合转录因子结合)、DNA-binding transcription activator activity,RNA polymerase II-specific(DNA结合转录激活因子活性,RNA 聚合酶 II 特异性)、DNA-binding transcription activator activity(DNA结合转录激活剂活性)、nuclear receptor activity(核受体活性)。
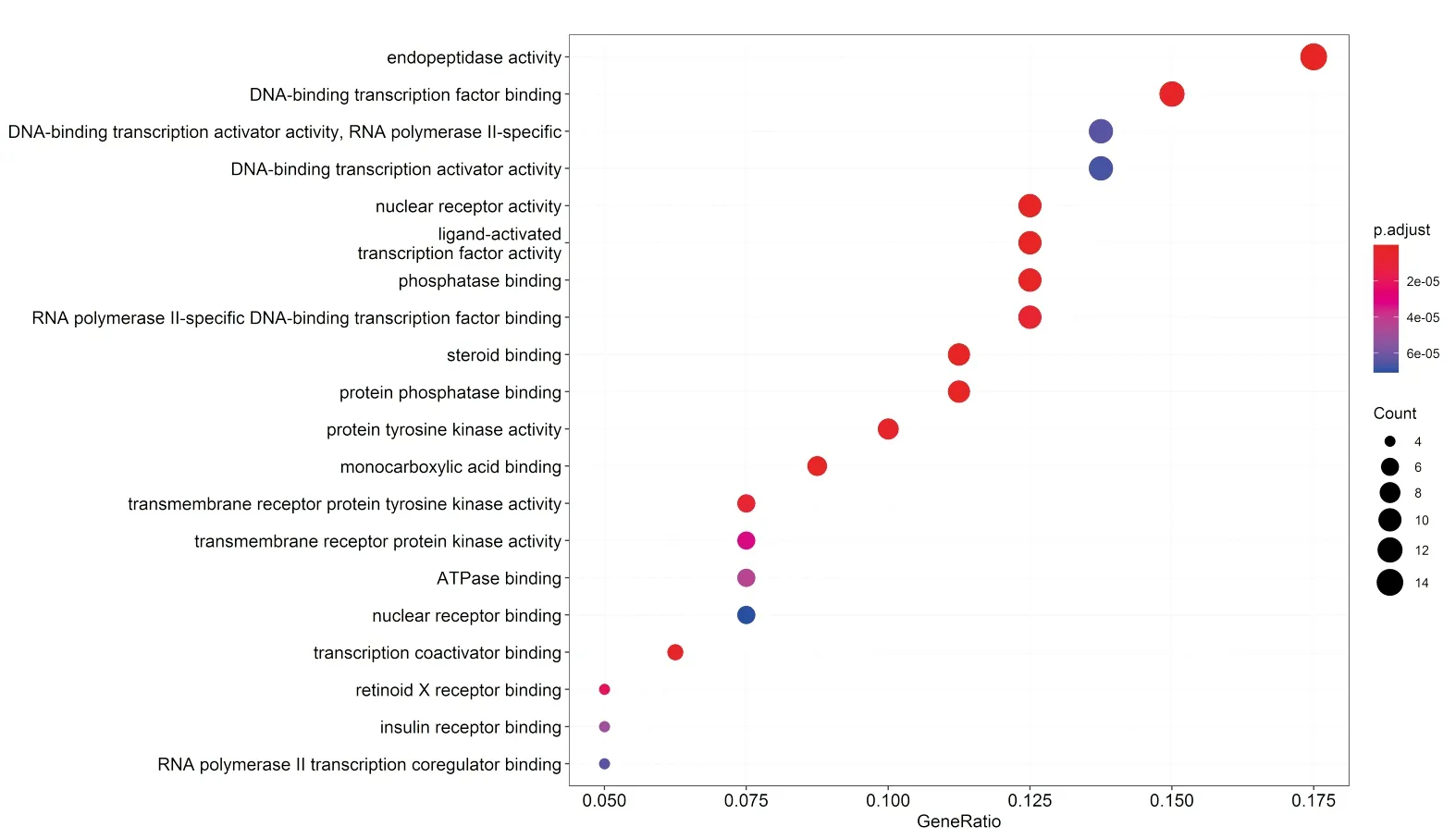
图3 交集基因GO term富集的前20个条目
2.4 KEGG通路分析采用DAVID在线服务平台对OM治疗OA涉及的80个蛋白质的KEGG通路进行富集分析。对分析所得结果进行筛选,设定p.adjust<0.05以及FDR<0.05,涉及到治疗OA的信号通路共有129个,再按照P值列出前20个较为显著的条目,见图4。由图4可知,OM用于治疗OA时涉及的信号通路主要有:proteoglycans in cancer (癌症蛋白聚糖)、PI3K-Akt signaling pathway(磷脂酰肌醇3激酶-蛋白激酶 B 信号通路)、Lipid and atherosclerosis(血脂和动脉粥样硬化)、MAPK signaling pathway(MAPK信号通路)、Chemical carcinogenesis receptor activation(化学致癌受体激活)、Prostate cancer(前列腺癌)。
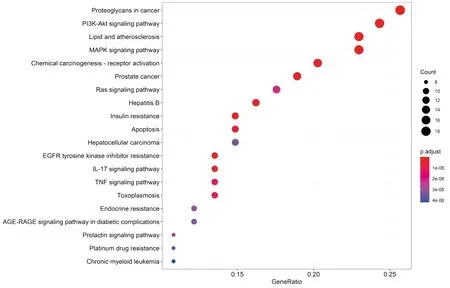
图4 交集基因KEGG通路富集的前20个条目
2.5 交集基因-GO-KEGG网络分析如图5所示,在交集基因-GO-KEGG网络图中,涉及到OM治疗OA的交集基因有63个节点、GO term有10个节点和KEGG信号通路有10个节点。其中,长方形为交集基因,三角形为GO term,V形为KEGG信号通路,每两个节点之间有连接就说明他们之间有潜在的联系,GO term-交集基因边106条以及KEGG信号通路-交集基因边143条,这说明OM治疗OA时,可能涉及多个靶点,有多种生物效应共同参与,并存在多种作用机制。按度值大小排序,前五的交集基因依次为:RELA(13)、AKT1(12)、ESR1(9)、GRB2(9)、PPARA(9)。
2.6 分子对接结果将从PubChem数据库检索下载得到的OM三维结构(SDF格式)与筛选出前5个核心靶点进行分子对接验证。小分子与靶点的对接结果为:Libdockscore>100时,表明两者能够自由、稳定对接。如表2所示,OM与各靶点对接得到的Libdockscore均>92,表明OM和核心靶点能够相对稳定地对接,见表3。由图6可知,OM主要是通过传统氢键、碳氢键、P-Pi共轭、碱基孤对电子与靶点结合。
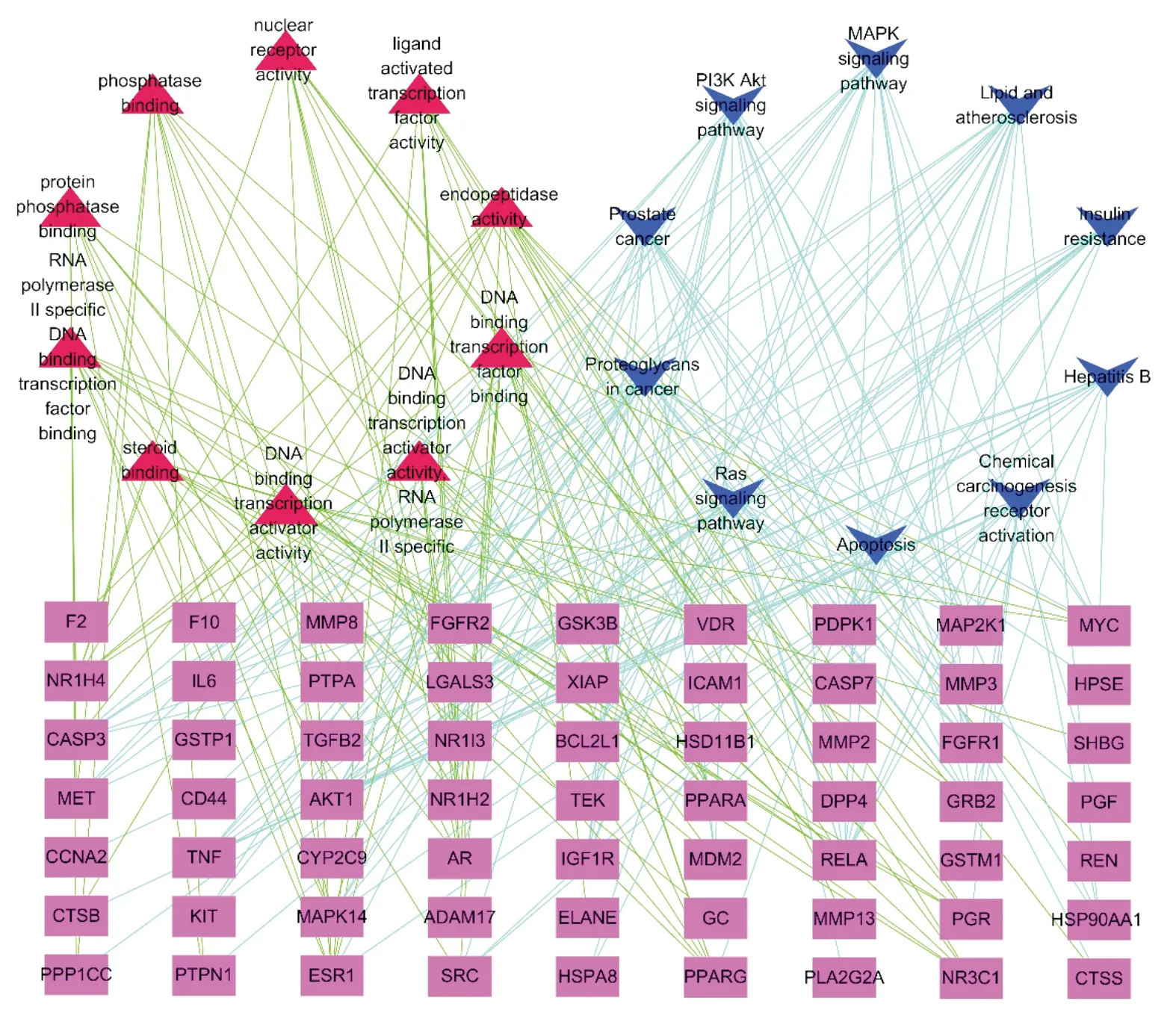
注:长方形为交集基因,三角形为GO term,V形为KEGG信号通路图5 交集基因-GO-KEGG网络图

表2 分子对接结果
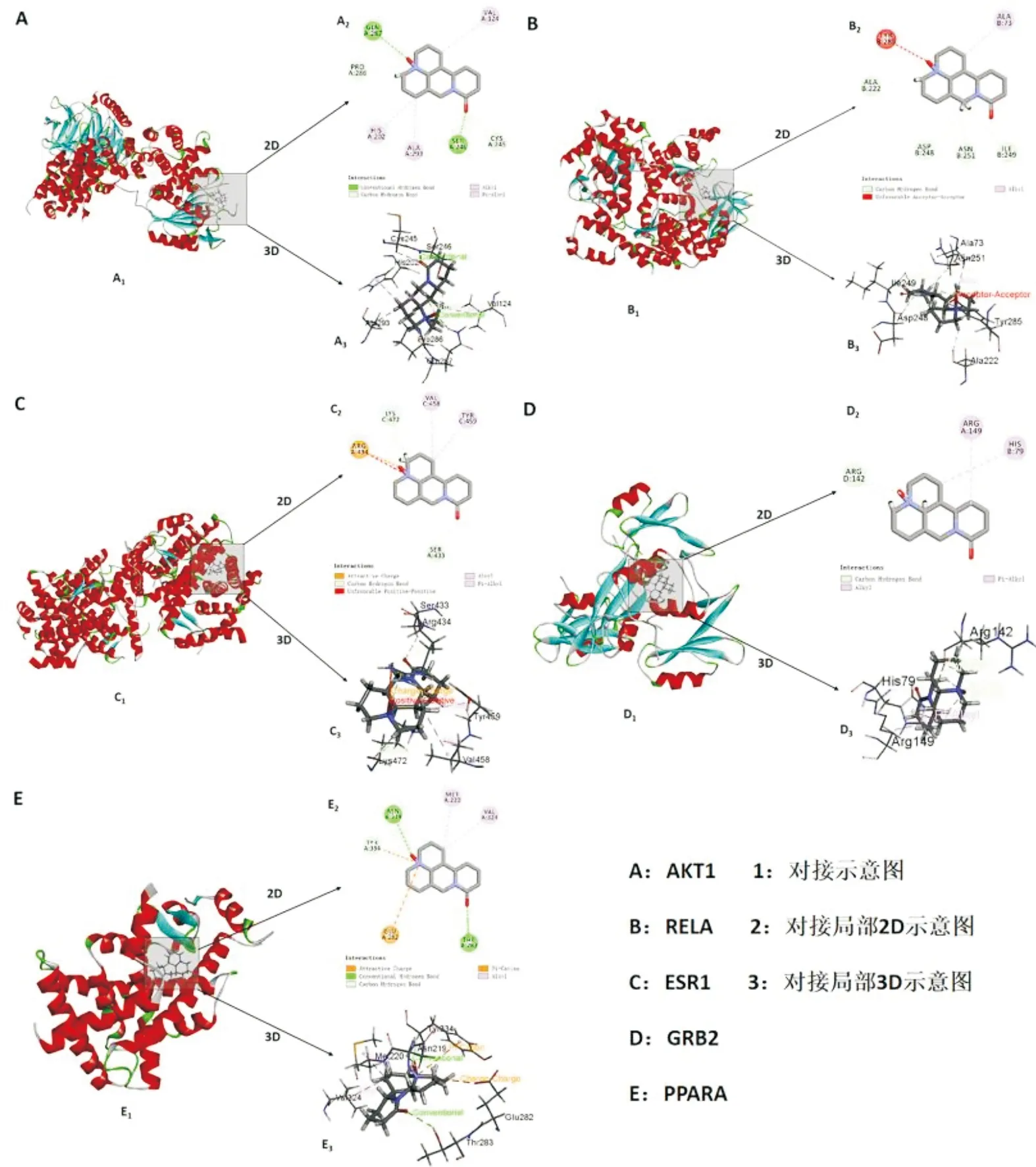
图6 Oxymatrine与核心靶点对接示意图
表3 基因表达蛋白及蛋白RCSB号
3 讨论
OA是由于关节退行性功能失调引起的慢性疾病,病因包括老年化、肥胖、运动损伤、炎症及遗传易感性等[15],该病程所涉及的生物效应数不胜数,分子机制更是复杂,已经报道证实的就有PERK/Bip信号通路、p38MAPK信号通路、Wnt/β-catenin 信号通路、NF-κB信号通路、TLR/MyD88信号通路、TGF-β /BMPs信号通路、细胞骨架信号通路,以及某些与他们存在cross-talk的信号通路等[16-20]。使用不同的活性成分治疗OA,其治疗过程中涉及的靶点、机制各有不同[21-23]。在本研究中,共交集得到80个OM治疗OA的目标靶点,获取AKT1、IL-6、SRC、MYC和TNF等核心靶点,富集到119个GO条目和129条KEGG通路。GO条目和KEGG通路中,涉及最多的基因依次为:RELA、AKT1、ESR1、GRB2、PPARA。
本研究经PPI网络分析得到AKT1、IL-6、SRC、MYC和TNF等核心靶点,表明OM治疗OA时,上述蛋白质参与的概率最高,被旁路激活的可能性最大。而如上述的GO条目和KEGG通路中涉及最多的基因为:RELA、AKT1、ESR1、GRB2、PPARA。这表明,在优选的GO条目和KEGG通路中,RELA、AKT1、ESR1、GRB2、PPARA的共有率最高。将两种情况进行比较分析,发现均存有AKT1,表明其代表性较强,具有一定的研究意义,后续值得关注。
GO条目中,P值较为显著的前5个依次为:endopeptidase activity(内肽酶活性)、DNA-binding transcription factor binding(DNA结合转录因子结合)、DNA-binding transcription activator activity,RNA polymerase II-specific (DNA 结合转录激活因子活性,RNA 聚合酶 II 特异性)、DNA-binding transcription activator activity(DNA结合转录激活剂活性)、nuclear receptor activity(核受体活性),他们与OA的发病有着密切联系。内肽酶活性可催化多肽链中内部α-肽键的水解,如MMP-3作为具有细胞外活性的锌依赖性内肽酶,在OA的产生过程中起着重要作用[24]。DNA结合转录因子结合则是通过与基因调控区内特定的DNA序列相互作用来调节转录。DNA 结合转录激活因子活性是指RNA 聚合酶II特异性激活或增加由RNA聚合酶II转录的特定基因集的转录。DNA结合转录激活剂活性可以通过激活或增加特定基因组转录来影响DNA结合转录因子活性。核受体活性是一种可以通过与DNA结合的方式来抑制或者减少特定基因组转录的辅助抑制活性。上述的后4个GO条目在细胞内遗传信息流通是极为常见的,OA的发生过程中也是必不可少的,如TNF-α诱导的MEK/ERK信号通路在产生OA时就涉及Egr-1的DNA 结合[25]。
KEGG信号通路中,P值较为显著的前5个依次为:proteoglycans in cancer (癌症蛋白聚糖)、PI3K-Akt signaling pathway(磷脂酰肌醇3激酶-蛋白激酶 B 信号通路)、Lipid and atherosclerosis(血脂和动脉粥样硬化)、MAPK signaling pathway(MAPK信号通路)、Chemical carcinogenesis receptor activation(化学致癌受体激活)、Prostate cancer(前列腺癌)。肿瘤微环境中的许多蛋白多糖对各种类型癌症的生物学效应如增殖、黏附、血管生成和转移起着关键作用,还有些和生长因子、细胞因子等相关。癌症蛋白聚糖信号通路中存在cross-talk,可激活TGF-β /BMPs、Wnt/β-catenin、p38MAPK、PI3K-Akt等能诱导OA的信号通路。血脂和动脉粥样硬化信号通路一般是通过激活PI3K-Akt信号通路、TNF信号通路、TLR/MyD88信号通路来产生作用。化学致癌受体激活信号通路则是通过激活PI3K-Akt信号通路、JAK/STAT信号通路来实现。前列腺癌信号通路可激活PI3K-Akt信号通路、MAPK信号通路来起作用。此外,上述5条KEGG信号通路均涉及到细胞凋亡,而细胞凋亡是导致OA的重要原因。因此,OM可能通过上述信号通路发挥对OA的治疗作用。
运用分子对接技术验证OM与各靶点的结合性能时,发现对接得到的Libdockscore为92~107,说明OM对核心靶点具有一定的结合能力,但并非十分稳定。分析OM与各核心靶点的分子间作用力种类与数量,发现主要依靠数目较少的传统氢键、P-Pi 共轭、碱基孤对电子进行结合,甚至有的主要依靠碳氢键这种弱作用力进行结合,结合能力相对较弱。已有研究表明,由于苦参碱类天然生物碱的自身结构特点,其与众多靶点进行对接时的Libdockscore都偏低[26]。生物碱类具有较强生理活性的同时,也有较大的不良反应,这种相对较弱的结合能力,亦可能是自然药学观下的机体保护作用,即药物与受体结合发挥药效之后尽快解离以免产生过多的不良反应。
本研究运用网络药理学对氧化苦参碱治疗骨关节炎的作用机制进行了预测及分子对接验证,并分析了前五个最为核心的靶点、GO条目及KEGG通路,为后续研究的模型选择、验证实验提供了信息导向。
