复合保鲜剂对团头鲂尸僵过程中品质变化的影响
2022-08-04董轶群罗鑫牛素敏谢定源
董轶群,罗鑫,牛素敏,谢定源
(华中农业大学 食品科学技术学院,湖北 武汉,430000)
团头鲂(Megalobramaamblycephalala),又名武昌鱼、鳊鱼等,为鲤科鲂属水产鱼类,其生长速度快、肉质鲜嫩、营养价值高[1],且下腹部尤其肥美,适合清蒸和红烧,受到广大消费者的欢迎。鱼类死后会经历僵直、成熟、自溶、腐败4个阶段,其中僵直阶段的鱼肉质粗硬、弹性差、持水力低,不适于食用,成熟阶段的鱼肉质柔嫩、弹性回升、持水力增强,是食用的最佳时机,因此,为了提高鱼类的宰后利用水平,需要了解鱼类宰后尸僵过程中的各项品质变化。
目前市面上的保鲜方法种类很多,常见的如冷藏[2]、冻藏[3]、辐照[4]、超高压[5]、生物保鲜剂[6]等。近年来,国内外研究学者相继开展水产品保鲜与品质评价分析。其中,孙小惠等[7]发现20 g/L壳聚糖+体积分数0.5%醋酸适用于鲤鱼保鲜,可使其货架期延长2 d;JIA等[8]评估了茶多酚对鲢鱼的抗菌效果,发现鲢鱼经茶多酚处理可有效提高其感官评分、抑制微生物生长以及减轻化学品质恶化,且1%茶多酚溶液的效果优于0.5%;李佳艺等[9]发现经复合保鲜液(10 mg/mL壳聚糖+5 mg/mL茶多酚+2 000 U/mL溶菌酶)处理后草鱼片的K值、汁液流失率和挥发性物质等增长速率明显低于对照组(无菌水)。鉴于此,本实验通过正交试验,确定壳聚糖、茶多酚、溶菌酶的最佳配比,进而测定复合保鲜剂处理后的团头鲂在4 ℃下冷藏72 h白度、质构、pH值、持水力、挥发性盐基氮(total volatile base nitrogen,TVB-N)、K值和菌落总数的变化,探究复合保鲜剂对团头鲂尸僵过程中品质变化的影响,旨在为团头鲂的保鲜和加工提供理论参考。
1 材料与方法
1.1 材料与试剂
团头鲂:每尾体重(750±50) g,体长(32.5±1.7) cm,均鲜活健康,购于中百超市,活体运输至实验室立即敲头击毙后宰杀。
ATP、ADP、AMP、肌苷酸(5′-inosine monophosphate,IMP)、次黄嘌呤核苷(inosine,HxR)、次黄嘌呤(hypoxanthine,Hx)标准品均为色谱纯,上海源叶生物科技有限公司;甲醇、磷酸(色谱纯),磷酸二氢钾、磷酸氢二钾、氢氧化钠、高氯酸、硼酸、盐酸(均为分析纯),平板计数琼脂培养基等,国药集团化学试剂有限公司;壳聚糖(脱乙酰度>90%,分子质量为50~100万)、茶多酚(纯度≥98%)、溶菌酶(活力≥20 000 U/mg),均为食品级,北京索莱宝科技有限公司。
1.2 仪器与设备
LC-20A高效液相色谱仪,日本岛津公司;ME104E/02电子天平,梅特勒-托利多上海有限公司;TA.XT Plus质构仪,超技仪器有限公司;笔式pH检测计,香港希玛公司;TDL-5-A离心机,上海菲恰尔分析仪有限公司;DY04-13-44-00立式压力蒸汽灭菌器筒,上海东亚压力容器制造有限公司;超净工作台,上海博迅实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 原料预处理
鲜活团头鲂敲头击毙后,及时宰杀,去鳃、鱼鳞、内脏等器官后,用流动清水冲洗至无血污后切成(2.0±0.2) cm的鱼片,在保鲜剂中浸泡5 min,沥干1 min后放入聚乙烯保鲜袋中,绑紧袋口,置于4 ℃冰箱冷藏。期间,分别在0、2、4、8、12、24、36、48、72 h进行指标测定。
1.3.2 保鲜剂配比的正交试验
经过单一生物保鲜剂的筛选,选择壳聚糖、茶多酚和溶菌酶进行正交试验,确定最佳的复合保鲜剂配比,设计3因素3水平L9(33)正交试验表(表1)。
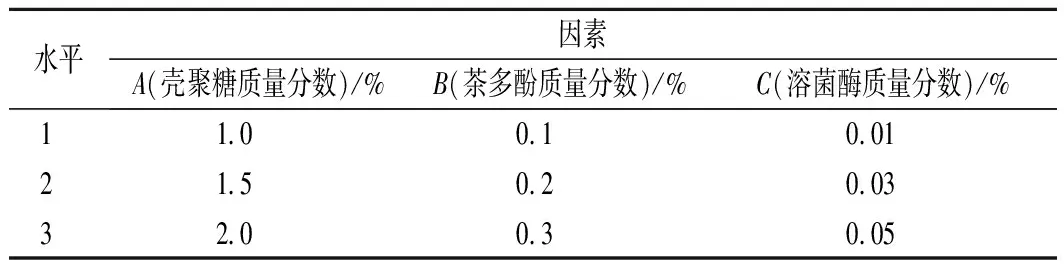
表1 复合保鲜配比正交试验因素水平表Table 1 Table of orthogonal experimental factors of composite preservation ratio
1.3.3 白度测定
采用JIN等[10]的方法测定,使用便携式精密色差仪进行测定。白度(W)按公式(1)计算:
(1)
式中:L*表示亮度,a*表示红绿值,b*表示黄蓝值。
1.3.4 质构测定
采用熊舟翼等[11]的方法,取距离团头鲂头部5.0 cm 处的背部肌肉组织,将鱼肉快速切成20 mm×20 mm×8 mm的立方体,采用TA.XT.Plus 物性测试仪TPA 模式进行测定。
1.3.5 pH值测定
采用王馨云等[12]的方法,用便携式pH计测定上清液的pH值,每次测定前进行校正。
1.3.6 持水力测定
采用常娅妮等[13]的方法,称取(2±0.2) g鱼肉,记下称量质量m1。用干燥滤纸包裹后装入50 mL离心管,离心条件设置为:3 600 r/min,4 ℃,15 min。离心完毕马上剥去滤纸,记下此时质量m2,持水力按公式(2)计算:
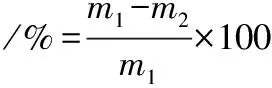
(2)
1.3.7 TVB-N测定
根据GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》,采用半微量定氮法进行测定。
1.3.8K值
根据SCT 3048—2014《鱼类鲜度指标K值的测定 高效液相色谱法》进行测定。鲜度指标K按公式(3)计算:
K值/%
(3)
式中:WHxR、WHx、WATP、WADP、WAMP和WIMP分别为次黄嘌呤核苷、次黄嘌呤、三磷酸腺苷、二磷酸腺苷、腺苷酸和肌苷酸的含量,mg/g。
1.3.9 菌落总数测定
根据GB/T 4789.2—2016《食品微生物学检验 菌落总数测定》进行测定。取背部鱼肉25 g于灭菌袋中,加入无菌生理盐水225 mL,以10倍梯度稀释,取3个适宜的稀释度,每个稀释度做3个平行。
1.4 数据处理
采用SPSS 26.0 软件进行统计分析,采用Origin 2019作图。本实验所列数据为3个试样的平均值,数据以平均值±标准差表示。
2 结果与分析
2.1 正交试验确定最佳复合保鲜剂组合
ATP的降解过程如下:ATP→ADP→AMP→IMP→HxR→Hx[14]。随着HxR和Hx含量的不断蓄积,会导致鲜味下降、苦味产生[15]。K值即HxR、Hx量之和与ATP关联物总量(ATP+ADP+AMP+IMP+HxR+Hx) 之和的百分比[16],K值越小表示越新鲜,越大则越不新鲜[17]。一般认为K值在20%以下为一级新鲜度,20%~40%为二级新鲜度,60%~80%为腐败初期,一级鲜度的鱼肉属于生鲜优良级别。因此本实验选择团头鲂超过一级鲜度范围(K<20%)的临界时间——48 h进行测定,以L9(33) 正交试验探究壳聚糖、茶多酚和溶菌酶的最佳复配比例,得到如表2的正交试验直观分析结果。
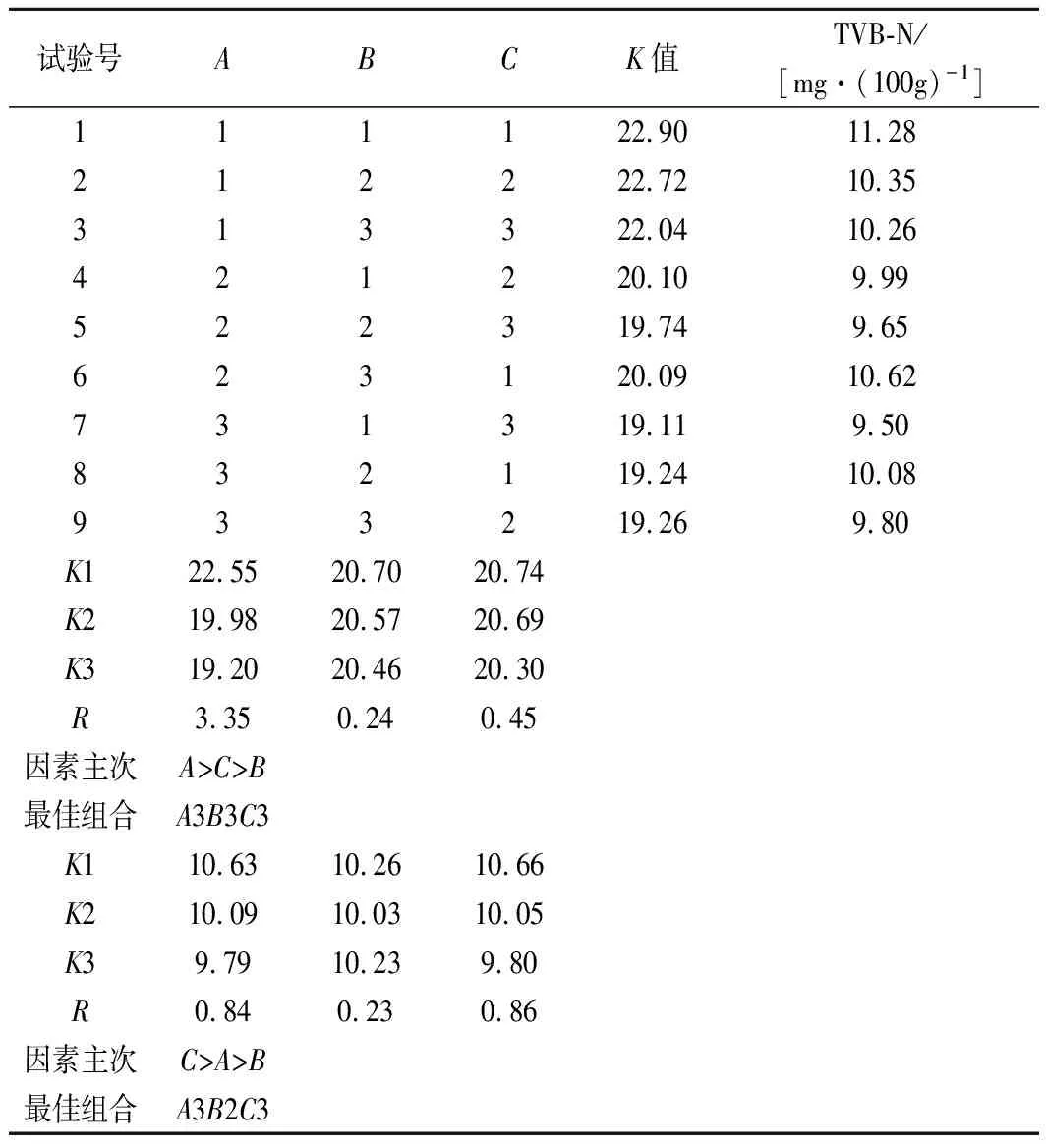
表2 正交试验直观分析结果Table 2 Orthogonal array design matrix and experimental results
对表2中的极差R值等结果进行分析,影响K值的因素主次为:壳聚糖>溶菌酶>茶多酚,影响TVB-N的因素主次为:溶菌酶>壳聚糖>茶多酚。针对K值来说所得的最佳复合保鲜剂组合为A3B3C3,此组合下的保鲜效果最好。针对TVB-N的变化量来说所得的最佳复合保鲜剂组合为A3B2C3,此组合下TVB-N的含量最低。由于2项指标单独分析所得的最优水平组合不同,因此对它们的主次顺序进行综合考虑。由表3可知,壳聚糖对K值具有显著影响,而茶多酚和溶菌酶均无显著影响;由表4可知,溶菌酶和壳聚糖对TVB-N增长有显著影响,且溶菌酶的影响强于壳聚糖,茶多酚无显著影响。因此,选择A3B2C3作为最终的复合保鲜剂配比,即2%壳聚糖、0.2%茶多酚、0.05%溶菌酶。将此组合的复合保鲜剂用于处理团头鲂,与对照组进行对比。
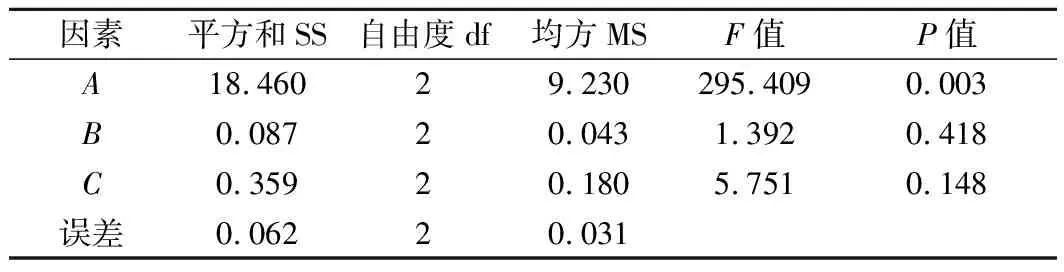
表3 K值方差分析Table 3 Variance analysis of K value
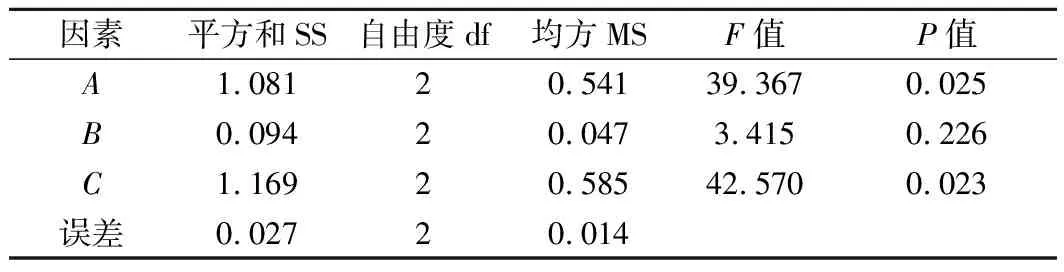
表4 TVB-N方差分析Table 4 Variance analysis of TVB-N value
2.2 复合保鲜剂对团头鲂的保鲜效果
2.2.1 复合保鲜剂作用下团头鲂冷藏期间白度的变化
由图1可知,鱼肉最初白度为43.32±0.23,复合保鲜组在8 h时白度降低到41.53±0.32,12 h时白度为41.03±0.26,鱼肉白度在72 h时达到最小值39.68±0.22。对照组在8 h时白度降低到40.77±0.32,12 h时白度为39.81±0.26,鱼肉白度在72 h时达到最小值38.02±0.23。吴凯强[18]认为带鱼的白度变化与其持水力、高铁肌红蛋白还原酶的活性以及脂质氧化等因素有关,延长贮藏时间将会更加影响消费者的感官体验。可见复合保鲜剂能有效隔绝鱼肉和空气的接触,减缓脂肪氧化所带来的颜色变化,在12~72 h,复合保鲜组白度下降较对照组下降趋势明显减缓,最终白度也比对照组高1.66左右,保持了鱼肉的良好色泽。
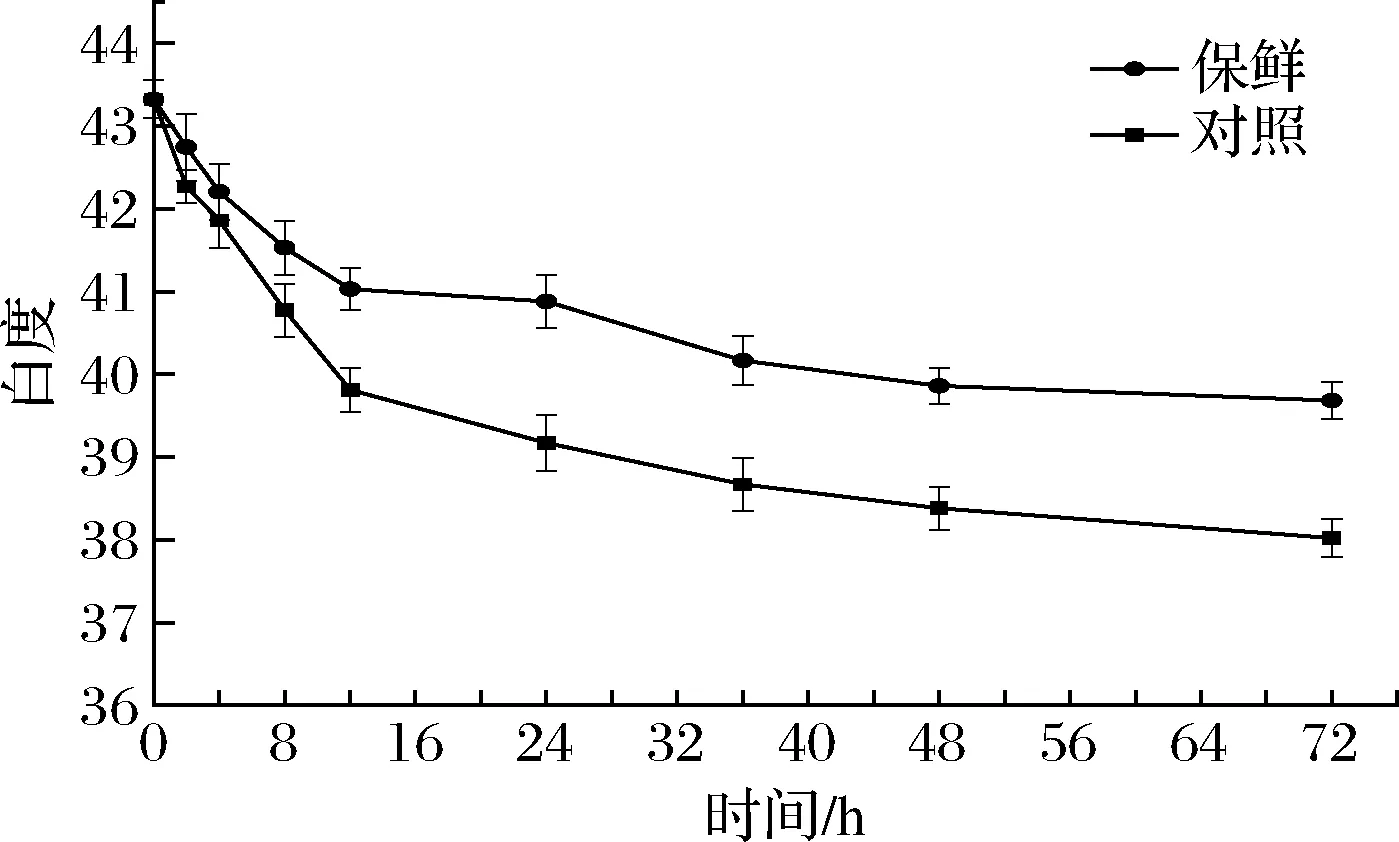
图1 冷藏期间团头鲂白度的变化Fig.1 Changes of whiteness of Megalobrama amblycephalala during cold storage
2.2.2 复合保鲜剂作用下团头鲂冷藏期间质构的变化
由表5可知,对照组的团头鲂初始硬度为(3 862.40±154.92) g,在宰后0~4 h,鱼肉的硬度无显著差异,在8 h时显著增加,达到最大值(4 875.89±686.43) g,8 h之后硬度下降,可以认为鱼体在8 h左右开始解僵进入了成熟期。胶黏性在12 h达到最大值(1 883.40±198.88) g,且在24~72 h 无显著差异。咀嚼性则在12~72 h由最大值(1 064.45±275.00) g降低到(677.03±65.26) g,且在12~72 h内无显著差异。黏性、弹性、凝聚性和回复性在72 h内差异不显著,分别由初始值(41.33±8.11) g·s、0.52±0.11、0.39±0.05和0.32±0.05降低到(35.44±8.73) g·s、0.47±0.05、0.37±0.03和0.30±0.03。LI等[19]研究发现,宰后冰藏2 h后,鲫鱼的硬度、黏性和咀嚼性达到最大值,认为其较佳食用时间为宰后2~4 h。由此,可以认为对照组团头鲂的较佳食用时间为宰后8 h 左右。
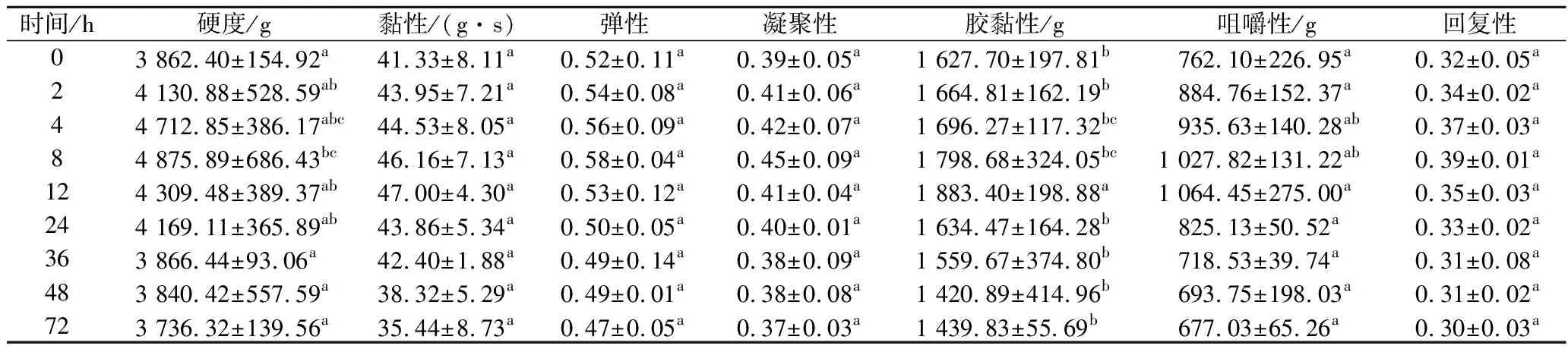
表5 冷藏期间对照组团头鲂质构的变化Table 5 Texture changes of Megalobrama amblycephalala during cold storage (control group)
由表6可知,复合保鲜组的团头鲂初始硬度为(4 001.39±149.07) g,在12 h时硬度达到最大值(5 428.69±93.87) g,比对照组推后了4 h。黏性、胶黏性、咀嚼性和回复性同样在12 h时达到最大值(50.21±2.80) g·s、(2 962.19±319.67) g、(1 666.18±150.69) g、0.40±0.09。弹性和凝聚性在24 h时达到最大值0.61±0.05、0.49±0.01。弹性、凝聚性和咀嚼性在72 h内均无显著差异,黏性和胶黏性在每个相邻的时间段内均无显著差异,回复性在第48 h时产生显著差异。说明复合保鲜剂对微生物和酶类有一定的抑制作用,降低了团头鲂营养成分分解和肌肉软化的速率,硬度下降的时间较对照组更晚。可以认为复合保鲜组团头鲂的较佳食用时间为宰后12 h左右,较对照组延长了4 h。
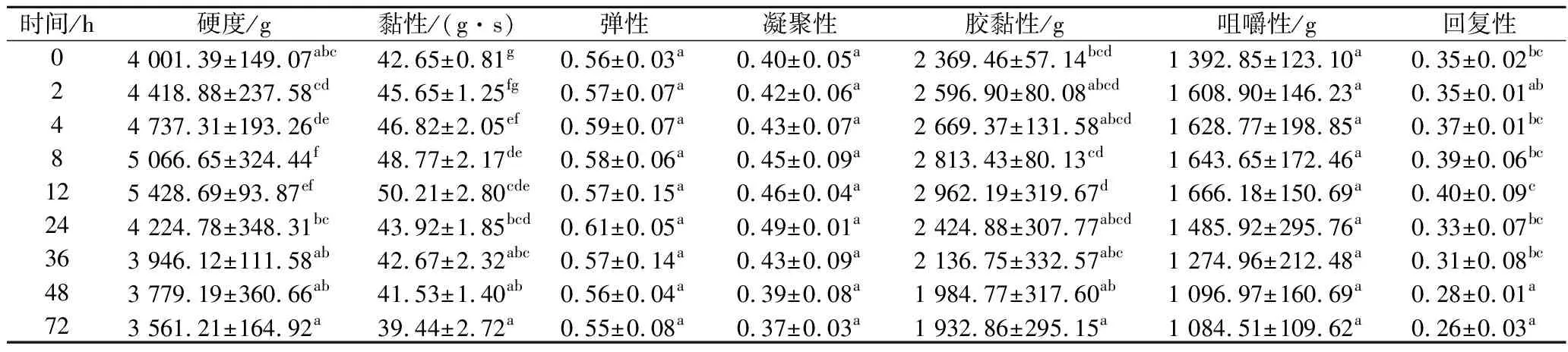
表6 冷藏期间复合保鲜组团头鲂质构的变化Table 6 Texture changes of Megalobrama amblycephalala during cold storage (compound fresh-keeping group)
2.2.3 复合保鲜剂作用下团头鲂冷藏期间pH值的变化
复合保鲜组和对照组的pH值变化呈现相同的趋势,最初降低然后增加。初始pH值的减少主要是由于鱼体内糖原的分解[20],增加则与含氮的碱性化合物产生有关[21]。由图2可知,刚宰杀的团头鲂pH值为7.16±0.06,在宰杀存放8 h内pH值明显下降,但复合保鲜组的pH值仍高于对照组,且从曲线的斜率变化来看,在8~72 h内复合保鲜组的pH值上升趋势较对照组更缓慢,说明复合保鲜剂可以降低微生物分解蛋白质的速率,延长其保鲜期。
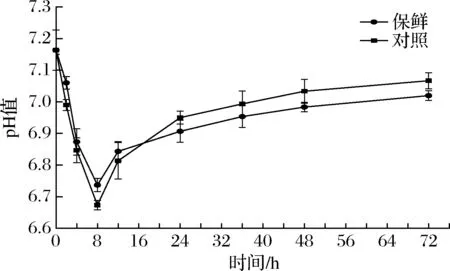
图2 冷藏期间团头鲂pH值的变化Fig.2 Changes of pH value of Megalobrama amblycephalala during cold storage
2.2.4 复合保鲜剂作用下团头鲂冷藏期间持水力的变化
鱼类持水性的大小与其本身的蛋白质结构和肌肉组织弹性等息息相关[22]。由图3可知,刚宰杀的团头鲂持水力为(28.68±1.32)%,复合保鲜组和对照组的持水力在0~8 h内逐渐下降,在8 h时分别达到最低值(23.54±0.68)%和(20.83±2.08)%。随后在8~12 h内持水力呈上升趋势,对照组在12 h时达到最大值(37.35±1.74)%,复合保鲜组达到(40.54±0.81)%,此时鱼肉的持水力最强。对照组在72 h内持水力下降到(16.81±0.82)%,复合保鲜组则下降到(20.48±0.80)%。持水力与团头鲂僵直的过程也有一定关系,僵直阶段持水力降低,与pH值以及蛋白质等电点的变化有关,解僵后持水力开始上升。同时可以看出复合保鲜剂对于团头鲂肌肉组织保持水分的能力有明显效果,保持水分的能力较对照组更强。
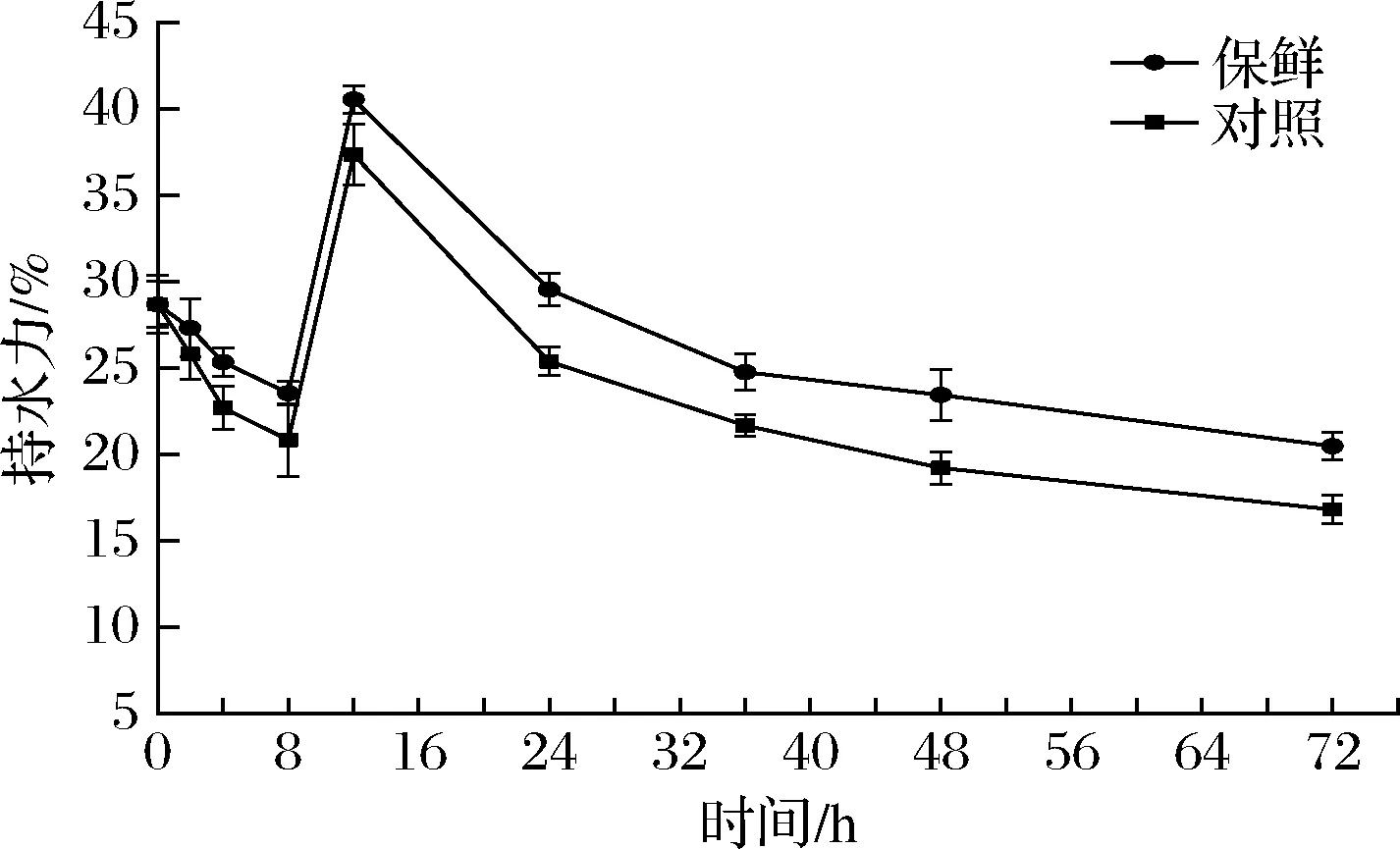
图3 冷藏期间团头鲂持水力的变化Fig.3 Changes of water-holding capacity of Megalobrama amblycephalala during cold storage
2.2.5 复合保鲜剂作用下团头鲂冷藏期间TVB-N的变化
由图4可知,团头鲂刚宰杀时的TVB-N值为(7.49±0.21) mg/100g,复合保鲜组和对照组的TVB-N值均在72 h冷藏时间内不断增加。在0~12 h,两实验组之间的差距不大,随后对照组的TVB-N值增长幅度明显大于复合保鲜组。这说明,复合保鲜剂可以有效降低团头鲂TVB-N值增长的速率,具有良好的保鲜效果。
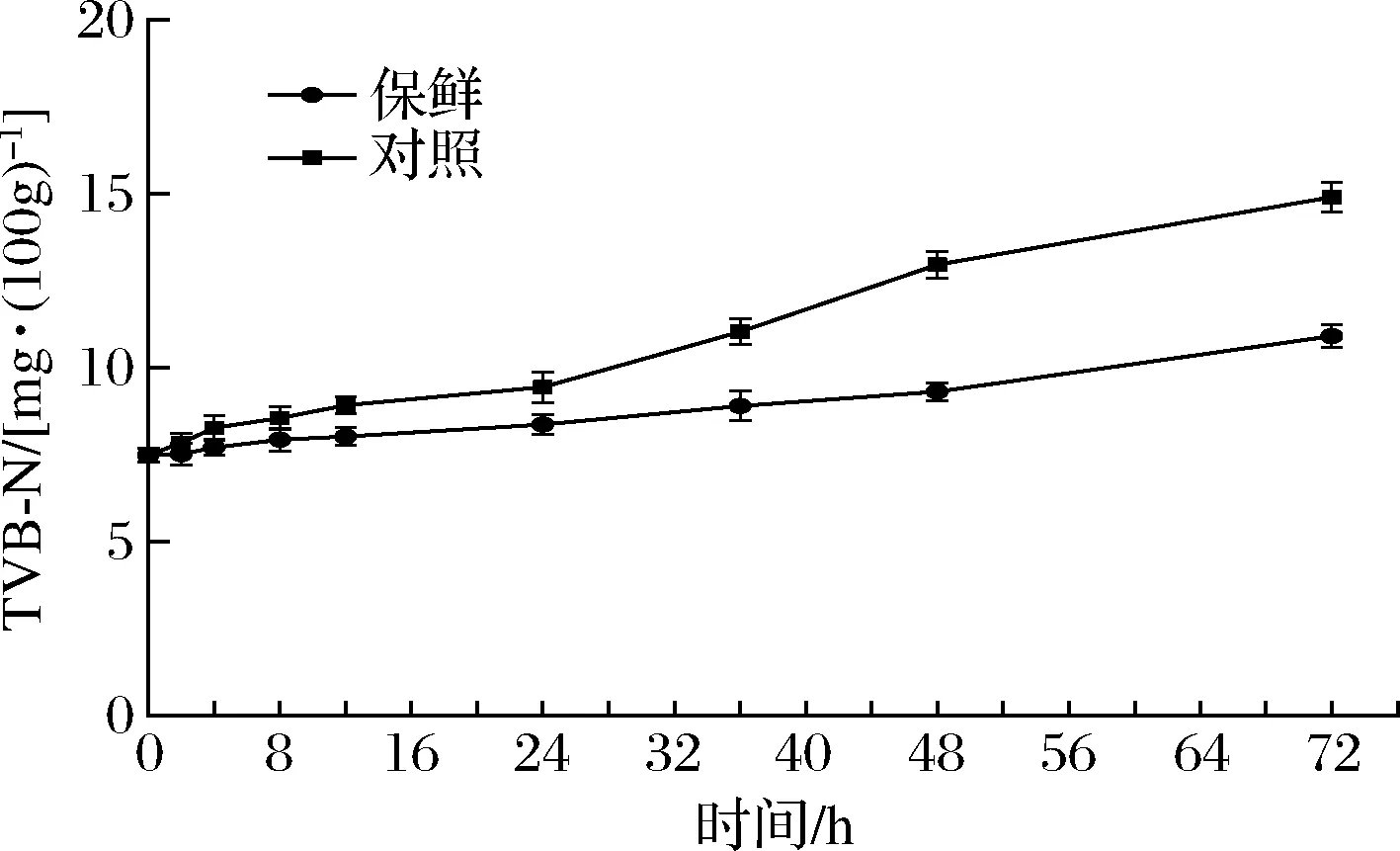
图4 冷藏期间团头鲂TVB-N的变化Fig.4 Changes of TVB-N of Megalobrama amblycephalala during cold storage
2.2.6 复合保鲜剂作用下团头鲂冷藏期间K值的变化
由图5可知,对照组团头鲂刚宰杀时的K值为(7.38±0.45)%,36 h时K值为(19.89±1.49)%,K值随贮藏时间的延长而不断增长,在72 h 时达到最大值(35.99±1.02)%。在0~3 h内,K值低于20%,在48~72 h内,K值低于40%。复合保鲜组的K值在72 h内的上升趋势明显低于对照组,尤其是在第48 h时K值为(18.85±1.27)%,仍然低于20%,处于一级鲜度范围内。而对照组在第48 h时已经超过20%,达到了(25.05±1.57)%。而后K值持续增加,复合保鲜组在72 h时达到最大值(27.77±1.33)%。由此可以认为,对照组的团头鲂在宰杀后36 h内处于一级鲜度,复合保鲜组的团头鲂在宰杀后48 h内处于一级鲜度,且对照组和复合保鲜组的团头鲂在72 h内均保持在二级鲜度。

图5 冷藏期间团头鲂K值的变化Fig.5 Changes of K value of Megalobrama amblycephalala during cold storage
2.2.7 复合保鲜剂作用下团头鲂冷藏期间菌落总数的变化
除了内源酶引起的品质变化,外源微生物滋生也是导致鱼体腐败变质的主要原因,4 ℃不足以抑制细菌的活性,细菌总数会随贮藏时间不断延长,通过测定鱼体的菌落总数可以评价其新鲜程度[23]。由图6可知,团头鲂的初始菌落总数为(3.63±0.21)lgCFU/g,在贮藏72 h内,对照组的增长速率较复合保鲜组更高,最终分别达到(4.54±0.24)lgCFU/g和(4.14±0.16)lgCFU/g。这与复合保鲜剂的抑菌效果有关,通过溶解细胞壁,破坏细菌的完整性,达到抗菌抑菌等作用。
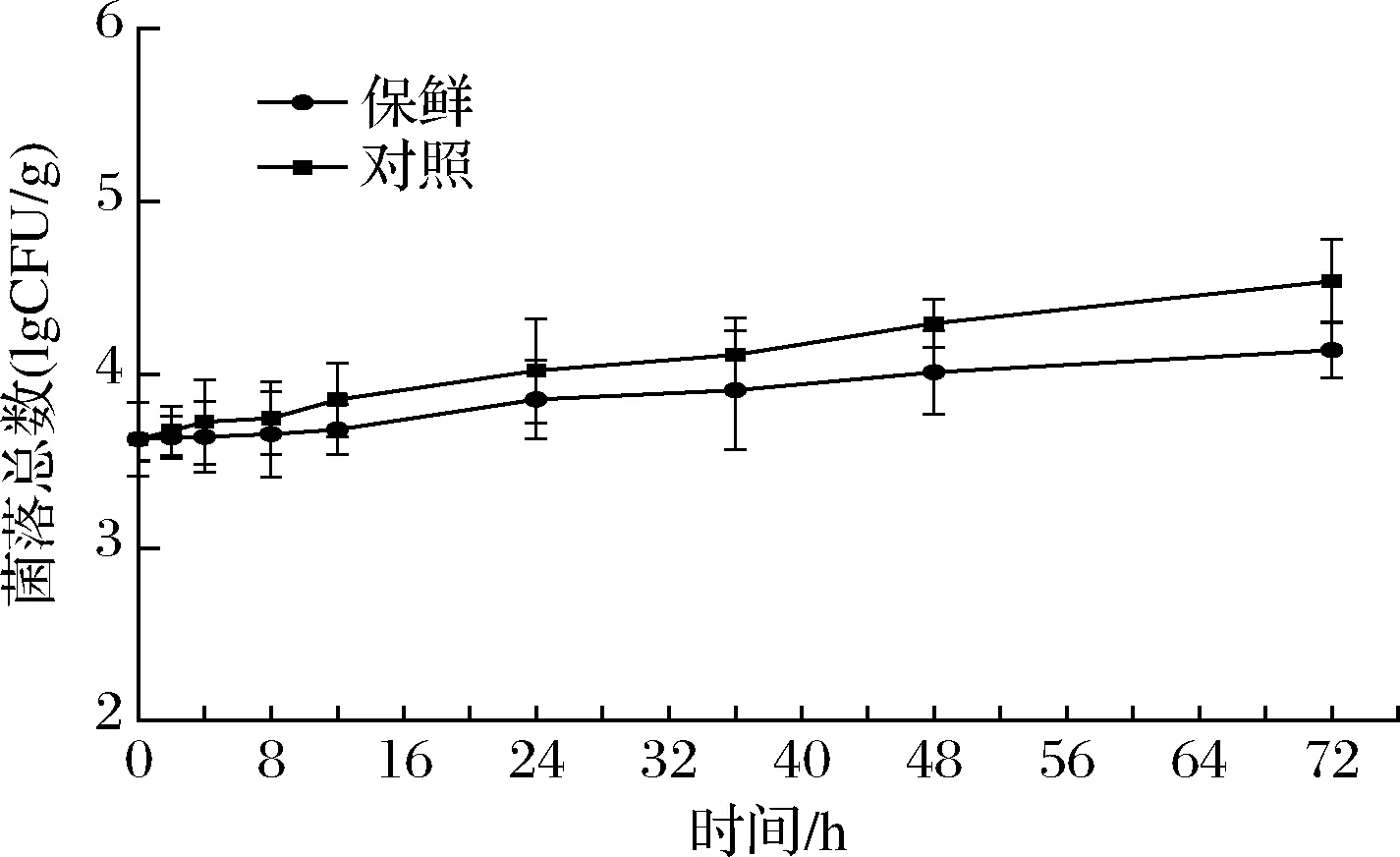
图6 冷藏期间团头鲂菌落总数的变化Fig.6 Changes of total bacteria count of Megalobrama amblycephalala during cold storage
3 结论与讨论
通过正交试验,筛选出复合保鲜剂的最佳配比为:2%壳聚糖、0.2%茶多酚、0.05%溶菌酶(均为质量分数)。在此复合保鲜剂处理下,对团头鲂宰后72 h内白度、质构、pH值、持水力、TVB-N、K值和菌落总数进行了测定和分析。结果显示,复合保鲜剂能隔绝鱼肉和空气的接触,减缓脂肪氧化所带来的颜色变化,抑制其感官品质的恶化;使肌肉组织保持弹性,提高其保持水分的能力,在较长时间内保持良好品质;对微生物和酶类有一定的抑制作用,降低了营养成分分解和肌肉软化的速率,pH值、TVB-N和菌落总数的上升趋势较对照组减缓,使得团头鲂宰后较佳食用时间较对照组延长了4 h左右。同时,复合保鲜剂还能够有效降低K值的增长速率,使得复合保鲜组的团头鲂在宰杀后48 h内保持一级鲜度,较对照组延长12 h,且72 h内K值小于对照组。
