肾癌中细胞自噬的作用及自噬调节剂在肾癌治疗中的研究进展
2022-08-04施声淦蒋培都
施声淦,蒋培都
肾癌是泌尿系统常见的恶性肿瘤,在所有恶性肿瘤中约占3%[1]。肾癌可以分为以下三个主要类型,即肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)、乳头状肾细胞癌(papillary renal cell carcinoma, pRCC)、嫌色细胞肾细胞癌(chromophobe renal cell carcinoma, chRCC)[2]。ccRCC作为肾癌的主要亚型,具有巢状紧密生长并伴有复杂的树状血管及恶性程度高等特点,该文主要围绕ccRCC进行阐述。近年来,全球肾癌的发病率呈现逐年增高的趋势。2018年全球新增肾癌确诊病例40万人[1]。2015年我国肾癌的发病率约为6.9/100万,病死率约为2.3/100万,男女比为2∶1[3]。由于放、化疗对肾癌的治疗效果不佳,目前最有效的治疗方法为手术治疗[4]。然而,肾癌患者的术后5年生存率因确诊时肿瘤分期分级的不同而差异较大,为20%~95%,复发率则高达30%[5]。因此,进一步深入研究肾癌的发病机制,寻找潜在的敏感靶点是治疗肾癌的根本方法。本文着重讨论自噬在肾癌进展中的作用,期望为肾癌患者提供安全且有效的新型治疗策略。
1 细胞自噬
1.1 细胞自噬的概念及体内发生过程细胞自噬(autophagy)是细胞将自身的一些衰老细胞器、错误折叠蛋白等包裹于自噬体中,通过与溶酶体形成自噬溶酶体来降解这些“货物”,从而维持细胞稳态的一种保守过程[6]。自噬通常分为3种:微自噬(microautophagy)、巨自噬(macroautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)[7]。自噬的发生伴有多种自噬相关基因(autophagy-related genes, ATG)的参与,分为启动阶段、自噬体形成阶段、自噬体与溶酶体融合阶段和物质降解与再利用阶段(图1)。自噬起始阶段,在unc-51样激酶1复合物(unc-51 like kinase 1 complex, ULK1C)的帮助下,磷脂酰肌醇-3-磷酸(phosphatidylinositol-3-phosphate, PI3P)将双FYVE结构蛋白1(double FYVE-containing protein 1, DFCP1)与磷酰亚胺(WD repeat protein interacting with phosphoinositides, WIPI)相互作用的WD重复蛋白招募到自噬前体上,之后ATG12-ATG5-ATG16L1复合物和自噬标志物微管相关蛋白1轻链3(microtubule-associated protein light chain 3, LC3)协助隔离膜伸展并形成成熟的自噬体。随后,在同型融合和蛋白分选复合体(homotypic fusion and vacuole protein sorting, HOPS)、突触融合蛋白17(syntaxin 17, STX17)、囊泡相关膜蛋白7/8(vesicle-associated membrane protein 7/8, VAMP7/8)和突触体相关蛋白29(synaptosomal-associated protein 29, SNAP29)等分子的参与下,自噬体与溶酶体融合形成自噬溶酶体。自噬溶酶体将包裹在其内的“货物”降解为一些小分子营养物质(氨基酸和核苷酸等)。

图1 自噬途径涉及隔离膜的形成、延伸、自噬体的成熟以及自噬溶酶体的形成
1.2 细胞自噬的生理功能 自噬广泛存在于真核细胞中,是细胞的一种自我保护机制[8]。细胞自噬的生理功能(图2)主要有以下几点。(1)维持内环境稳态:包括蛋白质质量控制、脂肪稳态、铁稳态、器官稳态、抗衰老以及维持基因组稳定性等多个方面。(2)免疫与炎症:自噬有助于帮助宿主细胞激活免疫系统来控制感染病情的加重同时抑制相关炎症的发生[9]。此外,一些ATG也可以作为炎症反应的信号分子诱导炎症反应的发生。(3)自噬性死亡:当细胞周围的生存条件无法满足生存时,自噬可以主动诱导细胞程序性死亡,即自噬性死亡,来减少非必要的能量消耗[10]。(4)对肿瘤的双重作用:某些肿瘤细胞(肾癌[11]、肝癌[12]等)可以通过自噬途径来抵御营养物质的缺乏以及细胞内低氧状况,从而维持其生长;而自噬也可以通过降解功能失调蛋白质、受损细胞器以及协同其他途径来增强宿主细胞自身的防护力,从而抑制早期肿瘤的生长。

图2 自噬的生理功能
2 细胞自噬对肾癌的双重作用
细胞自噬在肾脏的发育和生理功能方面起重要作用,然而自噬在肾癌的发生发展的某个特定阶段中的确切作用仍然不清楚[13]。下文就目前关于自噬在肾癌中的双重作用进行总结(图3)。
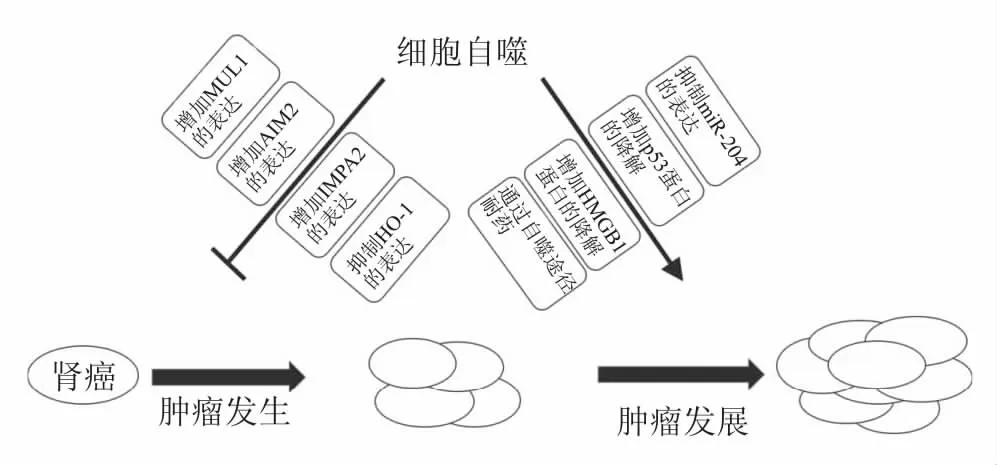
图3 自噬在肾癌中的双重作用:MUL1.线粒体相关E3泛素连接酶;AIM2.黑色素瘤缺乏因子2;IMPA2.肌醇单磷酸2;HO-1.血红素加氧酶-1;HMGB1.高迁移率族蛋白B1
2.1 细胞自噬对肾癌的促进作用 文献报道自噬通过维持肿瘤细胞微环境的稳态而对某些肿瘤细胞起保护作用[14]。Fang等[15]发现肾癌细胞可以通过产生ASPL-TFE3融合基因来激活自噬,从而促进肾癌细胞对脂质和蛋白质的利用。Mikhaylova等[16]发现,肾癌细胞通过增强自噬水平抑制了miR-204表达,从而促进了肾癌细胞的生长与存活。此外,TP53作为一种抑癌基因,其表达产物p53蛋白具有抑制肿瘤发生的作用。Kang等[17]发现肾癌细胞通过增强自噬水平增加了p53蛋白的降解,从而促进了肾癌细胞的发生和发展。Wu等[18]发现肾癌细胞通过高迁移率族蛋白B1(high mobility group box 1, HMGB1)和晚期糖基化终末产物受体(receptor for advanced glycation end products, RAGE)相互作用来诱导细胞自噬,降低肾癌细胞凋亡,最终促进肾癌细胞的增殖。
2.2 细胞自噬对肾癌的抑制作用也有研究表明,增加自噬基因以及相关因子的表达可以缓解肾癌病情的恶化。Wang等[19]发现在体内外实验中,通过ATG7和LC3过表达激活的自噬可以抑制肾癌细胞786-O、769-P、OS-RC-2等的生长与存活。Yuan等[20]发现,线粒体相关E3泛素连接酶(mitochondrial E3 ubiquitin ligase 1, MUL1)可以通过抑制ccRCC细胞中蛋白质聚集体的积聚来激活自噬,从而增强了对ccRCC细胞增殖的抑制。黑色素瘤缺乏因子2(absent in melanoma 2, AIM2)是一种参与免疫反应的感受器,具有抑制癌症的作用。Chai等[21]发现,肾癌患者体内AIM2的表达显著降低,其可以通过增加自噬相关基因(Beclin 1、MAP1LC3A和ATG5)的表达来增强自噬活性,从而抑制肾癌细胞的增殖。Banerjee等[22]发现血红素加氧酶-1(heme oxygenase-1, HO-1)可以降低自噬相关蛋白Beclin 1和LC3-Ⅱ的水平,从而促进肾癌病情的恶化。文献报道肾癌细胞中的自噬水平较正常肾细胞低,进一步研究发现自噬通过降解乏氧诱导因子-2α(hypoxia inducible factor -2α, HIF-2α)来抑制肾癌的生长和发展[23-24]。肌醇单磷酸2(inositol monophosphatase 2, IMPA2)下调通过激活哺乳动物雷帕霉素靶蛋白(mechanistic target of rapamycin, mTOR)信号通路,抑制自噬流的形成,最终促进ccRCC的生长与转移[25]。上述研究表明自噬抑制也可能会促进肾癌进展。
3 细胞自噬与肾癌的治疗
自噬在维持肾脏稳态中起多种作用,其保护肾脏的作用机制可能是通过特异性降解NLRP3炎症小体、清除细胞内突变蛋白等。因此可以通过靶向自噬来制定治疗肾癌的策略。
3.1 自噬诱导剂治疗肾癌研究表明自噬诱导剂可以用来治疗肾癌(表1)。索拉菲尼是经美国FDA批准上市的治疗晚期肾癌的一线药物。Serrano-Oviedo等[26]发现,索拉菲尼通过非依赖于ERK1/2途径抑制AKT信号通路,增加了肾癌细胞的自噬性死亡。研究表明,水飞蓟宾通过抑制单磷酸腺苷酸活化蛋白激酶(adenosine 5’-monophosphate activated protein kinase, AMPK)/mTOR信号通路,增加肾癌细胞中的自噬水平,从而抑制肾癌细胞的生长[27]。白藜芦醇可以上调肾癌细胞中ATG5和ATG7等自噬相关基因的表达水平激活自噬,并通过p53介导的AMPK/mTOR信号通路抑制肾癌细胞的生长和迁移,最终促进其凋亡[28]。青藤碱通过抑制PI3K/AKT/mTOR通路,增加LC3-Ⅱ、Beclin 1蛋白的表达,促进肾癌细胞自噬性死亡,从而抑制肾癌的进展[29]。
3.2 自噬抑制剂治疗肾癌在营养缺乏、氧化应激及缺氧等恶劣条件下,癌症细胞中的自噬被认为是一种保护机制,来确保癌症细胞的生长与增殖[14]。因此,抑制自噬也被认为是一种治疗肾癌的有效手段(表1)。Li等[30]发现,使用氯喹抑制肾癌细胞的自噬流后,可以显著增强舒尼替尼的抗癌效果。此外,Mao等[31]发现,通过联合应用氯喹衍生物羟氯喹和过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α, PPARα)抑制剂GW6471可以显著增加ccRCC细胞的凋亡水平,从而抑制ccRCC细胞的生长。THZ1是广泛应用于肿瘤治疗的一种细胞周期依赖性激酶7(cyclin-dependent kinase 7, CDK7)抑制剂。研究发现,THZ1联合替西罗莫司通过抑制肾癌细胞中的自噬,显著抑制肾癌细胞的增殖,并促进其凋亡[32]。SAR405是一种以高亲和力靶向液泡分选蛋白34(vacuolar protein sorting 34, VPS34)的ATP结合口袋,从而抑制自噬的小分子药物。有研究显示SAR405与依维莫司联用可以显著抑制肾癌细胞的生长[33]。由于肾癌的细胞模型及动物模型并不能完全模拟人类肾癌的病程(包括症状、病理变化等),导致在肾癌的不同阶段、不同的肾癌模型中的自噬水平存在差异,而出现自噬诱导剂和自噬抑制剂都可用于治疗肾癌的现象。
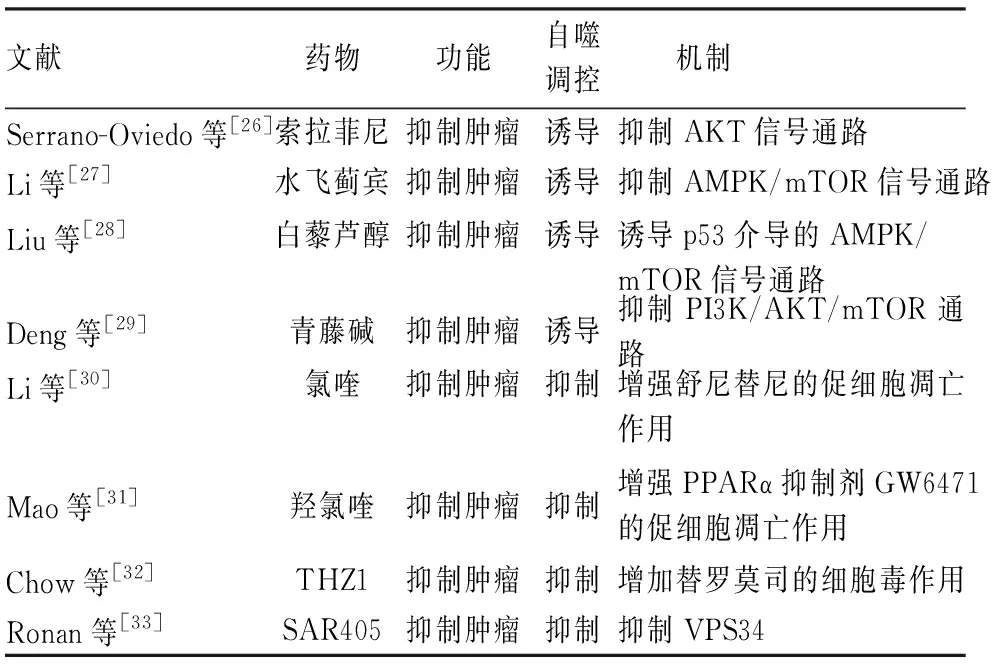
表1 治疗肾癌的自噬药物
4 总结与展望
细胞自噬是细胞内维持能量代谢和内环境稳态的一个重要途径。一方面,自噬通过改变肾癌细胞内环境的稳态,影响其生长与迁移。另一方面,肾癌细胞可以通过自噬途径获取能量和营养物质,从而增强对某些抗癌药物的耐受性,最终促进了肾癌细胞的存活。因此,自噬抑制剂/诱导剂对肾癌具有巨大的治疗潜力。然而,受限于实验技术以及缺乏特异性的自噬生物学标志物,特定阶段肾癌细胞中的自噬状态尚不清楚,因此将自噬诱导剂/抑制剂应用到治疗肾癌的临床实践中,至少需要解决以下几个问题:(1)基础研究层面:①发掘具有代表性和高特异性的自噬生物学标志物,实现体外实时监测肾癌进展过程中的自噬活性。②用细胞或动物模型来准确模拟人类肾癌的症状和病理变化。③明确自噬功能失调在肾癌发生发展中某个特定阶段所起的确切作用。(2)临床应用层面:①在无创或微创条件下准确检测出处于不同阶段肾癌患者中的自噬水平,从而针对性地使用相应的自噬调节药物来进行个体化来治疗。②避免肾癌患者使用自噬诱导剂/抑制剂后导致的体内自噬活性过强或过弱导致的副作用。
为解决上述存在的问题,可以从以下三个方面入手。(1)发掘具有高特异性的自噬生物学标志物及特异性的肾癌动物模型:理想条件下的高特异性自噬生物学标志物可能是患者血液和尿液中的自噬相关基因和蛋白[34],其能够准确地反映出处于不同阶段肾癌的自噬状态,进而通过自噬生物学标志物的改变反映疾病的进程,这样可以减少对患者身体的伤害和经济负担,为肾癌的治疗提供重要参考。特异性肾癌动物模型可以较好地模拟肾癌病程进展,从而为药物治疗及肾癌发病机制的研究奠定基础。例如Harlander等[35]首次报道,Vhl、Trp53和Rb1三基因联合突变可以导致小鼠ccRCC。Bailey等[36]报道在小鼠模型中Myc基因活化可导致高穿透性pRCC,而Myc基因活化后,与Vhl基因和Cdkn2a(Ink4a/Arf)基因联合缺失时,可以产生近似人类ccRCC。(2)确保自噬调节剂的特异性:通过自噬生物学标志物的变化反映疾病的进程,然后针对性地使用自噬抑制剂/诱导剂治疗疾病。由于药物在体内会经过复杂的代谢过程,其发挥药效的作用机制必须明确才可以有效地避免药物毒副作用的产生,从而提高药物的安全性和有效性。因此,自噬调节剂的特异性至关重要。(3)实时监测:由于自噬具有双重作用,通过特异性的自噬生物标志物和(或)一些特殊的影像学技术[37],反映不同阶段肿瘤细胞的自噬状态后,需要对服用自噬调节剂患者体内的自噬状态和血药浓度进行实时监测,避免出现调节过度或不足而加重疾病的现象。相信未来随着技术的不断进步及上述问题的解决,自噬在不同阶段肾癌中发挥的作用会被慢慢揭开,从而为肾癌药物治疗开辟新的领域。
