左氧氟沙星联合小柴胡颗粒对小鼠抗菌止泻的研究*
2022-08-03张五萍伍锡栋侯雄军
张五萍 伍锡栋 寇 光 侯雄军
(1江西省人民医院药学部,南昌 330006)(2.江西省医疗器械检测中心药物安全性评价室,南昌 330006)
抗生素的滥用导致细菌耐药性不断增加,超级耐药性细菌也不断出现,给腹泻、痢疾性等感染性疾病的防控带来了很多的困难[1-2]。腹泻是多因素引起肠道在感染或非感染因素刺激下,肠黏膜出现发炎、肠分泌及运动功能亢进,出现稀便和便频等症状的疾病[3]。近年来腹泻发病率不断上升,严重影响人们的身体健康,左氧氟沙星组可用于病原微生物感染的肺炎、泌尿系统疾病的抗菌治疗,但对细菌感染易产生耐药性,小柴胡颗粒的主要成分为半夏、柴胡、甘草、人参、黄芩、生姜、大枣等,具有疏肝健脾和解少阳、和胃降逆、扶正祛邪的功效。现代药理学研究表明,柴胡具有降血脂、保肝、改善肠道菌群紊乱等作用[4-5]。中医理论认为,肝脏具有主藏血、主疏泄解毒功能,小柴胡颗粒具有保肝功能,间接提示可以促进肝脏血液循环,增强机体对外来邪气的耐受性和抵抗能力。
本研究旨在研究分析联合本身具有抗菌作用的左氧氟沙星与小柴胡颗粒对大肠杆菌感染致腹泻小鼠的抗菌和止泻作用,从而减少大肠杆菌(E.coli)感染致腹泻的小鼠对左氧氟沙星的依赖性使用,降低抗生素的耐药性产生,为细菌性腹泻临床联合用药提供数据参考。
1 材料和方法
1.1 材料
1.1.1主要试剂:小柴胡颗粒(广西嘉进药业股份有限公司,批号20190709),盐酸左氧氟沙星片(安徽万泰制药有限公司,批号20190516),营养肉汤培养基(北京陆桥技术股份有限公司,批号200124),营养琼脂培养基(北京陆桥技术股份有限公司,批号200109);大肠杆菌(E.coli)ATCC(批号160816)购自于北京三药科技开发公司,由中国食品药品检定研究院监制,目前保种于江西省医疗器械检测中心。
1.1.2主要仪器:恒温培养箱(HWS-150,天津泰斯特仪器有限公司),生物安全柜(HR40,海尔仪器设备有限公司),漩涡混合器(Vortex-KB3,海门市其林贝尔仪器制造有限公司)。
1.1.3实验动物:KM小鼠(SPF级),6—8周龄,体质量(20±2)g,雌雄各半,购自于湖南斯莱克景达实验动物有限公司【SCXK(湘)2019-0004】,饲养于IVC实验动物饲养笼具中【SCXK(赣)2018-0006】。自由饮食水。本试验通过江西省药物研究所实验动物伦理委员会审批,审批号为P202105,符合动物试验伦理要求。
1.2 方法
1.2.1菌液制备:将E.coli的菌株划线平板,于37 ℃培养24 h,挑选典型的菌落培养于普通肉汤营养琼脂上,经37 ℃培养24 h。连续传代3次,取其菌落用普通肉汤制作菌悬液,用含1.5%蛋白胨的磷酸盐缓冲液稀释作为试验用菌。
1.2.2最小致死量的测定:(1)感染菌的制备:按无菌法操作,从上述制备好的菌液中采用麦氏计数法制成分别为1012、1011、1010、109、108、107、106cfu/mL的不同浓度菌液。(2)动物致死试验:取体质量为(20±2)g KM小鼠70只,雌雄各半,随机分为7组,每组10只,分别腹腔注射不同浓度的大肠杆菌细菌溶液,0.5 mL/只,观察小鼠在7 d内的死亡情况,确定最小致死量(MLD),即感染后引起小鼠100%死亡的菌液浓度。
1.2.3体内抗菌试验:另取体质量为(20±2)g KM小鼠50只,雄雌各半,随机分为5组,分别为模型组(给予生理盐水)、空白组(给予生理盐水)、左氧氟沙星组(8 mg/kg,小鼠给药浓度计算参照《药理学实验方法》人体表面计算法)、小柴胡颗粒组(114 mg/kg)、联合用药组(左氧氟沙星组8 mg/kg+小柴胡颗粒组114 mg/kg),每组10只。饲养于室温(25±2)℃,相对湿度:65%±5%的IVC笼具中,适应性饲养7 d。禁食24 h,不禁水,除空白组外,其余各组小鼠分别腹腔注射大肠杆菌MLD浓度菌各0.5 mL/只,分别于1、6、12 h灌胃给药1次,以后间隔24 h灌胃给药1次,空白组与模型组灌胃给予0.9%生理盐水,给药组按照剂量浓度给予相应药物,灌胃体积均为0.2 mL/10 g。连续灌胃15 d,观察、记录动物的存活情况,并计算保护率,即存活率=每组存活动物数/每组动物总数×100%。
1.2.4对大肠杆菌致腹泻小鼠的影响[6]:昆明种小鼠 50 只,随机分为5 组,即模型组(给予生理盐水)、空白组(给予生理盐水)、左氧氟沙星组(8 mg/kg)、小柴胡颗粒组(114 mg/kg)、联合用药组(左氧氟沙星组8 mg/kg+小柴胡颗粒组114 mg/kg),每组10只,自由饮水。各组灌胃体积均为0.2 mL/10 g,给药剂量见“1.4.3”项,空白组和模型组均给予0.9%生理盐水,每日1次,连续给药7 d,7 d后在小鼠腹腔内注射大肠杆菌菌悬液(0.5 mL/只),造成大肠杆菌感染致腹泻小鼠模型,空白组腹腔注射等量的生理盐水;3 h后空白组和模型组小鼠均灌胃生理盐水,其余组分别灌胃给予相应药物,灌胃体积均为(0.2 mL/10 g),观察腹腔注射大肠杆菌注射液3 h内小鼠腹泻情况以及给药3 h内模型组和给药组小鼠的腹泻情况(包括稀便次数、总便次数、稀便级(表1),观察过程中及时更换滤纸,观察完后处死动物,解剖小鼠肝脏、肾脏、脾脏,根据结果并计算出腹泻指数和脏器系数[7]。腹泻率=腹泻的动物数/该组动物数×100%,稀便率=每只动物的稀便次数/大便的总次数(稀便以滤纸上有无污迹为标准),腹泻指数=稀便率×稀便级,脏器系数=脏器质量(g)/小鼠体质量(g)×100%。

表1 污染直径与稀便级数对照Table 1 The comparison of pollution diameter with the grade of defecation
1.2.5对大肠杆菌感染致腹泻小鼠小肠推进的影响[8-9]:KM小鼠50只,禁食24 h,不禁水,随机分为5组,模型组、空白组、左氧氟沙星组、小柴胡颗粒组、联合用药组,每组10只,自由饮水。各组灌胃体积均为0.2 mL/10 g,给药剂量见“1.4.3”项,空白组和模型组均给予0.9%生理盐水,每日1次,连续给药7 d,末次给药前需禁食不禁水12 h,各实验组于末次给药后30 min,空白组灌胃0.1 mL/10 g的炭末,其余组均腹腔注射大肠杆菌菌悬液(菌悬液0.5 mL/只,且同时灌胃炭末0.1 mL/10 g),30 min后脱颈椎处死,取出小鼠的胃及小肠分离并铺直至消化道,测量小肠总长度及炭末在小肠的推进距离,计算小肠推进率。(小肠推进率=炭末前沿至幽门距离/小肠全长×100%)。
1.3 统计方法
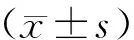
2 结果
2.1 大肠杆菌最小致死量测定
通过实验结果得出大肠杆菌的最小致死量,即感染大肠杆菌后引起小鼠100%死亡的菌液浓度为1×1010cfu/mL(3号菌),结果见表2。

表2 大肠杆菌对小鼠的最小致死量(MLD)Table 2 The median lethal dose(MLD)of E.coli to mice
2.2 联合用药对感染模型动物的影响
与模型组比较,左氧氟沙星组、小柴胡颗粒组和联合用药组均有统计学意义(P<0.05);与小柴胡颗粒组比较,联合用药组具有显著统计学意义(P<0.01);与左氧氟沙星组比较,联合用药组具有统计学意义(P<0.05)。结果见表3。

表3 联合用药对大肠杆菌感染致腹泻小鼠的保护作用Table 3 The protective function of drugcombination in E.coli mice
2.3 联合用药对大肠杆菌致腹泻小鼠的影响
小鼠注射大肠杆菌菌悬液3 h内出现腹泻症状,便次增多,便质稀软,精神萎靡,稀水样便;3 h后给予相应药物治疗,与模型组和小柴胡颗粒组比较,联合用药组腹泻指数均具有显著统计学意义(P<0.01),与左氧氟沙星组比较,联合用药组腹泻指数均具有统计学意义(P<0.05);与空白对照组比较,模型组具有显著统计学意义(P<0.01);联合用药可以减轻大肠杆菌致腹泻对小鼠脏器毒性的影响,可提高免疫脏器系数,与模型组、空白对照组、左氧氟沙星组和小柴胡颗粒组比较,联合用药胸腺脏器系数和脾脏脏器系数均有统计学意义(P<0.05),与空白对照组比较,联合用药组肝脏和肾脏脏器系数均无统计学意义(P>0.05)。结果见表4、表5。

表4 联合用药对大肠杆菌所致小鼠腹泻指数的比较Table 4 The comparison of diarrhea index of mice induced by Escherichia coli by combination of drugs
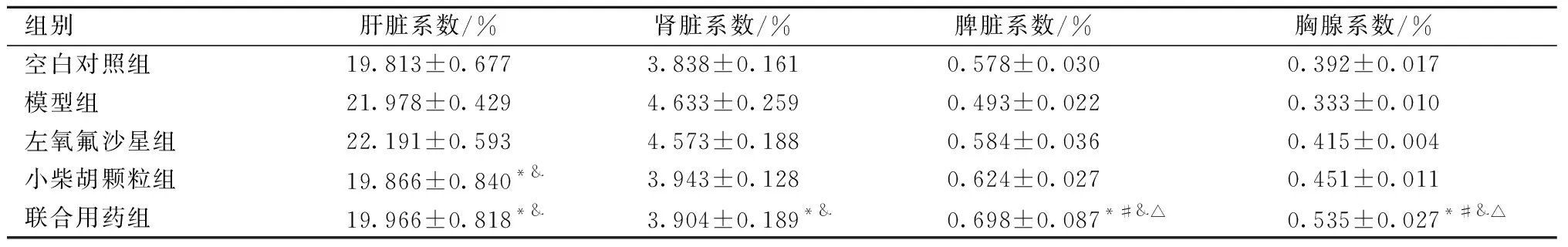
表5 联合用药对小鼠脏器系数的影响Table 5 The effect of combination medication on organ coefficient of mice
2.4 联合用药对大肠杆菌致腹泻小鼠的小肠推进率的影响
联合用药对大肠杆菌感染小鼠小肠的推进率影响结果见表6。由表6可知,与模型组比较,联合用药组小肠推进率具有显著统计学意义(P<0.01),与左氧氟沙星组和小柴胡颗粒组比较,联合用药组均具有统计学意义(P<0.05),与空白组比较具有显著统计学意义(P<0.01);与空白组比较,模型组具有极其显著的统计学意义(P<0.001),表明联合用药可以抑制大肠杆菌感染小鼠的小肠推进速度。

表6 联合用药对大肠杆菌感染小鼠小肠推进率的影响Table 6 The influence of combination medication on intestinal propulsion rate of mice infectedwith Escherichia coli
3 结论
感染性腹泻为临床常见腹泻,例如细菌、真菌等感染,细菌性感染腹泻易造成肠道粘膜受损,肠道菌群失调等功能炎症,严重的甚至会造成机体脏器代谢等功能的减弱。临床治疗腹泻一般以针对引起感染的病原体抗感染治疗为主,如采用左氧氟沙星进行抗菌治疗,但单纯的抗生素治疗容易导致细菌的耐药性,影响疗效。在中医学上腹泻类似于泄泻,是指以排便次数增多,粪质清、稀为特征的疾病[10],脾虚湿盛、脾胃阳虚是其中的一种病因。中医学认为,泄泻病变主要在脾胃,尤其与脾的运化功能失调关系密切,治疗上总以运脾化湿为基本原则[11]。小柴胡颗粒是由柴胡、半夏、人参、甘草、黄芩、生姜、大枣等成分组成,现代药理学研究柴胡入肝胆经,疏达经气,具有抗肿瘤、抗炎、解热、保肝和免疫调节等作用;法夏具有和胃降逆的功效;黄芩具有清泄邪热、抗炎、抗菌等功效;炙甘草、人参可扶助正气,抵抗病邪;大枣、生姜和胃气[12-13],方中诸药合作,达到抗菌、抗炎和提高免疫力等作用。
本研究通过挖掘小柴胡颗粒能保肝、抗炎和提高机体免疫能力的功效[14],研究联合抗菌药物左氧氟沙星对大肠杆菌感染致腹泻小鼠的抗菌和止泻作用,探索联合用药是否可以提高大肠杆菌感染致腹泻小鼠的疗效,间接减少抗生素的使用,降低细菌的耐药性产生。唐小云等[15]研究发现小柴胡颗粒可以调节免疫抑制小鼠的外周血淋巴细胞,可刺激CD28、CD80和CD86的表达而调节机体免疫功能。王军等[16]研究发现小柴胡颗粒可以提高血清IL-2、IL-6和TNF-α水平,提高机体免疫力。上述文献均表明小柴胡颗粒可以通过调节机体免疫功能,增强机体对细菌感染的耐受性,提高生存率。本研究在体内抗菌实验中,左氧氟沙星联合小柴胡颗粒可以降低大肠杆菌感染致腹泻小鼠的死亡率,与左氧氟沙星组和小柴胡颗粒组比较,均有明显的提高(P<0.05),提示小柴胡颗粒对大肠杆菌致腹泻小鼠具有很好的保护作用,其作用可能与小柴胡颗粒提高免疫力等综合作用有关,改善了大肠杆菌感染致腹泻小鼠的腹泻症状,产生了抗菌作用,提高了小鼠机体免疫力,从而加强了对细菌严重病变的抵抗性。也有文献报道小柴胡颗粒可以减轻肝纤维化小鼠血清中的ALT、AST水平,减轻肝脏病理学损伤程度[17],王丽敏等[18]研究发现小柴胡颗粒能抑制CFA大鼠血清细胞因子TNF-α、IL-1β、IL-6及MCS-F的表达,改善CFA大鼠的一般症状和炎症程度,吴山永等[19]研究发现小柴胡颗粒可以提高机体内肠道乳杆菌、双岐杆菌等菌群水平,调节胃肠道功能,保护菌群和肠道粘膜受损。在对腹泻指数和炭末推进实验中,联合用药可以降低大肠杆菌感染致腹泻小鼠的腹泻指数和炭末推进率,提高小鼠胸腺脏器系数和脾脏脏器系数,与模型组、空白组、左氧氟沙星组和小柴胡颗粒组比较,联合用药胸腺脏器系数和脾脏脏器系数均有统计学意义(P<0.05),同时结果提示联合用药可减轻肝脏和肾脏的代谢负担(与模型组比较,联合用药肝脏和肾脏脏器系数均有提高,与空白组比较均无统计学意义(P>0.05)),从而更好地发挥其生理供能,改善小鼠腹泻症状等,给予药物治疗后,小鼠腹泻症状均得到明显改善,表现为大便次数减少,便质由稀转干,精神状态渐好,饮食水状态改善,且与模型组和小柴胡颗粒组比较,联合用药腹泻指数均具有显著统计学意义(P<0.01),与左氧氟沙星组比较,联合用药腹泻指数具有统计学意义(P<0.05),与空白组比较,模型组均具有显著统计学意义(P<0.01)。结果间接提示联合用药对细菌致腹泻小鼠的胃肠粘膜损伤等具有保护作用,或运脾水湿等作用,同时结果进一步提示其产生抗菌及胃肠保护作用可能与改善修复胃肠道粘膜、调节肠道菌群水平、改善肝脏等脏器功能及提高机体免疫系统有关,从而减轻或者治疗细菌感染致腹泻的症状,具体机制有待进一步研究。
综上所述,联合用药可以多方面达到药物的联合作用效果,中西药协同作用[20],充分挖掘中药的联合作用,减少抗生素的使用,从而降低细菌的耐药性产生,本研究结果将为细菌性腹泻临床联合用药提供数据参考和实验依据。
