肿瘤负荷评分在获得根治性切除肝内胆管癌患者预后预测中的价值
2022-08-02陈青王征周俭
陈青,王征,2,周俭,2,3
(1.复旦大学附属中山医院肝肿瘤外科,上海 200032;2.复旦大学肝癌研究所,教育部癌变与侵袭原理重点实验室,上海 200032;3.复旦大学生物医学研究院,上海 200032)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是起源于肝内胆管上皮细胞的第二常见原发性肝脏恶性肿瘤,其发病率占原发性肝癌的10%~15%[1-2]。与肝细胞癌(hepatocellular carcinoma,HCC)相比,其恶性程度更高,预后更差。ICC对化疗和放疗有抵抗性,根治性切除术被认为是ICC患者获得治愈的唯一有效方法[3-4]。ICC复发率较高,术后5年总体生存率(overall survival,OS)仅为22%~24%[4-6]。因此,寻找对预后与治疗有指导意义的标志物,加强术后辅助治疗[经肝动脉化疗栓塞(TACE)、局部放疗、全身化疗、免疫治疗等],对降低ICC患者术后复发有重要意义。
Sasaki等[7]首先报道应用肿瘤形态学特点(肿瘤最大径与肿瘤数目)建立肿瘤负荷评分(tumor burden score,TBS),并确定了TBS可精准地预测结直肠癌肝转移患者预后。最近研究报道TBS对TACE、肝移植或者肝切除术等治疗的HCC患者预后具有较好预测价值[8-11]。目前,鲜见应用TBS预测ICC患者根治性切除术后临床预后的研究报道。因此,本研究拟评估TBS在获得根治性切除ICC患者预后中的预测价值,并探讨其与临床病理学特征的关系。
1 资料和方法
1.1 一般资料
2005年1月至2011年12月,在复旦大学附属中山医院肝肿瘤外科接受根治性切除治疗的7 140例原发性肝癌患者中(6 559例HCC,581例ICC),按照纳入标准,最终322例ICC患者纳入本研究。纳入标准:(1)年龄≥18周岁、≤85周岁;(2)病灶局限于肝脏,术前检查排除身体其他部位转移;(3)ICC行根治性切除,镜下病理显示切缘阴性;(4)术后病理诊断证实为ICC;(5)术前未接受其他抗肿瘤治疗;(6)临床资料及预后信息完整。排除标准:(1)合并其他恶性肿瘤;(2)非根治性手术。患者术前签署病例数据用于科学研究的知情同意书。
1.2 手术治疗
所有ICC患者均行根治性切除并经病理证实切缘阴性(R0切除),肝切除术式根据肿瘤位置、大小、与肝脏及周围重要血管的关系、区域淋巴结是否肿大、有无肝硬化及残余肝体积等指标选择,包括肝叶切除、肝段切除、肝局部切除、半肝切除和扩大半肝切除[12]。术前检测或术中发现区域淋巴结肿大者,均行区域淋巴结清扫。
1.3 随访
ICC患者术后随访参考本研究团队前期研究报道[13],患者术后第1 个月开始随访,2 年内每3 个月随访一次,2 年后每6 个月随访一次。随访内容包括:体格检查、血常规、肝肾功能、血清肿瘤标志物(AFP与CA199)、腹部超声以及腹部增强CT或MRI等检查。若有复发迹象,复查PET-CT监测肿瘤肝外远处转移。肿瘤复发患者根据肿瘤大小、数目以及位置行再次肝脏肿瘤切除、TACE、射频消融或对症支持治疗等。随访截止时间为2014年4月。
1.4 中性粒细胞/淋巴细胞比值和淋巴细胞/单核细胞比值截断值的设定
参考前期研究报道[14-15],设定中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)和淋巴细胞/单核细胞比值(lymphocyte-to-monocyte ratio,LMR)的截断值,NLR=2.49,LMR=4.45。
1.5 TBS的定义
根据Sasaki等[7]提出的肿瘤负荷评分TBS模型,对于每例ICC患者,从病理报告中获得肿瘤最大径和肿瘤数目。TBS定义为距离笛卡尔平面原点的距离,并包含两个变量:肿瘤最大径(X轴)和肿瘤数目(Y轴)。因此,TBS2=(肿瘤最大径)2+(肿瘤数目)2[7,11]。
1.6 统计学分析
应用SPSS 19.0统计软件。采用受试者工作特征曲线(receiver operation curve,ROC)评估TBS、系统炎症指数(NLR≥2.49、LMR≥4.45)和血清肿瘤标志物(CA199>37 U/mL)对ICC患者术后OS的预测效能。X-tile软件计算TBS的最佳截断值[16]。采用Kaplan-Meier方法计算ICC患者术后无复发生存率(recurrence-free survival,RFS)和总体生存率(OS),组间比较行Log-rank检验。多因素Cox回归分析筛选影响ICC患者术后预后的独立因素。P<0.05表示差异有统计学意义。
2 结果
2.1 基线特征
本研究共招募322 例ICC患者,其中男194 例,女128例。随访时间2.7~100.5个月(中位随访时间44.0个月)。随访过程中191例复发,187例死亡;123例合并乙型病毒肝炎感染,86例合并肝硬化;244例单发肿瘤,78例多发肿瘤;肿瘤最大径≤5 cm者145例,>5 cm者177例。根据TBS分布情况,将322例ICC患者分为低、中、高三个预后风险组:1.41 <TBS≤4.61(n=104)、4.92≤TBS≤10.30(n=176)、10.40≤TBS<22.85(n=42),见图1。
2.2 TBS与ICC临床病理学特征的关系
结果显示,TBS与血清CA199 >37 U/mL显著正相关(P=0.004);TBS与系统炎症指数NLR≥2.49显著正相关(P=0.001),而与LMR≥4.45 显著负相关(P<0.001)。TBS基于肿瘤最大径与肿瘤数目构建,结果显示,TBS与肿瘤最大径(P<0.001)及肿瘤数目(P=0.001)显著正相关。此外,TBS与淋巴结转移显著相关(P<0.001),TBS升高的ICC患者倾向于淋巴结转移。进一步分析发现,TBS较高的患者(30/42,71.4%)TNM分期大部分处于Ⅲ+Ⅳ期,而TBS较低的患者处于Ⅲ+Ⅳ期,只占6.7%(7/104),差异有统计学意义(P<0.001)。具体见表1。
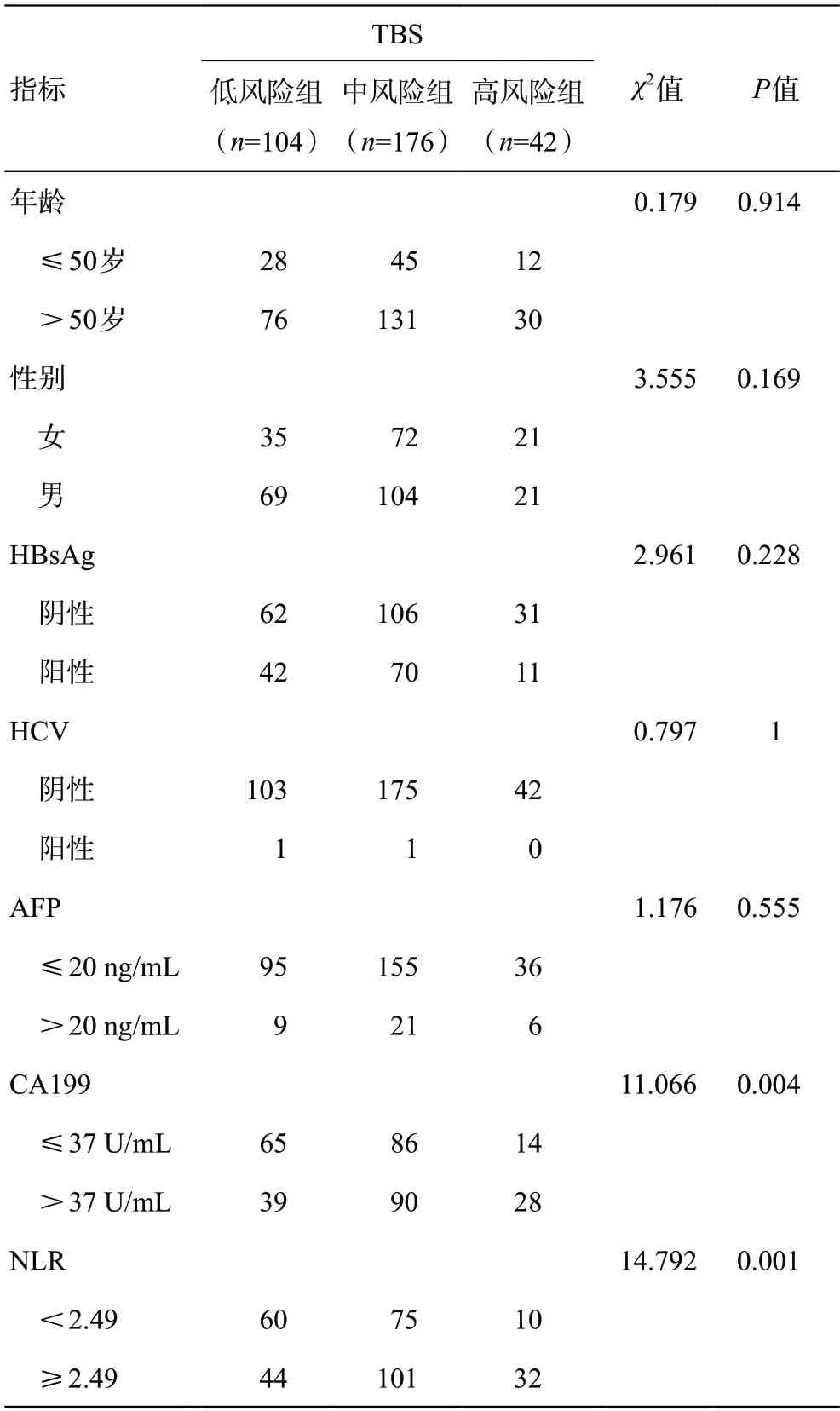
表1 TBS与ICC患者临床病理学特征的关系(例)

续表1
2.3 TBS预测ICC患者OS的效能
研究采用时间依赖的ROC曲线评价TBS、系统炎症指数(NLR≥2.49、LMR≥4.45)、血清肿瘤标志物(CA199>37 U/mL)预测ICC患者术后OS的准确性。结果显示,TBS预测ICC患者术后OS的AUC为0.632(P<0.001),高于NLR≥2.49(AUC=0.603,P=0.002)、LMR≥4.45(AUC=0.596,P=0.003)、血清CA199>37 U/mL(AUC=0.564,P=0.051),见图2。

图2 TBS及其他临床参数(NLR、LMR与CA199)预测ICC患者总体生存率的效能
2.4 TBS与ICC患者RFS及OS的关系
Kaplan-Meier生存分析显示,TBS低风险组ICC患者的1、3 和5 年RFS为71.4%、52.1%和40.2%,显著高于TBS 中风险组(分别为54.4%、36.6%和32.0%,P=0.0262)以及TBS高风险组(分别为26.3%、13.2%和13.2%,P<0.0001),见图3A。TBS低风险组ICC患者的1、3和5年OS为87.5%、63.8%和50.6%,也显著高于TBS中风险组(分别为73.8%、42.1%和31.0%,P<0.0001)及TBS高风险组(分别为48.9%、31.1%和13.8%,P<0.0001),见图3B。
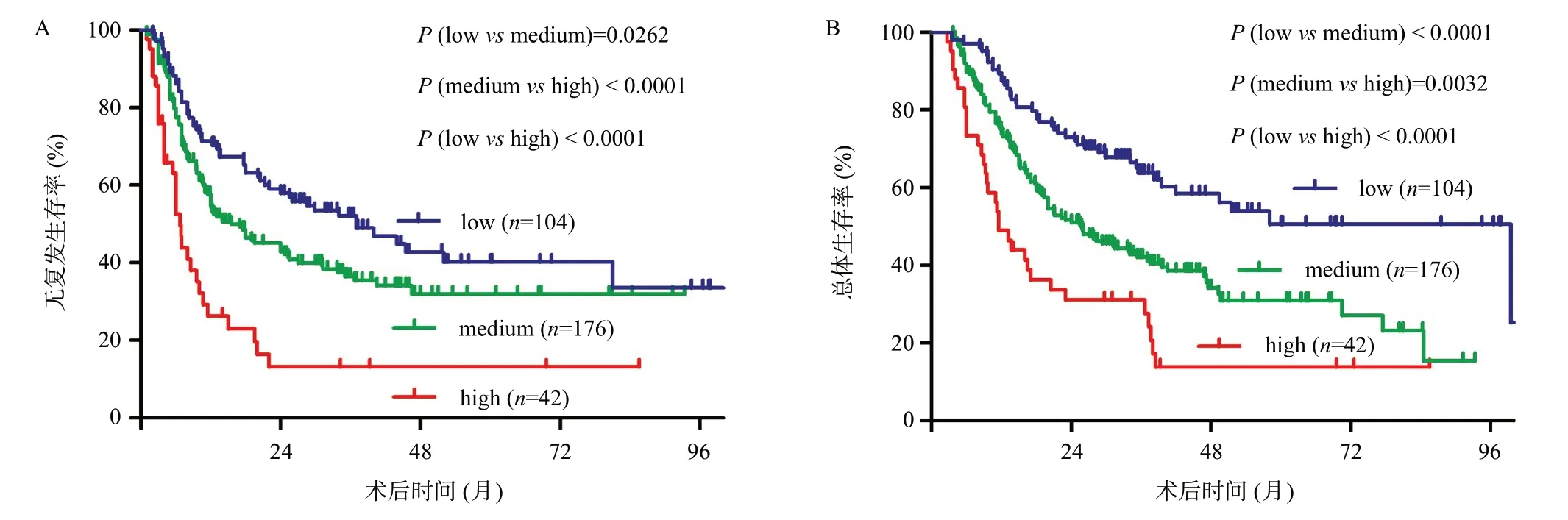
图3 不同TBS风险组患者的RFS(A)和OS(B)生存曲线
2.5 影响ICC患者预后的单因素分析
将TBS与其他临床病理学特征纳入Cox单因素分析,结果显示,ICC患者的性别、年龄、血清AFP、Child-Pugh分级、HBV、HCV以及肝硬化状态与患者的RFS和OS均无显著相关;肿瘤最大径(P=0.042)、肿瘤数目(P<0.001)、淋巴结转移(P<0.001)、微血管浸润(P=0.022)、TNM分期(P<0.001)、NLR≥2.49(P=0.016)、LMR≥4.45(P=0.048)以及TBS(P<0.001)与患者RFS显著相关;肿瘤最大径(P=0.008)、肿瘤数目(P=0.002)、淋巴结转移(P<0.001)、TNM分期(P<0.001)、NLR≥2.49(P<0.001)、LMR≥4.45(P=0.002)、血清CA199>37 U/mL(P=0.001)以及TBS(P<0.001)与患者OS呈显著相关,见表2。

表2 影响ICC患者预后的单因素分析
2.6 影响ICC患者预后的多因素分析
Cox多因素分析显示,肿瘤数目(HR1.757,95%CI1.271~2.429,P=0.001)、淋巴结转移(HR1.954,95%CI1.355~2.817,P<0.001)以及TBS(HR2.482,95%CI1.560~3.947,P<0.001)是影响ICC患者术后RFS的独立因素;肿瘤数目(HR1.570,95%CI1.127~2.186,P=0.008)、淋巴结转移(HR2.262,95%CI1.590~3.219,P<0.001)、LMR≥4.45(HR0.653,95%CI0.470~0.908,P=0.011)、血清CA199>37 U/mL(HR1.407,95%CI1.054~1.878,P=0.021)以及TBS(HR4.759,95%CI2.553~8.870,P<0.001)是影响ICC患者术后OS的独立因素,见表3。

表3 影响ICC患者预后的多因素分析
3 讨论
据报道,ICC发病率在全球范围内呈上升趋势[2,17]。由于ICC起病隐匿和恶性程度高,大部分ICC患者在确诊时就已失去手术治疗机会[18]。根治性切除术目前仍是ICC最有效的治疗手段,但患者术后5 年OS不尽人意,肿瘤复发率高达60%~70%[13,19]。因此,筛选根治性切除术后有高危复发风险的ICC患者,然后制定精准的治疗策略至关重要。最近研究报道,TBS能够预测肝癌患者接受肝移植或者部分肝切除术后的临床预后[9,11]。本研究发现,TBS与反映ICC患者不良预后的重要临床病理学特征包括血清CA199、系统性炎症指标(NLR、LMR)以及肿瘤侵袭生物学特性(肿瘤数目、肿瘤最大径、淋巴结转移、TNM分期)均具有显著相关性,提示TBS在预测ICC患者根治性切除术后的临床预后中具有重要价值。
肝十二指肠韧带淋巴结转移是ICC患者的重要病理学特征,ICC患者伴发淋巴结转移往往临床预后不佳。本研究发现淋巴结转移也是影响ICC患者RFS和OS的独立预后因素,与前期研究报道一致[6,20]。肿瘤数目和肿瘤最大径是评价ICC患者预后的两个重要肿瘤形态学特征[21],本研究提示,肿瘤数目是影响ICC患者术后RFS和OS的独立预后因素。TBS基于肿瘤最大径和肿瘤数目建立,因此TBS可能在预测ICC患者预后上具有更重要的价值。本研究根据TBS的分布情况,将322例ICC患者分成3个预后风险组,生存分析发现,TBS升高的ICC患者RFS和OS均显著性降低。TBS越高,ICC患者的临床预后越差。Cox多因素回归分析显示,TBS是影响ICC患者根治术后RFS和OS的重要独立预后因素,与最近的研究报道一致[22]。高风险TBS组和低分险TBS组比较,前者ICC患者的死亡风险比是后者的4.759倍。上述研究结果进一步证实了TBS在预测ICC患者根治性切除术后临床预后中的重要价值。因此,TBS高的ICC患者术后应积极进行辅助治疗(如TACE、局部放疗、全身化疗和免疫治疗等)以延缓肿瘤复发。
血清CA199 是ICC诊断和预后预测中重要的生物标志物。我们前期的研究指出,系统炎症指数(NLR与LMR)及血清CA199 可有效预测ICC患者的临床预后[13-15],本研究发现,血清CA199和LMR是影响ICC患者OS的独立预后因素。本研究通过时间依赖的ROC曲线评估TBS与其他临床参数(包括NLR、LMR和血清CA199)对ICC患者OS的预后效能,发现TBS预测ICC患者术后OS的AUC均高于NLR、LMR和血清CA199,这提示TBS对ICC患者术后预后具有较高的预测效能。
综上所述,TBS是影响ICC患者根治性切除术后RFS和OS的独立预后因素,对ICC患者预后具有良好的预测价值。但本研究为单中心、回顾性研究,仅纳入了根治性切除术后的ICC患者,相关结论仍需大样本、多中心研究进一步验证。
