采用水合氧化铁吸附钨酸钠溶液中的钒及其吸附特性
2022-08-01肖露萍陈星宇刘旭恒赵中伟
肖露萍,陈星宇,刘旭恒,赵中伟
(中南大学冶金与环境学院,湖南长沙,410083)
近年来,随着高品位优质钨矿原料的减少,一些钒含量高的复杂低品位钨矿资源以及一些二次含钨资源正逐渐被利用[1]。钒是一种化学性质与钨相近的元素,钨钒难以彻底分离。目前,国内外关于从钨酸盐中分离钒的报道比较少,主要方法有离子交换法[2-4]、活性炭纤维吸附法[5-6]和溶剂萃取法[7-9]等。离子交换法是通过树脂选择性吸钒,而钨保留在溶液中,达到分离的目的;活性炭吸附法是将活性炭改性后,利用其对钒的吸附达到去除钒的效果;溶剂萃取法同样是利用萃取剂对钒的选择性,从而将钒分离。这些方法大多是在较低pH条件下,利用钨和钒的存在形态不同或者对钨酸盐溶液进行预处理,达到分离钒的目的。但目前钨冶炼流程是基于碱法工艺,一般钨浸出液的碱含量较高,为达到分离条件,必须耗用大量的酸或大量钨酸盐溶液进行预处理,这势必会增加工艺运行的成本。
张正斌等[10]研究了海洋中各元素的迁移规律,研究发现钨、钼、锆、铼、钪和钒等组分在海水中含量较低,但在海床沉积物以及海洋植物和动物中含量更高,尤其是在氢氧化物型沉积物中。该研究表明,海洋中的氢氧化物对痕量元素具有较强的吸附作用。一些学者也认为,该富集过程主要是海水中形成的氢氧化物胶体吸附金属离子后沉积至海床中所致。金属离子从水溶液中吸附到某一固体氧化物表面上的程度取决于许多因素,一方面与吸附剂的本身性质有关,另一方面也与被吸附离子在溶液中的存在形态有关。作为一种新型的吸附剂,水合氧化铁有关酸碱特性及吸附理论对从钨酸钠溶液除钒具有重要的理论和应用价值。
表面配位理论自20世纪70年代初被提出,现在已逐步发展成比较完整的体系,其中,最具代表性的有恒电容模式、双层模式和三层模式等。对于有限范围的酸碱滴定或者离子吸附数据,大多数模式均能够对吸附过程进行较好地描述。无静电模式是最简单的表面配位模式。在该模式中,假定吸附自由能中的化学作用远大于静电作用,因而可以忽略固液界面双电层以及表面电荷的静电作用。随着表面配位理论的发展,逐渐形成了一种新的模型即表面配位模型[11-15],此模型无需考虑表面静电作用的影响,可归于无静电模型中的一种。文献[16]中,此模型被运用于粉煤灰吸附砷的研究,文献[17]运用表面配位模型模拟了砷、硒和钒在活性氧化铝颗粒上的吸附,文献[18]也将该模型运用到钨酸盐溶液中对锡进行吸附。该模型的最大特点是模式中的参数相对较少,可以避免计算过程中个别参数由研究者凭经验选定的情况。
基于此,为了开发新的从钨酸盐中除钒的方法,本文作者以水合氧化铁作为吸附剂,研究其吸附钒的理论与性能,探索钨、钒的深度分离,并运用模型量化在不同pH、表面负荷以及离子强度条件下研究水合氧化铁吸附钒的特性。
1 实验
1.1 水合氧化铁的制备
实验所用试剂均为分析纯。吸附剂水合氧化铁是用FeCl3与足量的NaOH反应生成水合氧化铁,过滤,用去离子水洗净后,于100 ℃下烘24 h磨细制备得到。
1.2 吸附除钒
钒的吸附实验是将水合氧化铁加入含钒的溶液中,于25 ℃震荡24 h 后过滤,考察水合氧化铁对钒的吸附情况;钒和钨的吸附实验是将水合氧化铁加入至含钒和钨的溶液中,于25 ℃震荡24 h后过滤,考察水合氧化铁对钒、钨的吸附情况。除在考察离子强度对钒吸附量影响实验中NaNO3溶液浓度分别为0.01 mol/L 和0.10 mol/L 外,其他实验中NaNO3溶液浓度均为0.01 mol/L。钨酸钠溶液中钒的吸附实验包括直接加入水合氧化铁作为吸附剂和在溶液中直接生成水合氧化铁作为吸附剂2 种方式。将水合氧化铁或者FeCl3按照铁与钨物质的量比为40 添加,加到钨与钒质量比为1 000∶1的含钒钨酸钠溶液中,第1种方式在震荡条件下反应24 h后过滤,第2种方式在磁力搅拌条件下反应1 h后过滤。用电感耦合等离子体发射光谱仪(IRIS Intrepid ⅡXSP,美国热电)测量溶液及滤液中钒、钨含量,用以计算吸附量、吸附率或损失率。
单位质量吸附剂吸附钒的量qV计算公式如下:

除钒率或钒吸附率μV计算公式为

钨损率或钨吸附率μW的计算公式为

其中:ρ为仪器检测的钒或钨的质量浓度;V为溶液体积;n为稀释倍数;m为吸附剂的质量;下标1为反应前的溶液;下标2为反应后的溶液。
1.3 水合氧化铁表面性质测定
水合氧化铁的滴定实验是由HUANG[19]提出的,是测定吸附剂表面位密度和酸度常数的方法。本研究中,将一定量的水合氧化铁加入NaNO3溶液中,在pH为3~12时对水合氧化铁进行滴定,得到净滴定曲线后,获取其表面位密度和酸度常数。
电泳淌度用于表征不同pH 条件下水合氧化铁颗粒的表面带电性能。同样在NaNO3溶液中,用Zeta 电位分析仪(Zetasizer Nano ZS,英国马尔文)测定不同pH下水合氧化铁颗粒的Zeta电位。
2 结果与讨论
2.1 水合氧化铁吸附钒
水合氧化铁吸附钒是实现钨、钒分离的基础,其吸附特性将直接影响吸附效果。pH 是研究吸附的极为重要的因素。在不同pH 条件下,离子状态、吸附剂的表面带电性能不同,吸附效果也不同。考察pH变化对水合氧化铁吸附钒的影响,结果如图1所示。从图1可以看出:当体系的pH 在2~10之间时,水合氧化铁对钒的吸附出现最大值。随着pH继续增加,水合氧化铁的吸附能力急剧下降。但当体系pH高于12时,水合氧化铁仍然具有一定的吸附能力。造成这种差异的原因,一方面,是钒在溶液中的聚合状态与pH以及其浓度密切相关[20]。当钒的浓度一定,pH 较低时,钒在溶液中的状态更多为聚合状态,在pH较高时更多为单体状态,因而在pH较低时,水合氧化铁对钒的吸附较强,而在pH较高时,水合氧化铁的吸附能力下降。另一方面,可能与水合氧化铁的吸附特性有关。在不同pH下,水合氧化铁因为表面带电性能不同,而对钒的吸附呈现不同的吸附特性。
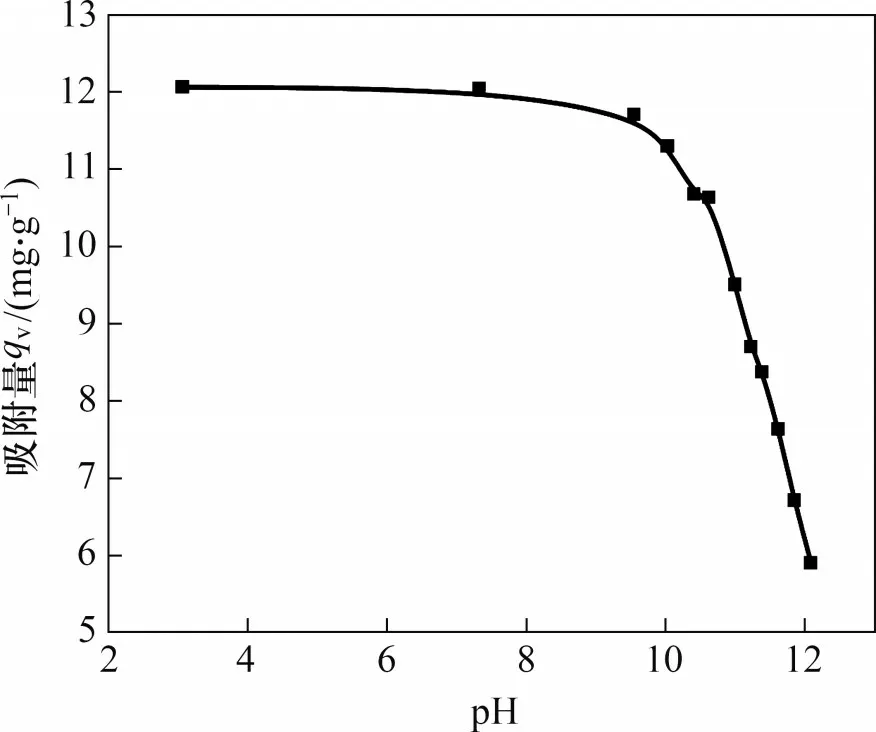
图1 pH对钒吸附的影响Fig.1 Effect of pH on V adsorption
2.2 水合氧化铁吸附钨和钒
图2所示为不同质量浓度下钨和钒在水合氧化铁上的吸附曲线。从图2可以看出:钒在水合氧化铁上最大的吸附平台出现的pH范围为2~10,钨的最大吸附平台对应的pH范围在钨初始质量浓度较低时较宽,而钨初始质量浓度较高时较窄。当钨的初始质量浓度为50,98,213和466 mg/L时,其对应的最大pH 吸附范围分别为2.0~8.2,2.0~7.8,2.0~7.0 和1.7~2.0。总体而言,当钒的质量浓度保持不变时,随着钨初始质量浓度增加,钨的吸附平台变窄,整个曲线向着pH降低的方向平移。同时也可看出,水合氧化铁有一定的分离钨、钒的能力,特别是对于钨高钒低的体系,当钨与钒质量浓度的比值越大时,二者高效分离的pH范围越宽,这为钒和钨的分离尤其是为钨酸盐中分离痕量钒提供了可能。

图2 不同初始质量浓度下钨和钒在水合氧化铁上的吸附Fig.2 W and V adsorption onto hydrous ferric oxide with different initial mass concentrations
2.3 钨酸钠溶液中水合氧化铁吸附钒
在实际的钨矿浸出过程中,钨酸盐中钨的质量为钒的数百倍甚至上千倍。因此,为了进一步探索水合氧化铁在实际生产过程中的除钒效果,本研究在钨与钒质量比为1 000∶1 的含钒钨酸钠溶液中进行除钒实验,经过检测分析得到除钒率和钨损率分别为86.32%和3.21%,计算得到此时钨与钒的分离系数为190。可见,利用水合氧化铁有较好的分离钨和钒的效果。为了进一步分离钨和钒,降低钨损率和提高除钒率,根据文献[21-22],新生态水合氧化铁具有很好的吸附微量元素的性能。鉴于此,直接在钨酸钠中生成水合氧化铁作为吸附剂,水合氧化铁的量分别为钒物质的量的40 倍和50 倍,进行除钒实验,结果如图3所示。从图3可知:当水合氧化铁的量为钒物质的量50倍时,除钒更彻底、而钨损率也更高。综合考虑除钒率和钨损率2个因素,当水合氧化铁的量为钒物质的量40倍时,在pH 为9.8~10.8的范围内,除钒率高于99%,而钨损率维持在1.85%~4.42%,此时,分离效果最佳。与水合氧化铁相比,采用新生态水合氧化铁时的钨损率更低、除钒率更高,因而分离系数更大,分离效果更显著。同时也说明,新生态水合氧化铁的除钒效果比水合氧化铁的除钒效果更优异,铁离子的形态对钒吸附有直接影响。将此实验参数用于扩大实验,在控制结晶率为96%和100%这2 种条件下得到仲钨酸铵,其铁质量分数分别为6×10-6和9×10-6,完全满足0级仲钨酸铵中铁质量分数不超过10×10-6的标准。由此可见,水合氧化铁具有优异的分离钨和钒的性能,为钨酸钠溶液中分离痕量钒提供了新途径。

图3 钨酸钠溶液中水合氧化铁分离钨和钒的效果Fig.3 Separation effect of W and V by hydrous ferric oxide in sodium tungstate solution
2.4 水合氧化铁吸附钒的特性研究
2.4.1 离子强度对钒吸附量的影响
为了进一步研究水合氧化铁吸附钒的特性,本文通过模型量化钒在水合氧化铁上的吸附行为。建立水合氧化铁的吸附模型,确定离子强度是否对吸附产生影响。考察离子强度对钒吸附的影响,实验结果见图4。从图4可知:在0.10 mol/L 和0.01 mol/L的NaNO3溶液条件下,钒在水合氧化铁上的吸附曲线几乎是重合的。也就是说,钒的吸附几乎不受离子强度的影响。研究人员研究以活性氧化铝或者其他吸附剂时,也得出了类似的结论[17]。这说明,钒在水合氧化铁上的吸附形成了内层络合物[23],同时可以考虑无静电吸附模型建模模拟钒在水合氧化铁上的吸附。

图4 离子强度对钒吸附的影响Fig.4 Effect of ionic strength on V adsorption
2.4.2 钒在水合氧化铁上的吸附建模
1)水合氧化铁的表面酸度。假设水合氧化铁的表面酸位是由一系列不同的一元酸组成[17]。式(4)用于拟合水合氧化铁的净滴定曲线,以求得水合氧化铁的酸位浓度及相应的酸度常数。

式中:ΔV为表面酸位消耗的酸或碱(酸为负值)净体积,mL;V0为含水合氧化铁溶液的总体积,mL;Si为酸位浓度,Si=Гi×ρF,mol/L;Гi为表面位密度,mol/g;i=1,2,3;ρF为水合氧化铁的质量浓度,g/L;Ki为酸度常数;C为用于调节pH的酸或碱的浓度,mol/L;[H+]为溶液中H+浓度,mol/L;[H+]0为未加酸或碱的对比溶液中H+浓度,mol/L。
从式(4)可以看出:完成水合氧化铁的滴定后,ΔV,V0,ρF,[H+]0和[H+]为已知,Гi和Ki为未知,通过非线性拟合,运用式(4)可以求得表面位密度Гi和酸度常数Ki。
图5所示为水含氧化铁的滴定结果与拟合结果。为了获得水合氧化铁的表面酸位密度及常数,假设水合氧化铁存在1,2,3,4,5或6种不同酸位,经过拟合发现,在假设只有3 种酸位的情况下,实验结果与拟合结果能很好地吻合(线性相关系数R2>0.99)。因此,将水合氧化铁的3 种不同的酸位记作A1,A2和A3,这3 种酸位的密度(Г)和酸度常数(K)的拟合结果见表1。

图5 水合氧化铁的滴定结果与拟合曲线Fig.5 Titration and curve-fitting results for hydrous ferric oxide

表1 水合氧化铁的拟合参数Table 1 Fitting parameters of hydrous ferric oxide
2)水合氧化铁的吸附酸位。图6所示为水合氧化铁Zeta 电位与pH 的关系图。从图6可以看出:当水合氧化铁的Zeta电位为0 mV时,其对应的pH为7.82。表1中A1和A2对应酸度常数的pK1和pK2分别为3.50 和7.57,均低于7.82;而A3对应酸度常数的pK3为11.02,高于7.82。由此可以推断,酸位A1和A2的质子化形态带正电,而酸位A3的脱质子化形态带负电。

图6 水合氧化铁Zeta电位与pH的关系图Fig.6 Zeta potential-pH relationship of hydrous ferric oxide
结合图1中pH对钒吸附量的影响也可以推断,当pH 高于8.0 时,水合氧化铁对钒的吸附量逐渐下降,这说明酸位A1和A2的质子化形态有可能吸附钒阴离子,而酸位A3几乎未对吸附产生影响。
3)运用表面配位模型模拟。离子强度对钒在水合氧化铁上的吸附没有影响(图4),这说明钒是吸附在水合氧化铁的表面,并且表面静电效应对吸附不产生影响。对于活性氧化铝颗粒上吸附砷,硒和钒的模式,文献[17]确定了2 种酸位,并将其中1 种酸位又分成了强酸位与弱酸位,文献[18]也将该模型运用于钨酸盐溶液中锡的吸附。本研究利用表面配位模型建模描述钒在水合氧化铁上的吸附行为。
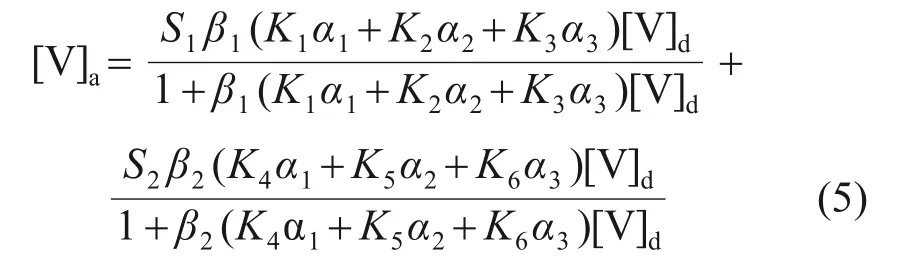
式中:[V]a为水合氧化铁吸附的钒的浓度;[V]d为溶液中游离的钒的浓度;S1和S2分别为A1和A2的酸位浓度;β1和β2分别为A1和A2的质子化分数,β=[H+]/([H+]+KH);K1,K2和K3分别为在表面酸位A1上H2VO-4,HVO2-4和VO3-4的吸附常数;K4,K5和K6分别为在表面酸位A2上H2VO-4,HVO2-4和VO34-的吸附常数;α1,α2和α3分别为H2VO-4,HVO24-和VO34-的所占总V 的浓度占比,由以下公式[17]计算得到:

从式(5)可知:钒的吸附有6个吸附常数。这些常数可通过钒在不同pH 下的吸附数据,运用Origin 非线性拟合来确定。然而,在拟合中发现,当采用2种酸位拟合时,无论参数如何变化,拟合得到的结果与图5中的实验结果都不能很好地吻合。通过计算酸位A3的质子化分数发现,酸位A3的质子化分数几乎都远大于同一pH下酸位A1和A2的质子化分数。也就是说,酸位A3在一定程度上也对吸附产生了影响,其原因可能是,溶液中钒阴离子在水合氧化铁上的特殊吸附导致水合氧化铁Zeta 电位为0 mV 时的pH 向更大的方向移动[16],使得酸位A3成为可能吸附钒的酸位。因此,将只有2种吸附酸位的吸附方程式(5)调整为包含3种吸附酸位的吸附方程式:

式中:S3为酸位A3浓度;K7,K8和K9分别为表面酸位A3上H2VO-4,HVO2-4和VO3-4的吸附常数。
图7所示为水合氧化铁对钒的吸附曲线。从图7可知:经过拟合得到的结果,其与实验结果吻合很好(R2>0.95)。同时,在拟合过程中发现,酸位A1和A2的酸度常数较大,而酸位A3的酸度常数较小,也就是说,酸位A1和A2上吸附钒的能力要远大于酸位A3上吸附钒的能力,这更好地解释图1中当体系处于高pH(>12)时,水合氧化铁仍然具有一定的吸附钒的能力。
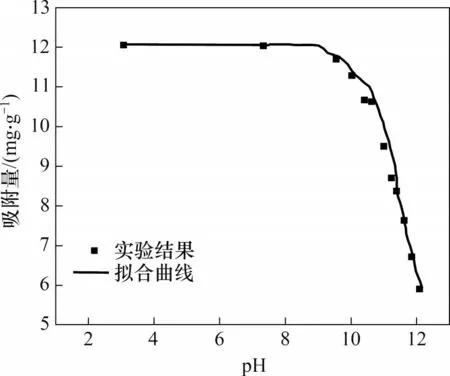
图7 水合氧化铁对钒的吸附Fig.7 V adsorption onto hydrous ferric oxide
3 结论
1)钒在水合氧化铁上最大的吸附平台出现的pH 范围为2~10,钨的最大吸附平台对应的pH 范围在钨初始质量浓度低时较宽,而钨初始质量浓度高时较窄,这为钨和钒的分离尤其是为钨酸盐中高效分离痕量钒提供了可能。
2)在溶液中钨与钒的质量比为1 000的钨酸钠溶液中,采用直接在钨酸钠中生成水合氧化铁作为吸附剂效果更好。当水合氧化铁的量为钒物质的量的40倍、pH为9.8~10.8、反应1 h的条件下除钒,除钒率高于99%,而钨损率维持在1.85%~4.42%。当增加水合氧化铁的量为钒物质的量的50倍时,除钒更彻底、而钨损失也更多。在水合氧化铁的量为钒物质的量的40 倍时进行放大实验,得到结晶率为96%和100%的仲钨酸铵中铁质量分数分别为6×10-6和9×10-6,完全满足0 级仲钨酸铵中铁质量分数不超过10×10-6的标准,为钨酸钠溶液中分离痕量钒提供了新途径。
3)钒在水合氧化铁上的最大吸附pH 范围为2~10,离子强度对吸附过程几乎没有影响。表面配位模型能很好地模拟水合氧化铁吸附钒的行为。确定了水合氧化铁上的3种酸位,其酸位常数分别为3.50,7.54和11.02。
