团头鲂cdc20基因的序列特征和表达分析
2022-08-01庞连慧罗双双石林林陈天圣刘红王焕岭
庞连慧,罗双双,石林林,陈天圣,刘红,王焕岭
1.华中农业大学水产学院/农业农村部淡水生物繁育重点实验室,武汉 430070;2.集美大学水产学院/农业农村部东海海水健康养殖重点实验室,厦门 361021
鱼类性腺成熟是生殖细胞不断增殖、分化成成熟配子的过程,而配子的成熟需要经过2次减数分裂,其中涉及了同源染色体的配对、联会、重组和分离等,其中任何环节的异常都会导致减数分裂过程无法正常进行,进而导致配子发育的异常[1],因此,这个过程需要精确而复杂的分子调控。细胞分裂周期蛋白20(cell division cycle 20 homolog,CDC20)是细胞周期、有丝分裂和减数分裂的重要调节因子[2]。据报道,不同物种CDC20蛋白的结构域十分保守,一般含有7个WD40基序形成稳定的7叶螺旋桨状结构,作为支架介导泛素结合酶与底物之间相互结合[3]。在卵母细胞减数分裂中,CDC20蛋白是同源染色体分离的关键因子,通过影响减数分裂的重要调控蛋白——后期促进复合物(anaphase promoting complex/cyclosome,APC/C)的活性促进Ⅱ期姐妹染色体分离。研究发现CDC20蛋白表达量降低会导致小鼠受精卵几乎不能正常发育[4],而其蛋白失活会引起胚胎死亡[5]。在人类中,CDC20基因的突变导致女性不育[6]和男性的生殖能力降低[7]。这些研究表明CDC20在动物生殖、胚胎发育中发挥重要作用。目前,CDC20的功能研究在鱼类中尚未涉及。因此,为了解鱼类cdc20基因的功能,本研究以团头鲂为试验对象,对其cdc20基因的序列特征、系统进化和时空表达模式进行初步研究,旨在为后续的基因功能研究奠定基础。
1 材料与方法
1.1 团头鲂总RNA的提取与cDNA合成
使用TRIzol(康为世纪生物科技股份有限公司)提取团头鲂成鱼不同组织的总RNA,包括脑、眼睛、鳃、心脏、肝脏、脾脏、肠、肾脏、卵巢、精巢和肌肉。采集不同发育时期(受精卵、2-细胞期、16-细胞期、囊胚期、原肠期、神经期、体节期、心跳期和孵化期)的胚胎并提取总RNA。将提取的总RNA用Prime-Script®RT reagent Kit With gDNA Eraser(TaKa-Ra)试剂盒进行反转录合成第一链cDNA。
1.2 团头鲂cdc20基因的克隆和进化分析
将斑马鱼的cdc20cDNA序列(Accession:NM_213080)与笔者所在实验室的团头鲂转录组数据进行比对,获得团头鲂cdc20基因的编码区序列。并根据此序列使用Oligo 7和Beacon Designer 7软件设计PCR引物以扩增团头鲂cdc20基因的编码区序列。根据预测的氨基酸序列利用ClutsalX软件进行多序列比对以及使用SWISS在线网站(https://swissmodel.expasy.org/)预测蛋白结构域;基于MEGA 6.0软件的Neighbor-joining方法构建进化树。
1.3 sqRT-PCR
采用sqRT-PCR方法检测cdc20基因在团头鲂成鱼各组织中的表达模式,以β-actin作为内参基因,引物序列见表1。PCR条件如下:95℃5 min;95℃30 s,58 ℃ 30 s,72 ℃ 10 s,30个循环;72 ℃ 5 min。PCR扩增结束后,取10 μL PCR产物,使用1%的琼脂糖凝胶,140 V电压下电泳15 min,检测该基因在各组织中的表达量。

表1 本研究所用引物Table 1 All primers used in this study
1.4 qRT-PCR
使用SYBR®Green qPCR Mix试剂盒,在CFX96 Real-Time PCR Dectection System中进行qRT-PCR。每个样品3次重复,以β-actin作为内参基因。以团头鲂不同发育时期胚胎的cDNA为模板,参照下列反应体系进行PCR扩增:模板cDNA 1 μL,正向引物和反向引物各0.4 μL;SYBR®Green qPCR Mix 10 μL,ddH2O 8.2 μL。反应条件为:95 ℃5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 10 s,39个循环;72℃5 min。结果通过2-ΔΔCt法计算cdc20的相对表达量,数值用“平均值±标准差”(n=3)表示,用GraphPad Prism 8软件作图。采用单因素方差分析方法(ANOVA)和Duncan’s检测mRNA表达水平的差异,当P<0.05时,认为差异显著。
1.5 性腺组织切片H.E染色及观察
团头鲂的性腺组织用4%PFA(DEPC水处理)固定后送武汉赛维尔公司做切片,依次将切片进行如下操作:二甲苯洗2次,每次20 min;无水乙醇洗2次,每次10 min;95%乙醇5 min;90%乙醇5 min;80%乙醇5 min;70%乙醇5 min;蒸馏水冲洗后,苏木素染色3~8 min,自来水洗;1%的盐酸乙醇分化数秒,自来水冲洗;0.6%氨水返蓝,流水冲洗;伊红染液中染色1~3 min;将切片放入95%乙醇洗2次,每次5 min;无水乙醇洗2次,每次5 min;二甲苯洗2次,每次5 min,切片拿出来稍晾干,中性树胶封片。以上操作完成后于显微镜(Leica,DFC550)下观察。
1.6 切片原位杂交
以团头鲂cdc20cDNA序列作为模板,设计探针引物(表1),在反向引物的5′端加上T7启动子序列,并参照下列反应体系进行体外转录:DNA模板1 μg,10×transcription buffer 2 μL,T7/SP6 RNA 聚合酶2 μL,DIG-NTP Mix 2 μL,RNase Inhibitor 1 μL,RNase-free水加至20 μL;体系混匀后,37℃水浴4 h后完成体外转录,合成的探针大小为342 bp。利用石蜡切片进行原位杂交,具体如下:二甲苯洗5次,每次5 min;二甲苯∶无水乙醇(体积比)=1∶1洗2次,每次3 min;无水乙醇洗2次,每次3 min;依次用95%、90%、85%、75%、50%乙醇各洗1次,每次3 min;85℃DEPC水洗3 min;滴加65℃预热的预杂交液,预杂交1~2 h;然后将5 ng/μL探针滴加到组织块上,放入湿盒,65℃杂交过夜;用2×SSCT 65℃清洗切片2次,每次30 min;0.2×SSCT 65℃清洗切片15 min,50%甲酰胺/2×SSCT 65℃清洗切片2次,每次30 min;用5%的羊血清封闭1~2 h;二抗(Anti-Digoxigenin-AP)室温孵育 1.5 h;滴加 BCIP/NBT(1 mL平衡液加4.5 μL NBT和3.5 μL BCIP)染色;显色完成后置于显微镜下观察。
2 结果与分析
2.1 团头鲂cdc20基因的分子特征和进化分析
通过PCR测序及生物信息学分析证实团头鲂cdc20编码区的基因组长3 960 bp,包含10个外显子和9个内含子,cDNA长1 482 bp,编码493 aa;预测蛋白的理论分子质量为5.44 ku,等电点为7.68。氨基酸序列多重比对结果显示(图1),团头鲂Cdc20与鲤和斑马鱼的相似度分别高达95.74%和90.12%,与大鼠、人类和非洲爪蟾的相似度分别为59.96%、59.36%和63.58%。结构域分析显示Cdc20有7个WD40重复基序,且该基序在不同物种中都相对保守,进一步分析发现每个WD40基序形成4股反向平行β折叠,7个WD40基序构成稳定的7叶螺旋桨状结构(图2)。

图1 团头鲂Cdc20蛋白的多序列比对Fig.1 Multiple sequence alignment of Cdc20 proteins of Megalobrama amblycephala
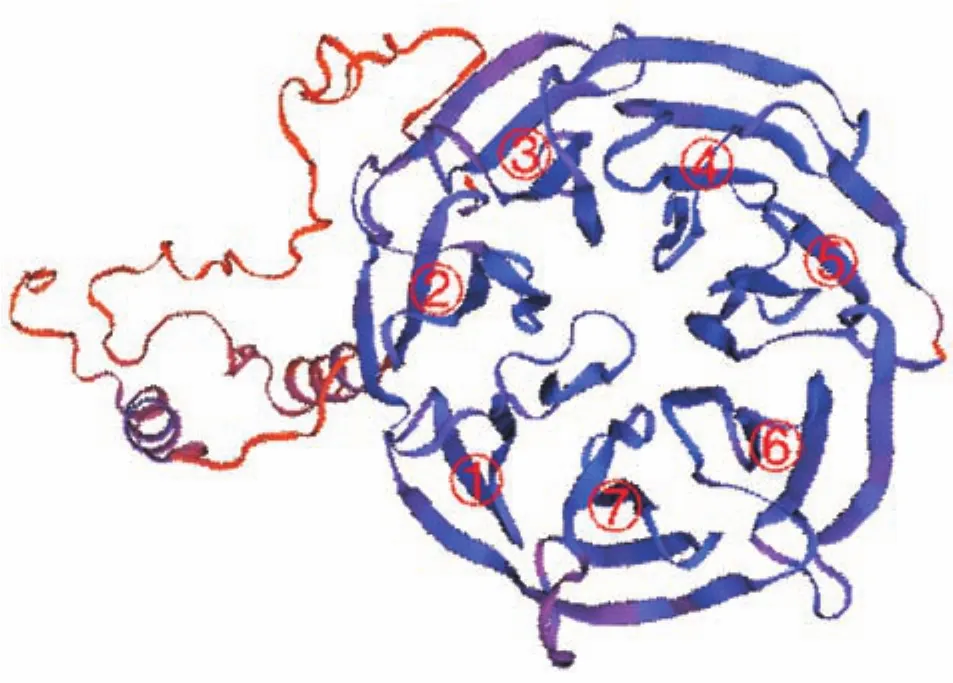
图2 团头鲂Cdc20蛋白预测的三级结构Fig.2 Predicted structure model of M.amblycephala Cdc20 protein
基于多个物种Cdc20氨基酸序列的系统进化分析显示,团头鲂与鲤的系统进化关系最近,其次是斑马鱼。而亲缘关系较远的两栖类、鸟类和哺乳类形成一个独立分支(图3)。
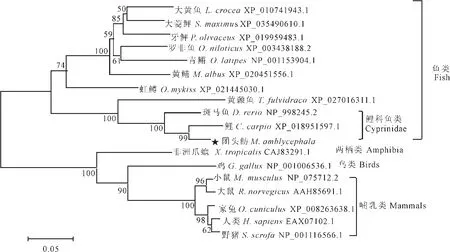
图3 脊椎动物CDC20蛋白的系统进化树Fig.3 Phylogenetic analysis of the protein sequences of CDC20 in vertebrates
2.2 团头鲂cdc20在成鱼各组织和胚胎发育各时期的表达
通过sqRT-PCR检测cdc20基因在团头鲂成鱼不同组织中的表达情况,结果如图4所示,cdc20mRNA在脑、鳃、心脏、脾脏、肠道、肾脏和肌肉中有微弱的表达,而在卵巢和精巢中表达量最高,说明cdc20可能与团头鲂性腺发育有关。

图4 团头鲂cdc20基因在成鱼各组织中的表达Fig.4 Expression of cdc20 gene in different tissues of M.amblycephala
通过qRT-PCR检测cdc20在团头鲂各发育阶段胚胎中的表达情况,包括受精卵、2-细胞期、16-细胞期、囊胚期、原肠期、神经期、体节期、心跳期和孵化期。结果(图5)显示该基因在受精卵中的表达水平最高,随着胚胎发育的进行,其表达量呈逐渐下降的趋势,推测团头鲂cdc20可能是1个母源基因,对维持胚胎的早期发育具有重要作用。
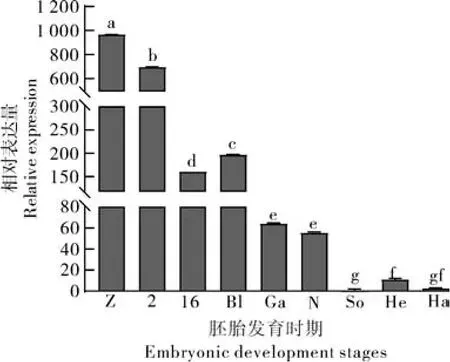
图5 团头鲂cdc20基因在胚胎发育各时期中的表达Fig.5 Expression of cdc20 gene at different embryonic development stages of M.amblycephala
2.3 团头鲂cdc20在生殖细胞中的表达模式
根据团头鲂性腺切片原位杂交的结果(图6),cdc20基因在Ⅰ期卵母细胞信号最弱。卵母细胞进入Ⅱ期后,其表达量开始升高,且在卵母细胞的胞质内表达,而在皮质泡和细胞核中几乎没有表达。而在Ⅲ期卵母细胞的卵黄颗粒中检测到了强烈的探针信号,但细胞核中信号较弱。Ⅳ期卵母细胞中充满了卵黄颗粒,观察不到细胞核和皮质泡,cdc20基因在Ⅳ期卵母细胞的卵黄颗粒中表达,而在放射带几乎不表达。与H.E染色(图7A)对比,基于精巢切片原位杂交的结果显示,在精原细胞以及生精小管的生殖上皮中该基因的表达量最高,而在成熟精子中的表达量低(图7B)。
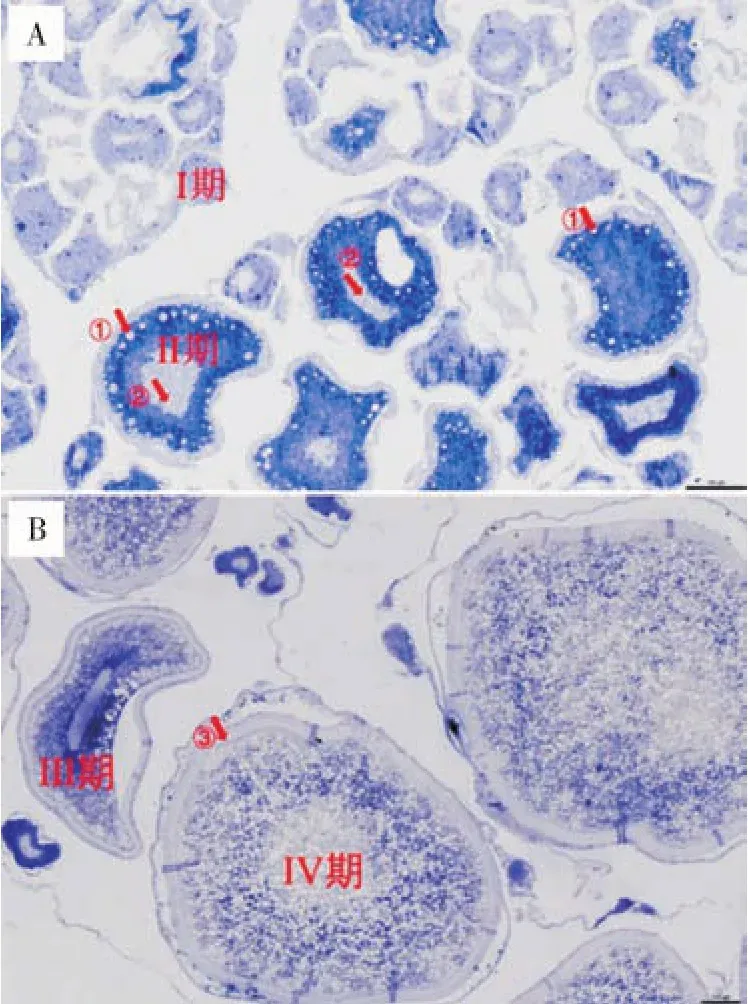
图6 cdc20基因在团头鲂不同发育时期卵母细胞中的表达Fig.6 Expression of cdc20 gene at different development stages of M.amblycephala oocytes
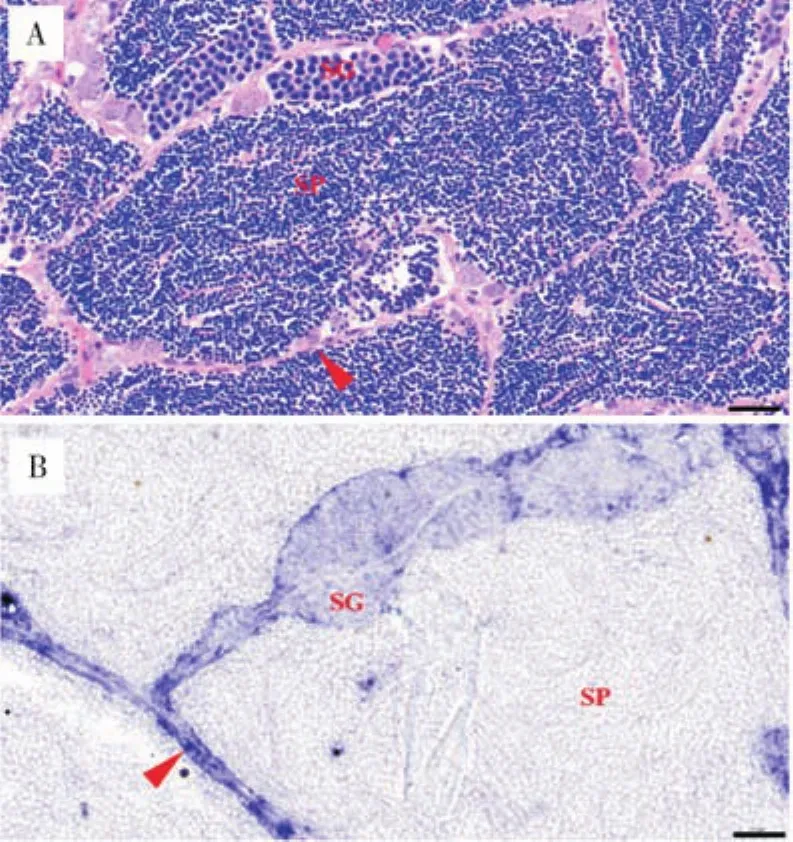
图7 团头鲂cdc20基因在精巢中的表达Fig.7 Expression of cdc20 gene in testis of M.amblycephala
3 讨论
CDC20蛋白通过C端的WD40结构域(即WD40基序)识别、激活和结合APC/C调节细胞分裂中姐妹染色体的分离[8],被认为是生殖细胞成熟的重要调节因子[9],在生物体生长和生殖中发挥重要作用。WD40蛋白最早在牛的G蛋白β亚基中发现[10],该蛋白的7个WD40基序形成稳定的螺旋桨状结构[11],参与信号转导、染色质组装、凋亡、细胞周期调控等过程[12]。本研究发现团头鲂Cdc20包含的7个WD40基序可形成7叶螺旋桨状结构,这种特殊的结构形成稳定的支架,为蛋白质的识别和组装提供位点,并增强蛋白之间的互作[12]。氨基酸序列和结构域的保守性说明团头鲂cdc20基因可能与在小鼠、人类中的功能相类似,参与了细胞周期调控、有丝分裂和减数分裂的过程。
本研究还发现,团头鲂cdc20主要在性腺中表达。类似地,有研究发现cdc20基因在斑马鱼性腺中高表达,且对斑马鱼卵子和精子发生过程具有重要作用[13]。在其他物种中,该基因同样与生殖相关。小鼠CDC20蛋白表达量的降低导致雌性失去生殖能力[5],人类CDC20基因发生突变导致女性不孕[6]和男性无精子症[7]。因此,我们推测团头鲂cdc20基因可能参与生殖和性腺发育。另外,本研究发现在卵巢成熟过程中,随着卵母细胞的发育,该基因的表达量逐渐升高,这与在猪卵母细胞中的表达一致[14]。而精巢切片的原位杂交结果与卵巢相反,cdc20在精原细胞中的表达量最高,而在发育成熟的精子中表达量最低。这些研究结果说明,cdc20基因可能在团头鲂卵巢和精巢中发挥的功能不同,在卵巢中可能参与卵母细胞的成熟过程,而在精巢中对精原细胞早期的形成具有重要作用。
此外,团头鲂cdc20在胚胎发育早期大量表达,然后逐渐下降,因此推测该基因是一个母源基因,对早期胚胎发育具有重要意义,包括激活卵子、促进早期的卵裂、促进合子基因的表达等[15]。在秀丽隐杆线虫中的研究发现,CDC20蛋白与APC/C复合物结合后参与母源因子卵母细胞成熟蛋白(oocyte maturation proteins,OMA)介导的卵母细胞到早期胚胎发育的过程[16]。此外,有文献报道APC/C复合物是一个母源因子[17],而APC/C复合物的激活需要CDC20蛋白,由此推测CDC20蛋白存在于胚胎发育的早期。这些结果说明团头鲂cdc20可能是1个母源基因。
综上,本研究克隆并分析了团头鲂cdc20基因的序列特征及其时空表达模式,结果可为后续深入研究该基因的功能奠定理论基础。
