荧光铜纳米簇的制备及荧光分析法检测过氧化氢
——推荐一个分析化学综合实验
2022-07-30董江雪范亚杰刘晓彤李慧
董江雪,范亚杰,刘晓彤,李慧
河北大学化学与环境科学学院,河北 保定 071000
近年来,以新型荧光纳米材料为探针的光学传感器在对环境进行分析的过程中发挥了重要作用[1]。荧光金属纳米簇主要是由金、银、铜等金属的几个到几十个原子组成的相对稳定的聚集体,性质介于单个金属原子和较大块金属之间。荧光金属纳米簇具有优异的光学特性,荧光发射可调、荧光稳定性高、量子产率较高,且易于合成和毒性小,具有良好的生物相容性,因此受到了广泛的关注,具有十分巨大的发展潜力[2]。为了提升本科教学的前沿性和学术性,我们将科研成果中关于荧光铜纳米簇的制备和H2O2的荧光分析法应用于教学,设计了该综合性化学实验。该实验内容主要包括荧光铜纳米簇的制备、荧光光谱表征及以荧光铜纳米簇为探针的H2O2检测实验。首先以青霉胺为稳定剂在室温下通过搅拌制备发射红色荧光的铜纳米簇,因制备原料简单,只需硝酸铜和青霉胺,因此,在实验内容中设计了优化反应物用量比的内容,使学生建立寻找最佳实验条件的思想。同时,该实验制备周期短,只需半个小时即可完成铜纳米簇的制备,完全可以满足教学时长的要求。此外,本科教学实验中经典的H2O2检测实验是利用高锰酸钾滴定法实现对H2O2含量进行检测的,本实验以学生制备的铜纳米簇为探针,通过荧光分析法对水溶液中的H2O2进行检测,在学习仪器原理操作的同时,拓宽了学生的视野,激发学生的学习热情,对培养学生的前沿思想、创新思维及综合实践能力具有重要意义。
1 实验目的
(1) 了解金属纳米簇的性质及应用领域;
(2) 掌握荧光铜纳米簇的制备方法;
(3) 掌握荧光分光光度计的基本操作和原理;
(4) 掌握利用荧光分析法检测H2O2,绘制标准曲线的方法。
2 实验原理
金属纳米簇是一种尺寸约为2 nm,介于金属原子和金属纳米颗粒之间的纳米材料[3],近几十年人们对金、银等贵金属纳米簇进行了广泛的研究[4],而与金、银同一族的铜,一直到近些年才引起人们的重视。与金、银相比,铜的相对含量丰富,价格低廉且易于获取,铜纳米簇不仅与金、银等纳米簇具有相似的光化学性质,其生物相容性更高,环境友好,具有广泛的应用前景。
因小尺寸的金属纳米簇在溶液中易发生聚集,因此在制备金属纳米簇时通常向其中加入稳定剂,即通过模板法制备金属纳米簇,目前用于稳定金属纳米簇的模板有树枝状分子、DNA、蛋白质、巯基小分子等[5-8]。模板法也是目前制备铜纳米簇的主要方法[9]。青霉胺是一种含有巯基的小分子,可以作为稳定剂制备荧光铜纳米簇,且因青霉胺具有较强的还原性,在制备铜纳米簇的过程中可同时作为还原剂将二价铜离子还原为一价和零价,或者荧光铜纳米簇。根据荧光光谱的特性可知,荧光物质有最大激发光谱和发射光谱,荧光发射光谱的位置不会随激发波长的变化而变化,因此,可以在不同激发波长下扫描荧光物质的发射光谱,确定最大发射峰的位置,再固定发射峰,反扫激发光谱,从而确定最大激发光谱的位置。
H2O2是一种常见的化学物质,在生活中具有广泛的用途。作为一种重要的无机化工原料和精细化工产品,在纺织、造纸等化工领域也得到广泛应用。H2O2是高效、清洁的氧化剂,被广泛应用于印染纺织工业的漂白过程中[10]。研究显示,H2O2进入人体后大量堆积极有可能加速人体细胞衰老和诱发心脑血管疾病等[11],因此对H2O2的检测具有极为重要的意义。本实验中因H2O2具有强氧化性,当向铜纳米簇溶液中加入H2O2后,铜纳米簇会被氧化导致纳米簇的稳定结构被破坏,从而使得铜纳米簇溶液的荧光被猝灭。在一定的浓度范围内,H2O2的量与溶液荧光的猝灭值呈线性相关,据此,可以绘制标准曲线,实现对水溶液中H2O2的检测。
3 实验试剂与仪器
3.1 实验试剂
还原型D-青霉胺、三水硝酸铜、混酸溶液(0.04 mol·L-1的磷酸、硼酸和醋酸)、0.2 mol·L-1的氢氧化钠溶液、H2O2溶液,实验试剂均为分析纯,购于阿拉丁试剂(上海)有限公司(中国),实验用水为超纯水。
3.2 实验仪器
分析天平,85-2A型数显磁力搅拌器(常州越新)、MX-S型漩涡混匀器(北京大龙)、ZF-20D型暗箱式紫外分析仪(上海锦岐)、F-2700型荧光分光光度计(日本,日立)、移液器、移液管、JSM-7500型冷场扫描电子显微镜(日本,日本电子)、Tecnai G2 F20 S-TWIN型透射电子显微镜(美国,FEI)。
4 实验内容
4.1 荧光铜纳米簇的制备
配制溶液:准确称取0.1492 g D-青霉胺粉末于10.00 mL棕色容量瓶中,加超纯水定容、摇匀,配制成0.1000 mol·L-1的D-青霉胺溶液;准确称取0.2416 g三水硝酸铜固体于10.00 mL容量瓶中,加超纯水定容、摇匀,配制成0.1000 mol·L-1的硝酸铜溶液。
取5个3 mL样品瓶将其编号为1-5号,首先,向1-5号样品瓶中分别加入超纯水900、850、800、750、700 μL;随后,向上述样品瓶中依次加入0.1000 mol·L-1的D-青霉胺溶液50、100、150、200、250 μL,并放置在恒温测速磁力搅拌器上,在室温下以500 r·min-1的转速搅拌;然后,向5个样品瓶中加入0.1000 mol·L-1的硝酸铜溶液50 μL,继续搅拌0.5 h;最后,将上述溶液在室温下静置0.5 h,获得不同青霉胺与硝酸铜摩尔比(1 : 1,2 : 1,3 : 1,4 : 1,5 : 1)下制备的荧光铜纳米簇,用于探究反应物比例对制备的纳米簇的影响,优化制备铜纳米簇的最佳反应物之比。
4.2 铜纳米簇的荧光表征
取5支2 mL的一次性离心管,依次取上述制备的1-5号铜纳米簇溶液40 μL于5支离心管中,向其中各加入960 μL的超纯水得到稀释后的铜纳米簇溶液,利用移液器将稀释后的荧光铜纳米簇分别移入5支比色皿中,将比色皿置于暗箱式紫外分析仪中,在345 nm的紫外灯下观察不同反应物比例下获得的铜纳米簇的发光情况,初步确定制备铜纳米簇的最佳青霉胺与硝酸铜之比。
将上述观察到的荧光最强的比色皿中的铜纳米簇置于荧光分光光度计上,扫描其激发和发射光谱,确认最大激发和发射波长,设置荧光分光光度计的激发和发射狭缝均为10 nm,光电倍增管电压为400 eV。首先,将荧光光度计的最大激发波长设置为345 nm,在370-650 nm范围内扫描其发射光谱,得到其最大发射波长为λem;然后,固定发射波长为λem,在330-600 nm范围内扫描铜纳米簇溶液的激发光谱,得到最大激发波长λex。最后,在330-370 nm的激发波长范围内,改变激发波长,在480-650 nm范围内扫描不同激发波长下的铜纳米簇溶液的发射光谱,观察制备的铜纳米簇是否具有激发依赖性质[12]。进一步在最大激发波长下,在480-650 nm范围内扫描5支比色皿中稀释的1-5号铜纳米簇溶液的发射光谱,确定制备铜纳米簇的最佳青霉胺和硝酸铜比例。
4.3 荧光分析法检测H2O2
配制溶液:取6个20 mL的样品瓶,用移液管首先向其中依次加入10.00 mL混酸溶液(0.04 mol·L-1的磷酸、硼酸和醋酸),随后向上述样品瓶中分别加入1.25、1.75、2.00、2.25、2.75和3.75 mL 0.2 mol·L-1的氢氧化钠溶液,上述溶液混合均匀后依次得到pH为2.4、2.9、3.3、3.8、4.4和5.3的BR缓冲溶液(伯瑞坦-罗比森缓冲溶液);用移液器移取103 μL 30% H2O2溶液(9.7 mol·L-1)于10.00 mL的棕色容量瓶中,加超纯水定容至刻度,获得100 mmol·L-1的H2O2溶液,并逐级稀释到1.00 mmol·L-1作为工作溶液。
检测H2O2:取7支2 mL的一次性离心管,依次向其中加入一定量的超纯水,150 μL pH 3.8的缓冲溶液,40 μL铜纳米簇工作溶液和1 mmol·L-1的H2O2标准溶液(0、10、50、100、200、300、400 μL),使溶液的最终体积均为1.00 mL,于漩涡混匀器上混匀。同时,另取一支2 mL的一次性离心管,依次向其中加入610 μL超纯水,150 μL pH 3.8的缓冲溶液,40 μL铜纳米簇工作溶液和200 μL的H2O2未知溶液,于漩涡混匀器上充分混匀。上述8支溶液在室温下静置反应40 min后,于荧光分光光度计上在最大激发波长下,扫描荧光发射光谱,记录各溶液的荧光强度(F)。以加入H2O2后荧光强度的猝灭值(ΔF)对H2O2的浓度作图,绘制ΔF-C(H2O2)的标准曲线,同时记录未知溶液的荧光强度(F未知),将ΔF未知代入标准曲线方程,计算未知溶液中H2O2的含量。
5 结果与讨论
5.1 铜纳米簇的制备及荧光性质
如图1a所示,制备的铜纳米簇原液在可见光下为淡黄色悬浊液,在紫外灯下发射强烈的红色荧光,铜纳米簇稀释后的溶液在可见光下为白色悬浊液,在紫外灯下发射红色荧光。制备好的铜纳米簇溶液在室温下放置,可在10天内保持光学性质稳定。图1b表明铜纳米簇具有镜像对称的激发和发射光谱,最大激发波长为λex= 340 nm,最大发射波长为λem= 620 nm,图1c表明制备的荧光铜纳米簇不具备激发依赖性[12],在不同的激发波长下,发射峰的位置没有发生明显移动。按照4.1节的方法,在不同的D-青霉胺和硝酸铜比例下制备了铜纳米簇,通过荧光光谱测量,比较荧光强度,结果表明当D-青霉胺和硝酸铜的比例为4 : 1时所制备的铜纳米簇具有较好的荧光性能,如图1d所示。此外,我们利用冷场电子扫描电镜(SEM)和高分辨透射电子显微镜(TEM)技术探究了所制备的铜纳米簇的微观形貌及颗粒尺寸大小,SEM表征结果(图1e)表明铜纳米簇在溶液中成片状堆积状态,TEM图(图1f)中可看到这些片状结构是由多个尺寸约为2 nm的纳米颗粒聚集而成。此外,这些聚集的纳米颗粒可以均匀地悬浊在溶液中保持至少2 h,但若静置时间太长会出现一定的沉降现象,因此,制备好的纳米簇储备液在实验前应首先进行漩涡混匀。

图1 (a) 铜纳米簇原液(1和2)和稀释后的溶液(3和4)在可见光(1和3)及紫外灯(2和4)下的照片;(b) 铜纳米簇的 激发和发射光谱图;(c) 不同激发波长下铜纳米簇的发射光谱;(d) 不同D-青霉胺和硝酸铜比例制备的 荧光铜纳米簇的发射光谱图;(e) 铜纳米簇的SEM图;(f) 铜纳米簇的TEM图,插图为放大的TEM图
5.2 检测H2O2
实验首先对溶液的最佳pH条件进行了优化,测定了在不同pH条件下空白溶液(不加H2O2)和加入H2O2后溶液的荧光强度,结果如图2所示,无论是空白溶液还是加入H2O2后溶液的荧光强度均存在随pH先升高后降低的现象,且ΔF在pH为3.8时具有最大值,因此,实验选取pH 3.8作为检测H2O2的最佳条件。
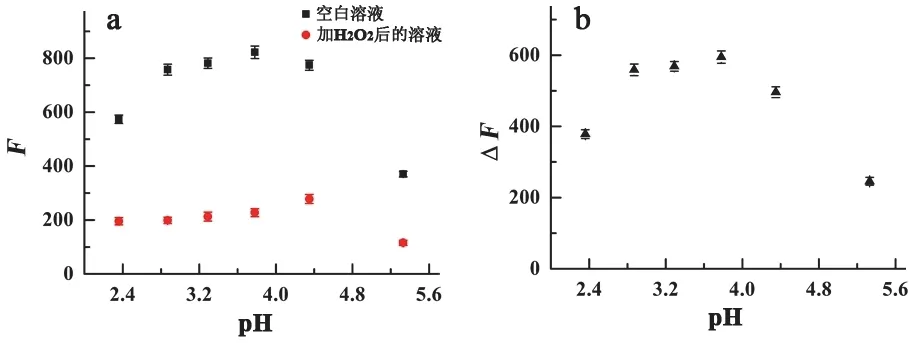
图2 (a) 不同pH条件下空白溶液加入H2O2后反应溶液的荧光强度; (b) 不同pH条件下加入H2O2后溶液荧光强度的猝灭值
以铜纳米簇为探针检测溶液中的H2O2,按照4.3节的方法,扫描含不同浓度H2O2的铜纳米簇溶液的荧光发射光谱,如图3a所示,当溶液中不含有H2O2时,溶液具有较强的荧光强度,当加入的H2O2的量逐渐增加后,溶液的荧光强度随之降低,记录不同H2O2浓度的溶液的荧光强度(F),以加入H2O2后荧光强度的猝灭值(ΔF)为纵坐标,以H2O2的浓度为横坐标绘制标准曲线,如图3b所示,标准曲线方程为ΔF= 1.74 + 4.72,相关系数R= 0.9972,表明在该范围内荧光强度的猝灭值与溶液中H2O2的浓度间具有较好的线性关系,据此可建立检测溶液中H2O2含量的荧光分析法。经计算,该方法检测H2O2的最低检出限(LOD)为1.71 μmol·L-1,LOD = 3σ/k。
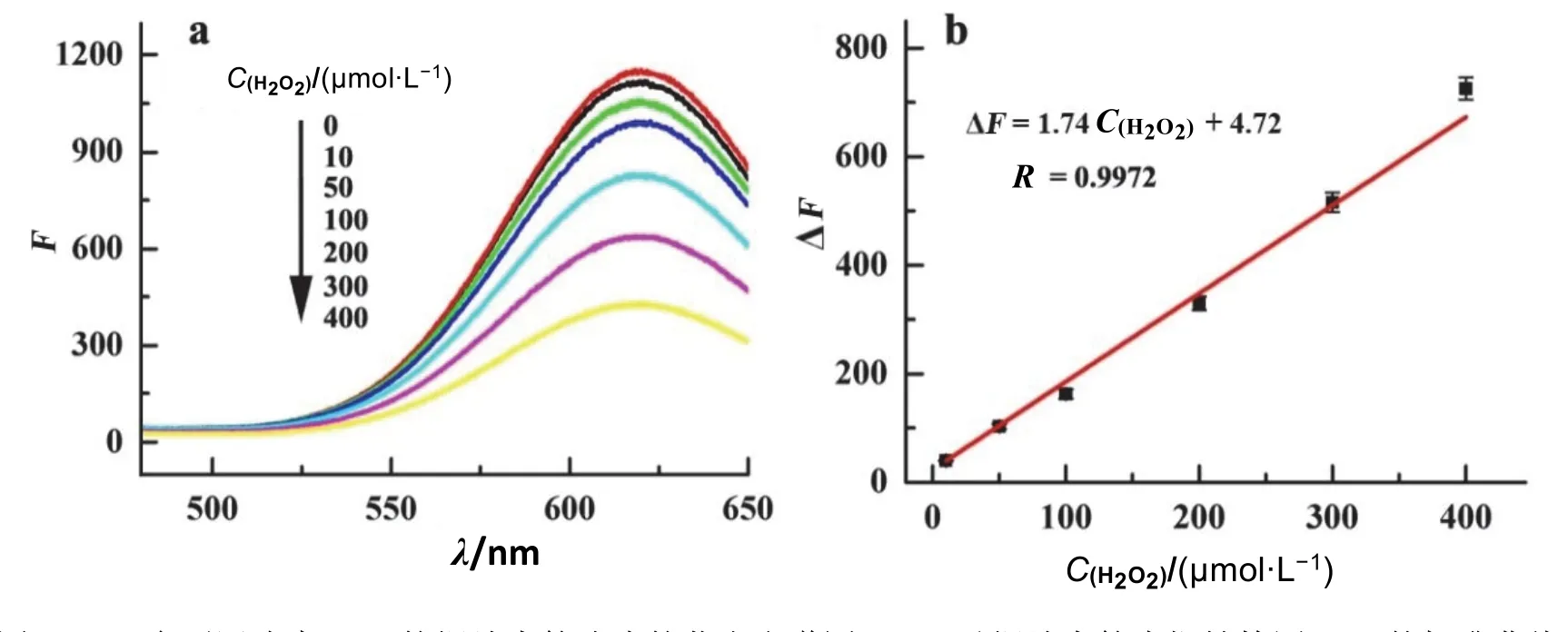
图3 (a) 含不同浓度H2O2的铜纳米簇溶液的荧光光谱图;(b) 以铜纳米簇为探针检测H2O2的标准曲线
6 注意事项
(1) 配制好的溶液一定要充分混匀,以确保溶液反应均匀。
(2) 在紫外灯下观察铜纳米簇的荧光强度时须将溶液置于四面透光的石英比色皿中进行观察,排除其他容器自身杂质荧光的干扰。
(3) 配制检测H2O2的反应溶液时,反应物的添加顺序不可更改。
(4) 在进行荧光测定时,系列样品按照由低向高浓度测定时可以不洗比色皿,当更换溶液时,一定要用超纯水清洗比色皿,最后将比色皿中的超纯水尽量移除完毕,再将待测样用移液器移入比色皿。
(5) 比色皿在放入仪器前用吸水纸将表面溶液吸干。
(6) 移取H2O2溶液时,一定要操作规范,以免将溶液洒到身上或衣服上。
7 实验组织运行方式
本实验适用于已学习了部分光谱分析理论知识的学生,实验采用小班教学,每次面向10-12名同学进行授课,将学生分为三组,每组3-4人。实验学时为9学时,分为两个阶段进行。第一阶段为5学时(上午进行),内容包括:教师引导学生进行文献调研,了解铜纳米簇和H2O2检测的相关知识;教师进一步讲解实验原理并演示移液器、漩涡混匀器、磁力搅拌、暗箱式紫外分析仪和荧光分光光度计的使用方法及铜纳米簇的制备方法,学生开展实验,配制溶液,制备荧光铜纳米簇,将制备好的铜纳米簇溶液在室温下静置,待后续实验使用。第二阶段为4学时(下午进行),内容包括:学生开展实验,确定铜纳米簇的最大激发和发射波长,确定制备荧光铜纳米簇的最佳反应物之比,配制溶液,绘制检测H2O2的标准曲线。实验教学中,结合学生已有的理论知识,启发式引导学生回顾相关理论知识,理解分析化学中探针的含义和利用荧光强度猝灭值为纵坐标绘制标准曲线的方法。
该实验在教学中用于综合化学实验课程,该课程目标如下:(1) 加深对化学基础理论知识的理解,学习实验数据的处理方法,进一步掌握各种仪器的基本工作原理、特点和应用;(2) 综合运用多种实验操作技术,提高观察、分析和解决问题的能力;(3) 了解科技前沿知识,开拓视野、发散思维,培养创新意识;(4) 培养学生实事求是的科学态度和认真细致的工作作风。实验中的基本荧光光谱理论知识、合成探针、荧光分光光度计的使用和利用荧光猝灭法绘制标准曲线,与课程目标1对应;实验涉及的探针合成实验及发光性质观察等内容,与课程目标2对应;实验在教学中引入新兴的探针材料纳米簇,并通过启发学生查阅文献资料及讲解等方式学习纳米簇的相关知识,与课程目标3对应;在实验过程中,不规范的操作可能导致纳米簇的合成失败或H2O2的检测结果不准确,启发学生尊重实验事实并正确对待实验结果,同时操作中严格按照规定进行,与课程目标4对应。
此外,该实验的考核内容由预习报告、课堂表现、实验操作和实验报告组成,各部分占比分别为10%、20%、40%和30%。综合化学实验课程共由15次实验课组成,该实验占用2次实验课时,因此在课程成绩中占比2/15。由于该实验是综合化学实验课程中唯一涉及荧光探针和荧光分析法的实验,同时实验中设计了通过紫外灯观察探针发光情况、让学生用自己合成的探针进行分析检测实验等环节,激发了学生的好奇心理,充分调动了学生的学习积极性。因此,学生对此实验反馈较好,教学评价结果优秀。但该实验仍存在一定的不足,未来改进方向有:(1) 实验中每个同学制备1000 μL的铜纳米簇溶液,但整个实验中只需要不到500 μL纳米簇溶液即可,存在浪费的问题,而青霉胺试剂较为昂贵,因此导致实验成本较高,今后应努力对教学中荧光探针的制备方法进行改进,寻找更加简单、合成量可更少的制备方法;(2) 该实验以具有强氧化性的H2O2为检测对象,在实验过程,学生在移取30% H2O2溶液时,稍有不慎即会沾染到身体或衣服上,存在一定隐患,今后应改进H2O2稀溶液的配制方法,或在不影响教学效果的基础上寻找更为安全的检测对象替代H2O2。
8 结语
本实验将科学研究中常用的一种新型荧光纳米材料——铜纳米簇引入化学实验教学中,开拓学生视野,使其明白发射荧光的物质不仅限于化学分子。此外,铜纳米簇的制备方法简单,反应快速,所需实验试剂无毒,绿色环保,可满足本科教学的时长及安全性要求,且在不同反应物比的条件下制备铜纳米簇,并将其荧光发射情况进行比较,使学生理解“优化实验条件”的基本思路和方法。同时,在实验条件下,H2O2可以猝灭铜纳米簇的荧光,荧光强度的猝灭值在一定范围内与H2O2的浓度成正比,因此在教学中建立荧光猝灭法检测H2O2的分析方法,使学生构建了“利用待测物对荧光探针的猝灭效应检测其含量”的科学思想。将本实验引入教学,提升了教学的学术深度,激发了学生的学习热情,启发学生思考,有助于培养学生的创新意识和综合实践能力。
