化浊抗纤保肝汤调控PI3K/AKT/mTOR途径抑制肝纤维化的机制研究*
2022-07-30孙瑞芳刘石柱李瑞东许双朝
孙瑞芳,刘石柱,李瑞东,许双朝
(1.邢台医学高等专科学校第二附属医院消化内科,邢台 054000;2.邢台医学高等专科学校第二附属医院放化疗科,邢台 054000)
肝纤维化是肝炎、脂肪肝等多种慢性肝病发展为肝硬化的常见机制[1]。研究结果表明,受到氧化应激刺激的肝形状细胞和肝细胞会分泌炎性因子,从而诱导成纤维细胞增殖和细胞外基质合成,并最终加速肝纤维化进程[2]。然而,目前尚无治疗肝纤维化的特效方法。化浊抗纤保肝汤(HZKXD)是基于“浊毒”原理拟定的具有解毒化浊、行气活血功效的中药汤。最新临床研究发现化浊抗纤保肝汤与恩替卡韦联合使用可提高治疗肝纤维化的效果[3],但是单独使用是否具有抗纤维化作用,以及其治疗机制仍不清楚。磷脂肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/雷帕霉素靶蛋白(mTOR)通路是肝纤维化过程的关键通路之一,体内研究结果显示肝纤维组织中PI3K/AKT/mTOR通路表达水平显著升高[4]。研究已经证实了PI3K/AKT/mTOR通路不但会促进肝星状细胞和成纤维细胞的活化,还会促进细胞外基质的积累,从而促进肝纤维化进程[5]。此外,也有研究显示与HZKXD具有类似功能的抗纤抑癌方也具有抑制PI3K/AKT/mTOR通路的作用[6]。因此,文章主要分析HZKXD对肝纤维化的治疗作用,并分析其对炎性反应和PI3K/AKT/mTOR通路的影响。
1 材料与方法
1.1 实验材料 SD大鼠(SPF级,雄性,6周龄,体质量210~230 g,北京维通利华动物公司,中国)。四氯化碳(Sigma公司,美国),酶联免疫吸附(ELISA)试剂盒、苏木精-伊红(HE)染色、Masson染色试剂盒(碧云天公司,中国),酶标仪(Model 680,Bio-Rad,美国),RNAspin Mini(GEHealthcare公司,美国),Bestar qPCR RT和BestarTMqPCR试剂盒(DBI Bioscience公司,德国),PI3K(##4255,Cell Signaling Technology公司,美国),AKT(ab8805)、mTOR(ab32028)、GAPDH(ab181602)的一抗和山羊抗免疫球蛋白G二抗(Abcam公司,美国),硝酸纤维素膜(EMD Millipore公司,美国),电化学发光(ECL)显色试剂盒(Thermo Fisher公司,美国),显微镜(Carl Zeiss公司,德国)等。
1.2 大鼠分组、建模和干预方法 80只大鼠随机分为4组:对照组、模型组、低剂量HZKXD组和高剂量HZKXD组(n=20)。根据参考文献[7]的方法构建肝炎后肝纤维化模型。将四氯化碳溶解于橄榄油中,浓度为10%,腹腔注射,每次1 mL/kg,每周2次,连续8周。通过穿刺收集肝组织,利用HE染色和Masson染色在病理学的角度上分析建模成功率。本次研究无大鼠死亡,模型组、低剂量HZKXD组和高剂量HZKXD组建模成功率分别为90%(18/20),95%(19/20)和 95%(19/20),在对照组、低剂量HZKXD组和高剂量HZKXD组中随机选择18只进行后续研究。对照组注射等量生理盐水作为对照。低剂量HZKXD组和高剂量HZKXD组使用化浊抗纤保肝汤灌胃,剂量为5 mL/kg和10 mL/kg,每日1次,连续8周。对照组和模型组灌胃等量生理盐水。HZKXD的制作方法如下:黄芩15 g,黄连 12 g,鳖甲 15 g,三棱 12 g,红景天 12 g,田基黄15 g,绞股蓝 15 g,茵陈 15 g,虎杖 15 g,1 000 mL 水制成水煎剂,然后浓缩至20 mL。
1.3 检测指标和方法
1.3.1 ELISA 取大鼠尾静脉血,在3 000 r/min的转速下,离心半径8 cm,离心15 min收集上清液,分别加入抗体和显色剂,终止显色反应后15 min内检测吸光度(450 nm),然后根据标准曲线计算谷草转氨酶(AST)和谷丙转氨酶(ALT)的浓度。
1.3.2 HE染色检测肝组织损伤 大鼠经过断头处死,收集肝组织并放置进入多聚甲醛固定48 h。将固定好的组织样本利用不同浓度的乙醇进行脱水,然后加入二甲苯进行透明处理并包埋至石蜡中,使用切片机切成4 μm厚的切片。切片水化后制成玻片标本,加入苏木精孵育5 min,然后加入0.5%的伊红染色5 min,洗涤后透化。固定,在显微镜下观察。
1.3.3 Masson染色检测纤维化 将1.3.2中的玻片标本加入Masson三色染料进行染色,根据试剂盒说明书的方法操作,最后在显微镜下观察并拍照,利用图IPP 6.0像分析系统计算胶原蛋白的体积分数。
1.3.4 免疫组化染色 通过检测α-平滑肌肌动蛋白(α-SMA)评估肝组织中成纤维细胞水平。将1.3.2的样本用不同浓度的乙醇脱水。经过抗原修复后,向切片中加入3%的过氧化氢溶液以阻断内源性过氧化物酶的活性。然后,将切片在5%牛血清白蛋白中孵育以封闭非特异性蛋白。然后将1∶50稀释的anti-α-SMA添加到切片中,并在4℃下孵育12 h。然后将切片与特异性二抗和过氧化物酶底物试剂盒在室温下一起孵育1 h。使用光学显微镜观察anti-α-SMA染色阳性区域。
1.3.5 实时定量聚合酶链反应(RT-qPCR) 使用RNeasy Mini试剂盒取肝组织中的总RNA,然后使用Bestar qPCR RT试剂盒将其逆转转录为cDNA,条件如下:37℃/15 min;98℃/5 min。然后使用BestarTMqPCR预混液进行qPCR实验,条件如下:95 ℃/2 min,94 ℃/20 s,58 ℃ 20 s,72 ℃/20 s,40 个循环,最后在72℃下延伸4min。使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。通过比较循环阈值并以GAPDH作为内参计算PI3K、AKT和mTOR mRNA相对表达水平。PI3K上游引物:5’-GGTGAGGAACGAAGAATGGC-3’,下游引物:5’-TCCGAGGCAAGACAGGGATA-3’;AKT 上游引物:5’-AATACCTGGTGTCGGTCTCA-3’,下游引物:5’-TCGAGCTCATCCTAATGGAG-3’;mTOR上游引物:5’-TACTTCGGGTACTTGGTAA-3’,下游引物:5’-GATGAAGGGATGCTTTACA-3’;GAPDH上游引物:5’-GCACCGTCAAGGCTGAGAAC-3’,下游引物:5’-TGGTGAAGACGCCAGTGGA-3’。
1.3.6 蛋白免疫印迹(Western Blot) 将肝组织裂解后收集总蛋白。通过8%的SDS-PAGE分离每个样品中等量(50 μg)的蛋白质,并将其转移到硝酸纤维素膜上。然后将5%脱脂牛奶完全浸没硝酸纤维素膜来封闭非特异性抗原(室温下2 h)随后,将膜与分别与 PI3K、AKT、mTOR、GAPDH 的一抗(1∶800稀释)在4°C下孵育过夜,然后将山羊抗免IgG二抗按照1∶2 000的比例稀释并在室温下孵育1 h来进行反应。使用化学发光试剂显示,使用Quantum One软件分析灰度计算PI3K、AKT和mTOR蛋白相对于GAPDH的表达量。
1.4 统计学方法 统计分析使用SPSS 26.0软件。数据以均数±标准差(±s)表示。多组间比较采用单因素方差分析,组间两两比较使用SNK-q检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 HZKXD对肝纤维化模型大鼠肝功能指标的影响 4组大鼠肝功能指标比较差异具有统计学意义(P<0.05)。模型组的ALT和AST高于对照组,差异具有统计学意义(P<0.05),低剂量HZKXD组和高剂量HZKXD组的肝功能指标均低于模型组,差异具有统计学意义(P<0.05),且高剂量HZKXD组的ALT和AST水平低于低剂量HZKXD组,差异具有统计学意义(P<0.05),见表1。

表1 HZKXD对肝纤维化模型大鼠肝功能指标的影响Tab.1 Effect of Huazhuo Kangxian Baogan Decoction on liver function indexes of liver fibrosis model rats
2.2 HZKXD对肝纤维化模型大鼠病理学损伤的影响 对照组大鼠组肝组织染色均匀,细胞核呈圆形,细胞排列有序,肝小叶结构清晰。模型组可观察到肝细胞膨大,肝小叶结构遭到破坏,并出现严重的出血和炎性浸润。低剂量HZKXD组和高剂量HZKXD组的损伤情况均较模型组有所缓解,其中高剂量HZKXD组损伤轻于低剂量HZKXD组。见图1。
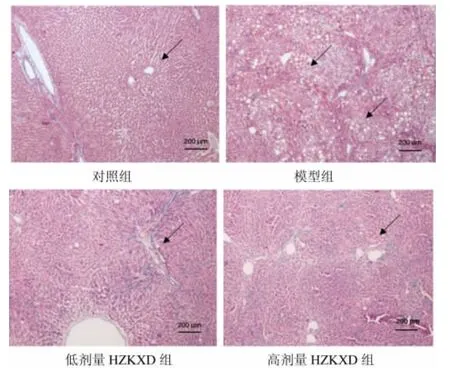
图1 HE染色检测HZKXD对肝纤维化模型大鼠病理学损伤的影响Fig.1 HE staining to detect the effect of Huazhuo Kangxian Baogan Decoction on the pathological damage of liver fibrosis model rats
2.3 HZKXD对肝纤维化模型大鼠肝纤维化的影响如图2所示,粉红色提示正常肝组织,蓝灰色为模型组织。4组大鼠肝纤维化情况比较差异有统计学意义(P<0.05)。模型组胶原蛋白的体积分数高于对照组,差异有统计学意义(P<0.05)。高剂量HZKXD组的胶原蛋白的体积分数低于低剂量HZKXD组,差异具有统计学意义(P<0.05),且两者均低于模型组,差异具有统计学意义(P<0.05)。见表2。
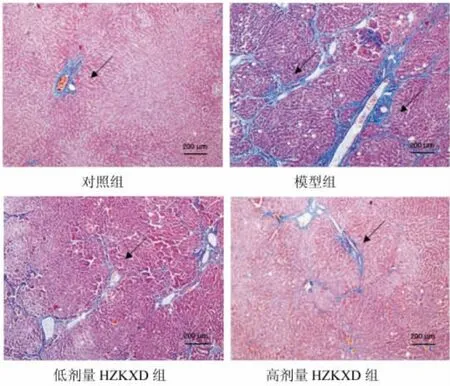
图2 Masson染色检测HZKXD对肝纤维化模型大鼠肝纤维化的影响Fig.2 Masson staining to detect the effect of Huazhuo Kangxian Baogan Decoction on liver fibrosis in rats with liver fibrosis

表2 HZKXD对肝纤维化模型大鼠肝组织胶原蛋白的体积分数的影响Tab.2 Effect of Huazhuo Kangxian Baogan Decoction on the volume fraction of liver tissue collagen in liver fibrosis model rats
2.4 HZKXD对肝纤维化模型大鼠成纤维细胞的影响 如图3所示,蓝色为细胞核,棕黄色为被染色的α-SMA蛋白。结果显示模型组的α-SMA蛋白高于对照组,差异具有统计学意义(P<0.05),见表3。高剂量HZKXD组的胶原蛋白的体积分数、α-SMA蛋白低于低剂量HZKXD组,差异具有统计学意义(P<0.05),且两者均低于模型组,差异具有统计学意义(P<0.05)。
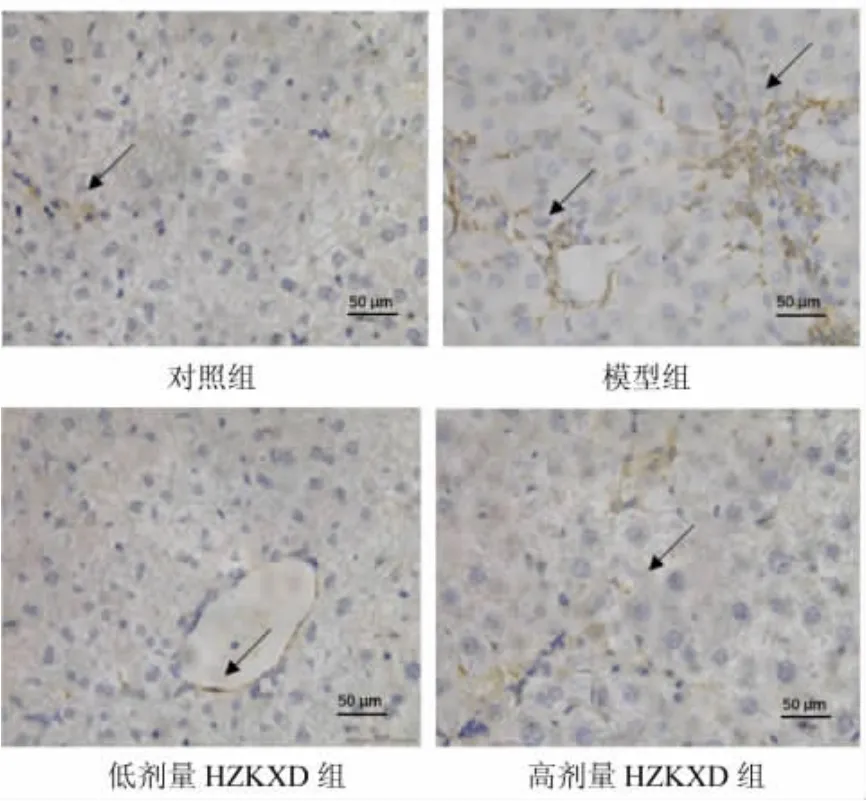
图3 免疫组化染色检测α-SMA蛋白评估HZKXD对肝纤维化模型大鼠成纤维细胞的影响(×400)Fig.3 Immunohistochemical staining to detect α-SMA protein to evaluate the effect of Huazhuo Kangxian Baogan Decoction on fibroblasts in rat liver fibrosis(×400)
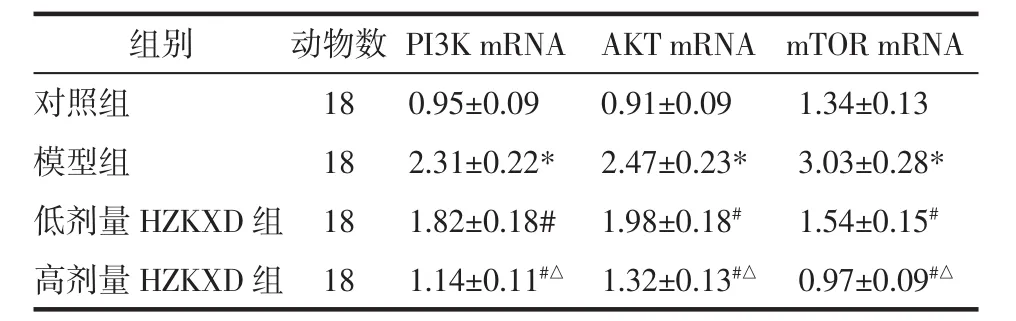
表3 HZKXD对肝纤维化模型大鼠肝组织中PI3K、AKT和mTOR mRNA的影响Tab.3 Effects of Huazhuo Kangxian Baogan Decoction on PI3K,AKT and mTOR mRNA in liver tissues of liver fibrosis model rats
2.5 HZKXD对肝纤维化模型大鼠肝组织中PI3K、AKT和mTOR mRNA的影响 4组大鼠肝组织中PI3K、AKT和mTOR转录水平比较差异具有统计学意义(P<0.05)。模型组的PI3K、AKT和mTOR mRNA表达量高于对照组,差异具有统计意义(P<0.05)。低剂量HZKXD组的PI3K、AKT和mTOR mRNA表达量低于模型组,差异具有统计意义(P<0.05)。高剂量HZKXD组的PI3K、AKT和mTOR mRNA表达量低于模型组和低剂量HZKXD组,差异具有统计意义(P<0.05),见表4。
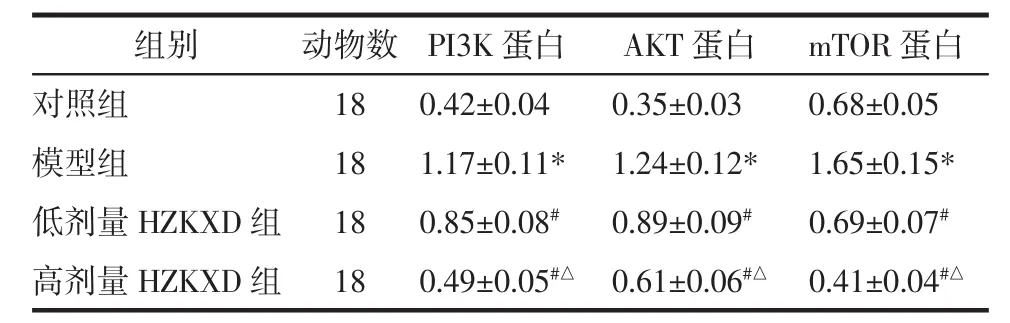
表4 HZKXD对肝纤维化模型大鼠肝组织中PI3K、AKT和mTOR蛋白的影响Tab.4 The effect of Huazhuo Kangxian Baogan Decoction on PI3K,AKT and mTOR protein in liver tissue of rats with liver fibrosis
2.6 HZKXD对肝纤维化模型大鼠肝组织中PI3K、AKT和mTOR蛋白的影响 4组大鼠肝组织中PI3K、AKT和mTOR蛋白表达量比较差异有统计学意义(P<0.05)。模型组的PI3K、AKT和mTOR蛋白>表达量高于对照组,差异具有统计学意义(P<0.05)。低剂量HZKXD组的PI3K、AKT和mTOR蛋白表达量低于模型组,差异具有统计学意义(P<0.05)。高剂量HZKXD组的PI3K、AKT和mTOR蛋白表达量低于模型组和低剂量HZKXD组,差异具有统计学意义(P<0.05),见图4和表5。

图4 Western-Blot检测HZKXD对肝纤维化模型大鼠肝组织中PI3K、AKT和mTOR蛋白表达量的影响Fig.4 Western blot detection of the effect of Huazhuo Kangxian Baogan Decoction on the expression of PI3K,AKT and mTOR protein in liver tissue of liver fibrosis model rats
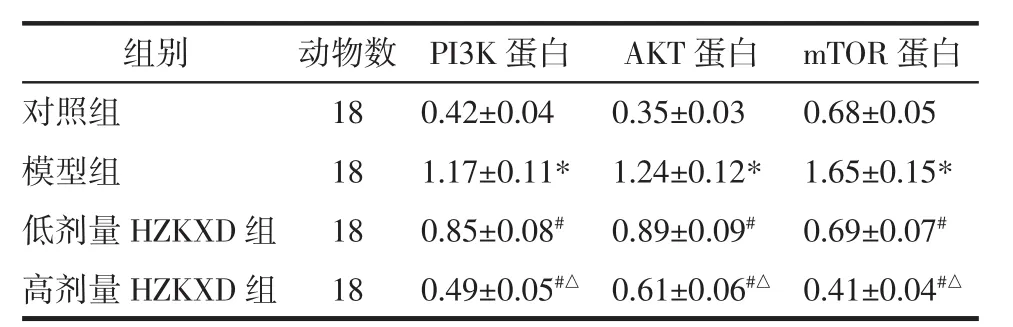
表5 HZKXD对肝纤维化模型大鼠肝组织中PI3K、AKT和mTOR蛋白的影响Tab.5 The effect of Huazhuo Kangxian Baogan Decoction on PI3K,AKT and mTOR protein in liver tissue of rats with liver fibrosis
3 讨论
肝纤维化是持续性和慢性肝损伤的结果,在肝纤维化过程中,肝细胞受损、炎症细胞被募集、肝星状细胞被激活、成纤维细胞大量繁殖,从而导致细胞外基质的合成和降解失调,最终可能导致肝功能衰竭甚至肝癌[8]。研究治疗肝纤维化的新方法具有重要的临床意义。
近年来,中医中药在治疗肝纤维化中取得了长足的进展,在中医理论中,肝纤维化属于“正虚血瘀”以及“浊毒”,其表现为肝肾阴虚与脾肾阳虚以及肝络瘀阻[9]。HZKXD是以黄芩、黄连、鳖甲、三棱、红景天、田基黄、绞股蓝、茵陈、虎杖组成,其从肝纤维化相关的“浊毒”理论出发,兼以行气活血、滋阴柔肝的中心思想而拟成[10]。在本次研究中,通过四氯化碳诱导肝纤维化模型,并以不同剂量的HZKXD干预,结果显示模型组的AST和ALT显著升高,肝组织出现损伤和大量的胶原蛋白累积,而HZKXD可剂量依赖性的降低AST和ALT水平,缓解肝组织损伤和纤维化程度。黄芩和黄连均具有“泻火解毒”之功效,两者可缓解“浊毒”抑制肝纤维化[11-12]。鳖甲、三棱、红景天分别具有“滋阴潜阳”“消积止痛”“益气活血”之功效,可解除肝纤维化患者“正虚”。田基黄、绞股蓝均具有“清热解毒”之功效,从而进一步帮助“清毒化浊”。茵陈和虎杖“清利湿热”“活血散瘀”,并缓解肝纤维化患者“血瘀”之证。本此研究结果表明单独使用HZKXD可显著缓解肝纤维化大鼠的纤维化,并保护肝功能。
成纤维细胞大量繁殖是肝纤维化的重要基础,其会分泌大量的胶原蛋白累积在肝细胞周围[13]。α-SMA是肝成纤维细胞的标志蛋白之一,研究已经证实了纤维化过程中,α-SMA显著升高,而抑制α-SMA可有效缓解肝纤维化[14]。成纤维细胞的增殖和细胞外基质的累积受到细胞内信号通路的调控,其中PI3K/AKT/mTOR通路是最主要的通路之一,它不但可以促进成纤维细胞的增殖,还可以促进胶原蛋白和细胞外蛋白的累积,导致纤维化[15-16]。本此研究结果显示,有四氯化碳诱导的肝纤维化模型大鼠肝组织中α-SMA蛋白表达量显著升高,PI3K/AKT/mTOR通路转录和蛋白表达量也显著升高,而HZKXD可显著的抑制α-SMA蛋白表达,下调PI3K/AKT/mTOR通路。研究显示HZKXD中的黄芩可通过抑制PI3K/AKT/mTOR通路抑制人软骨肉瘤细胞的生长。黄连是HZKXD的主要成分,其中的活性成分黄连素可通过调控PI3K/AKT信号通路抑制IL-21/IL-21R介导的成纤维样滑膜细胞的炎性增殖,这提示HZKXD中的活性成分可能通过抑制PI3K/AKT/mTOR通路抑制成纤维细胞的增殖,并减少细胞外胶原蛋白的累积,降低炎性反应,从而缓解纤维化。
综上所述,HZKXD可缓解肝纤维化模型大鼠肝组织中胶原蛋白累积,还可以抑制PI3K/AKT/mTOR通路减少成纤维细胞,从而缓解肝纤维化。关于HZKXD调控PI3K/AKT/mTOR通路缓解纤维化的作用仍需要临床研究证实,其调控机制也需要进一步研究。
