乳源肽的抗衰老功效研究
2022-07-26栾媛媛谢雨佳李政王娟彭小杰李明逸肖珊珊曾星星张少辉
栾媛媛,谢雨佳,李政,王娟,彭小杰,李明逸,肖珊珊,曾星星,张少辉,
(1.上海交通大学农业与生物学院,上海 200240;2.浙江辉肽生命健康科技有限公司,浙江 温州 325800)
0 引言
人体的皮肤老化分为内在老化和外在老化两种形式。内在老化即随着时间流逝人体正常的老化现象;外在老化则是由于一些外部因素导致的老化,其中紫外线(UV,Ultraviolet)照射被认为是诱发皮肤损伤和老化的主要外部环境因素,占外在老化的80%[1]。UV根据波长范围的不同可以划分为3种:长波紫外UVA(320~400 nm)、中波紫外UVB(290~320 nm)和短波UVC(100~290 nm)[2]。其中UVB造成的辐射最强,能够穿透表皮到达真皮细胞,导致DNA的损伤[3];诱导ROS的产生和促炎因子的增加[4]。UVB照射的皮肤内ROS的含量会出现显著升高,从而导致基质金属蛋白酶含量的升高,进一步导致I型胶原蛋白的降解[5]。
近几年有研究表明某些植物提取物具有抗光老化的效果,如当归根提取物可通过抑制MAPK/AP-1通路磷酸化和诱导TGF-β的激活,抑制基质金属蛋白酶(MMPs)的活性,从而促进胶原蛋白合成[6];佛手柑多酚组分可通过促炎细胞因子IL-1β的调节恢复细胞活力,增强端粒酶活性[7],以及茶叶提取物[8]、废咖啡渣[9]、大豆肽[10]和海洋生物中提取的胶原蛋白肽[11]均具有抗光老化的效果。而对于乳源多肽的研究多集中于抗癌[12]、抗氧化[13]、降血压[14-15]、降血糖[16]等。
本文旨在探讨牛乳蛋白经酶解后产生的多肽,其在经UVB照射后的人皮肤成纤维细胞中的抗光老化作用。
1 材料与方法
1.1 材料与试剂
人皮肤成纤维细胞(human foreskin fibroblasts-1,HFF-1),中国科学院上海细胞库;乳源肽,浙江辉肽生命健康科技有限公司;96孔和6孔细胞培养板,血球计数板等。
DMEM高糖不完全培养基和胎牛血清,美国Sigma公司;青霉素-链霉素溶液(100×)、细胞衰老β-半乳糖苷酶染色试剂盒,上海碧云天生物技术有限公司;胰酶细胞消化液(含酚红)和1×PBS缓冲液,Biosharp;MTT细胞增殖及细胞毒性检测试剂盒、活性氧ROS检测试剂盒,南京凯基生物生物技术股份有限公司;逆转录试剂盒 (PrimeScriptTMRT reagent Kit)、SYBR green法实时定量PCR试剂盒(TB Green Premix Ex TaqTM),日本Takara公司。
1.2 仪器与设备
倒置显微镜,日本尼康公司;离心机,中国医疗器械(上海)股份有限公司;GI36T高压灭菌锅,厦门至微仪器公司;BJ-2CD超净工作台,上海屹明净化设备有限公司;Froma 700低温冰箱,赛默飞世尔科技(中国)有限公司;多功能酶标仪,瑞士帝肯公司;二氧化碳恒温培养箱,德国MEMMERT公司;NanoDrop超微量分光光度仪,赛默飞世尔科技(中国)有限公司;Thermal热循环仪,美国Applied Biosystems公司;PCR仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 细胞培养
将HFF-1细胞用含1%100×双抗、15%FBS的DMEM高糖培养液置于二氧化碳恒温培养箱中培养,培养条件为:37℃,二氧化碳5%,湿度95%。将冻存细胞复苏培养2~3 d后,置于倒置显微镜下观察,当细胞达到80%~90%聚合度时,用PBS清洗,胰酶消化后进行传代培养,传代后的细胞接种于96孔板或6孔板,用于下一步实验。
1.3.2 细胞活力测定和UVB照射
本实验主要探讨不同浓度的乳源肽对细胞的毒性作用。将传代后的HFF-1细胞以1×104/mL的密度接种于96孔板(100μL/孔),经24 h培养后,将不同浓度(0.05、0.08、0.10、0.12、0.50、1.00、2.50、5.00 mg/mL)的乳源肽添加到96孔板中,设为实验组,对照组添加15%FBS的DMEM高糖培养液,继续在37℃培养48 h。根据MTT细胞增殖及细胞毒性检测试剂使用方法,将5×MTT溶液稀释成1×MTT溶液,以50μL/孔的量添加到96孔板中,于37℃恒温培养箱中避光孵育4 h,吸弃上清液,每孔加入150μL DMSO溶液,震荡使甲臜充分溶解后,迅速用酶标仪于490 nm波长处检测OD值,以对照组为基础计算细胞活力。
为探讨UVB对HFF-1细胞造成的亚细胞毒性的辐照剂量,采用不同紫外辐照剂量(1.2、2.4、3.6、4.8 J/cm2)对HFF-1细胞进行照射,辐照剂量用紫外辐照计进行测定,将传代后的HFF-1细胞以1×104/mL的密度接种于96孔板(100μL/孔),经48 h培养后,吸弃培养液,用PBS缓冲液覆盖薄薄的一层连续3次照射,每次间隔12 h,在最后一次照射后24 h测定细胞活力。
为探究预给予不同浓度的乳源多肽对UVB损伤的HFF-1细胞活力的修复作用,将传代后的HFF-1细胞以1×104/mL的密度接种于96孔板(100μL/孔),经24 h培养后,更换培养液为含有不同浓度(0.08、0.1 mg/mL)的乳源多肽,对照组为含15%FBS的DMEM培养液,继续培养24 h后,吸弃培养液,用PBS缓冲液覆盖薄薄的一层,用3.6 J/cm2的紫外辐照剂量对细胞进行紫外照射(对照组避光),照射结束后,弃掉PBS缓冲液,加入培养液,每次间隔12 h,共照射3次,在最后一次照射结束后24 h进行细胞活力测定。每组设6个平行。
1.3.3 ROS测定
在UVB照射后12、24 h时后分别进行ROS的测定。ROS用2’,7’-dichlorodihydrofluorescein diacetate(DCFH-DA)荧光探针进行测定,将用无血清培养液稀释后的DCFH-DA加入到96孔板中,37℃恒温培养箱孵育20 min,用无血清细胞培养液洗涤3次,多功能酶标仪测定荧光强度,激发波长488 nm,发射波长525 nm。同时将96孔板中加入MTT,孵育4 h后用酶标仪测定OD值,作为内参。每组设6个平行。
1.3.4β-半乳糖苷酶测定
与衰老有关的胞内β-半乳糖苷酶在细胞衰老时可表现出高酶活性,为测定乳源肽的抗衰老情况,在最后一次照射后48 h,吸弃培养液,加入β-半乳糖苷酶染色固定液,室温固定15 min后,用PBS洗涤3次,加入染色工作液,于37℃孵育过夜,在倒置显微镜下观察计数,每次计400个,计3次。
1.3.5 ELISA测定
用ELISA方法对I型胶原蛋白和基质金属蛋白酶-1(MMP-1)的活性进行测定。将细胞接种于96孔板中,在最后一次照射24 h后使用ELISA试剂盒进行活性测定。
1.3.6 RT-qPCR测定
在最后一次照射后12 h和24 h分别用RNA提取试剂盒提取RNA,提取的RNA用NanoDrop超微量分光光度仪进行浓度及纯度测定,用逆转录试剂盒进行RNA逆转录(20μL),逆转录条件为:37℃、15 min;85℃、5 s;4℃。逆转录后的cDNA根据试剂盒使用说明用PCR仪进行扩增,反应分两步:95℃、30 s(Step 1);95℃、5 s,60℃、30 s,GOTO 39(Step 2)。溶解曲线条件为:95℃,65~95℃,增量0.5℃。每次实验取3个平行。1.4 数据分析
实验结果以实验平均值±标准差(SD)的形式表示,用EXCEL,SPSS和GraphPad 9软件对实验数据进行分析,分析结果显著性以*:P<0.05表示。
2 结果与讨论
2.1 细胞活力测定和UVB照射
对细胞给予不同浓度的乳源肽,来测定乳源肽对细胞的毒性作用。如图1所示,与多肽浓度为0 mg/mL的对照组相比,乳源肽在0.5~2.5 mg/mL的范围内,对于细胞增殖均无明显的抑制作用,其中0.08 mg/mL和0.1 mg/mL的乳源肽对细胞增殖均有显著性的促进作用。这与本实验室之前乳源肽相关实验结果一致[17],说明乳源肽在0.1 mg/mL的添加量以下对细胞增殖有较好的促进作用,因此选用0.08 mg/mL和0.1 mg/mL的乳源肽进行功效实验。

图1 乳源肽浓度对细胞活力的影响
为确定合适的UVB辐照剂量,对HFF-1细胞分别进行1.2、2.4、3.6、4.8 J/cm2剂量的照射。24 h后的细胞活力测定结果如图2所示。结果表明,当紫外辐照计量达到3.6 J/cm2时,对细胞增殖有显著性抑制作用,可显著降低细胞活力,而当辐照剂量为2.4 J/cm2时,对细胞活力无显著性影响。因此,选用3.6 J/cm2的紫外辐照强度用于测定预给予乳源肽对UVB照射后的细胞活力的影响,选用2.4 J/cm2的紫外辐照强度用于预给予乳源肽对UVB损伤细胞的抗光老化影响研究。

图2 紫外辐照剂量对细胞活力的影响
用3.6 J/cm2的紫外辐照强度测定预给予0.08 mg/mL和0.1 mg/mL的乳源肽对UVB照射后的细胞活力的影响,同时选用棕榈酰五肽-4作为阳性对照。棕榈酰五肽-4能很好地促进胶原蛋白的合成,具有抗皱效果,其商品名为Matrixyl,目前已广泛的用于抗皱化妆品中[18]。结果表明,如图3所示,UVB(3.6 J/cm2)照射后的细胞较未被照射的细胞活力均有下降,而预给予乳源肽和棕榈酰五肽-4的细胞相较于阴性对照组来说,其细胞活力均有增长,但都没有显著性差异,说明乳源肽对于UVB照射的细胞活力无显著影响,且会一定程度的促进细胞活力的增长。

图3 预给予乳源肽对紫外损伤细胞的细胞活力影响
2.2 乳源肽可抑制ROS的生成
炎症反应和ROS的产生是导致光损伤主要原因[19]。ROS的产生会对下游多个信号通路产生影响,如MAPK信号通路,TGF-β/SMAD信号通路等,对信号通路中的多种衰老因子,如JNK,p38,NF-kB,TGF-β产生影响。最终导致细胞内抗氧化酶的效率降低,抗氧化物质的减少,导致DNA损伤的累积,并对胞外基质产生影响[4,20-21]。研究表明,对于紫外诱导的小鼠细胞来说,在紫外照射后1 h内会有明显的变化,在辐照后25 min内ROS含量会显著性的增高,25 min后逐渐下降并恢复到正常水平[5]。
因此,ROS在紫外辐照导致的光老化中发挥巨大的作用,可用于探究乳源肽对于抗光老化的效果。如图4所示,在2.4 J/cm2的亚细胞毒性剂量下分别测定了紫外照射后12 h和24 h的ROS产量,结果表明在紫外照射12 h后,经紫外照射后的细胞内ROS呈极显著的升高(P<0.001),而预给予乳源肽组及阳性对照组都呈现极显著性的降低,其中预给予0.08 mg/mL的乳源肽相较于0.1 mg/mL的乳源肽添加量效果更为显著;在紫外照射24 h后,实验组与阴性对照组细胞内的ROS都逐渐趋于正常生长的细胞水平,说明对于紫外照射的细胞来说,ROS含量会显著升高并在24 h后恢复正常,而预给予乳源肽的细胞会在细胞接受紫外照射时起到修复作用,防止ROS的升高。说明在紫外照射前预先添加乳源肽有助于紫外损伤的细胞内ROS的清除,并降低ROS的产量,有效防止紫外辐照所导致的氧化损伤。
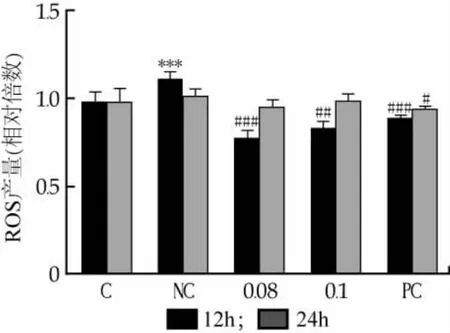
图4 乳源肽对紫外诱导的ROS产量的影响
2.3 乳源肽可抑制紫外照射的细胞中β-半乳糖苷酶活性
正常体细胞在培养过程中在经过有限数量的细胞分裂后,即进入不可逆的衰老阶段[22]。而β-半乳糖苷酶是测定衰老细胞的常见指标,其主要以pH为6.0时细胞内的β-半乳糖苷酶活性为衰老指标,细胞老化越严重,β-半乳糖苷酶活性就越高[23]。β-半乳糖苷酶试剂盒可使衰老细胞呈深蓝色,即阳性,在普通光学显微镜下即可观察。该指标在多个研究中被用于判断细胞衰老情况[24-25]。
如图5所示,乳源肽组可明显抑制紫外照射后的细胞衰老,对于紫外照射的细胞,其β-半乳糖苷酶阳性细胞的比例是对照组的3.29倍,而乳源肽组和阳性组的阳性细胞都出现了显著性的降低,说明预给予乳源肽可能会有效延缓紫外照射所导致的细胞衰老现象。

图5 β-半乳糖苷酶活性及阳性细胞比例
2.4 预给予乳源肽可抑制MMP-1的分泌,促进I型胶原蛋白的合成
细胞经一定程度的紫外照射后,会产生细胞损伤,而损伤累积到一定程度时,便会出现衰老现象,产生一系列衰老相关的分泌表型(SASP,senescenceassociated secretory phenotype),包括一些细胞因子,生长因子和基质金属蛋白酶等[26]。同时,早有研究表明紫外辐照引起的光老化会导致胶原蛋白、弹性蛋白等胞外基质的减少,从而产生皱纹,阻碍伤口的愈合[27]。
为研究乳源肽的抗光老化效果,用ELISA方法测定了不同处理方式的细胞其MMP-1和I型胶原蛋白的分泌量。如图6(a),在紫外照射后24 h,经紫外照射的细胞(NC)相较于未受紫外照射的对照组细胞(C),其MMP-1的分泌量有极显著的升高,是对照组的1.76倍,而预给予不同浓度的乳源肽及阳性对照组相较于阴性对照组都有极显著的下降,预给予0.08 mg/mL和0.1 mg/mL的乳源肽组分别下降了30.38%和27.42%。而图6(b)的结果显示,细胞经紫外照射后,其I型胶原蛋白的分泌量会显著下降,而实验组和阳性对照组都很好地抑制了I型胶原蛋白的降解,相较于阴性对照组其分泌量有极显著的升高。图6的实验结果表明,紫外照射会诱导细胞内MMP-1的分泌增多,从而导致I型胶原蛋白的降解,而乳源肽能够很好地抑制MMP-1的分泌,从而防止I型胶原蛋白的降解。

图6 乳源肽对紫外诱导的细胞中MMP-1及I型胶原蛋白分泌量的影响
为进一步验证预给予乳源肽抗光老化的效果及对MMP-1的调控,分别提取了最后一次UVB照射后12、24 h细胞内的RNA进行RT-qPCR实验以测定细胞内MMP-1及I型胶原蛋白的mRNA表达情况。如图7(a)所示,紫外照射后的细胞在照射后24 h内MMP-1的表达量均呈现极显著的升高,其中在照射后12 h的表达量是照射后24 h的1.5倍,而经乳源肽处理后的细胞与阴性对照组相比显著的抑制了MMP-1的表达。相应的,图7(b)的结果显示,经紫外照射的细胞在照射后24 h I型胶原蛋白的mRNA表达量出现显著性下降,而经乳源肽处理后的细胞在24 h内I型胶原蛋白的mRNA表达量均出现显著性的升高,且出现表达量随时间的增长而降低的趋势。说明乳源肽通过调控MMP-1和I型胶原蛋白mRNA的表达来控制其分泌,可抑制紫外照射细胞中MMP-1的表达,并且促进I型胶原蛋白的表达。而乳源肽对MMP-1基因的下调可能与ROS含量的降低有关。

图7 乳源肽对紫外诱导的细胞中MMP-1及I型胶原蛋白mRNA表达量的影响
之前研究表明,紫外引发的DNA氧化损伤会导致NF-κB的激活[28]。而很多细胞因子其基因的启动子或增强子部位都存在可与NF-κB结合的位点,NFκB的激活会导致炎症反应与光老化,其中涉及炎症因子TNF-α,IL-6 and IL-10与光老化相关基质金属蛋白酶MMP-2 and MMP-9的调控[29]。同时,研究表明在成纤维细胞与U937巨噬细胞的共培养体系中,成纤维细胞分泌的IL-6细胞因子会对U937巨噬细胞分泌MMP-1产生影响[30]。由于紫外照射会诱导炎症因子,如IL-6的表达,IL-6会继而诱导MMP-1的表达[31]。同时,对于紫外损伤的修复也有可能通过对损伤细胞DNA的修复来调控MMP-1的表达以及防止MAPKs的磷酸化[32]。另外紫外诱导的ROS的产生,会促进MAPK信号通路的磷酸化,继而诱导下游激活蛋白(AP-1)的生成,AP-1能通过上调MMP-1的表达来降低I型胶原蛋白的含量,并且抑制转化生长因子TGF-β1的表达[33],而TGF-β1可促进胶原蛋白的合成[34]。因此本实验中乳源肽对MMP-1调节可能是ROS及炎症因子调控的结果,对I型胶原蛋白的调节可能与TGF-β1有关。
3 结束语
本实验通过HFF-1细胞探究了预给予乳源肽对紫外损伤细胞的抗光老化效果。结果表明,在细胞经多次紫外照射后,会产生衰老现象,添加一定浓度的乳源肽会有效防止细胞的老化,0.08 mg/mL和0.1 mg/mL的乳源肽均能有效抑制紫外照射细胞内ROS的升高,通过控制MMP-1的基因表达来抑制MMP-1的分泌,从而减少对胶原蛋白的降解,同时乳源肽可促进I型胶原蛋白的表达和分泌,与未处理过的紫外损伤细胞相比,其含量显著升高。本研究为乳源肽在化妆品行业的应用奠定了基础,而其相关的具体机制通路还有待探究。
