基于G-四链体/硫黄素T的荧光生物传感器检测Pb2+
2022-07-23黄伟华廖世琪赵一炜许惠凤
黄伟华, 胡 筱, 廖世琪, 赵一炜, 许惠凤*, 朱 希
(1.福建中医药大学药学院,福建福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建中医药大学中西医结合研究院,福建福州 350122;3.福建农林大学生命科学学院,福建福州 350002)
随着现代化工业进程的加快,铅已成为生态环境中的主要重金属污染物之一,经土壤种植收获的植物类药材也因此常受其扰[1]。铅污染会对人类的造血功能、神经系统和肾脏造成慢性损害,严重者还会出现铅中毒脑病[2]。因此,对药材中Pb2+含量的测定具有十分重要的意义。迄今为止,研究人员已经开发了许多Pb2+的检测方法,如原子吸收光谱法[3]、电感耦合等离子体质谱法[4]、原子荧光光谱法[5]等。这些方法相对成熟可靠,但受仪器条件限制,不能满足现场快速检测的实际需求。近年来,利用功能型核酸探针构建简便型生物传感器,在Pb2+检测方法受到人们的广泛关注。其中,最具代表性的是通过指数富集的配体系统进化技术(Systematic Evolution of Ligands by Exponential Enrichment,SELEX)筛选得到的寡核酸片段DNA核酶(DNAzyme),该酶以Pb2+作为辅因子来催化切割断裂特定的底物链[6]。不少研究者利用这一特性实现了对Pb2+的灵敏检测[7,8]。然而,底物链通常包含切割位点核糖腺苷(rA),该结构不稳定,极易水解,对检测溶液环境要求较为苛刻,在一定程度上限制了其应用。另一种代表性功能核酸是富含鸟嘌呤的核苷酸片段,俗称富G序列。它位于真核细胞染色体的末端,同时也在一些重要的原癌基因的启动子区和未翻译的mRNA中分布广泛[9,10]。在这类核苷酸片段中,四个G碱基通过氢键形成环状平面,两个以上的这些环状平面通过π-π作用堆积形成G -四链体(G4)。一些金属离子(如K+、Pb2+、Tb3+)[11-14]和小分子化合物(如Hemin)[15]可以促进G4的形成。Hemin不仅可以稳定G4结构,还能帮助G4增强类过氧化物酶的催化性质[16,17]。Pb2+可以缩短Pb-O键和O-O键,使得到的G4的结构更稳定。然而以Pb2+为中心的这种G4结构则会抑制其原先的催化活性[18]。这种催化活性的改变,使得G4联合Hemin的传感策略可以用于Pb2+的检测[6]。不过由于Hemin本身对H2O2具有催化作用,采用这种方法除了对Hemin的用量要求比较严格,而且背景信号也相对偏高。
硫黄素T(Thioflavin T,ThT)分子由一个苄胺环和一个苯硫醚环组成,这两个环可以围绕C-C键自由旋转,导致ThT在自然状态下荧光信号很弱。而当这种旋转受到某些特殊结构的限制时,ThT的荧光就会被增强。近年来,研究发现ThT能够特异性结合G4,结合后其荧光强度得到极大增强[19 - 21]。本工作利用Pb2+与ThT之间对G4中心的竞争关系,构建了一种基于G4-ThT的荧光传感器用于Pb2+的检测。当Pb2+存在时,其可帮助G4形成更稳定的结构,故而通过竞争作用将ThT从G4中心释放出来,引起体系荧光强度的下降,可以实现对Pb2+的超痕量检测。
1 实验部分
1.1 仪器与试剂
荧光光谱仪(F-4500,日本日立公司);pH计(pHS -3C,上海越平科学仪器有限公司);数控超声波清洗器(KQ5200B,昆山市超声仪器有限公司);干式恒温器(Bionoon-101G,上海般诺生物科技有限公司)。所有光学测量均在室内环境条温度件下操作;所有荧光测量均在统一的石英比色皿中操作。
寡核苷酸序列购自上海生物工程有限公司,序列为:5′-AGG GTT AGG GTT AGG GTT AGG G -3′,使用时未经特别纯化;硫黄素T(ThT)、三羟甲基氨基甲烷(Tris)、Pb(NO3)2等试剂购自国药集团化学试剂有限公司,均为分析纯;金属离子溶液均以它们的硝酸盐按常规法配制。实验用水为超纯水(18.2 MΩ·cm)。
1.2 实验方法
1.2.1 G4-ThT混合溶液的配制将装有G4寡核苷酸序列冻干粉的EP管以10 000 min离心5 min,轻轻加超纯水配成浓度为1 μmol/L的母液并混合均匀,随后在干式恒温器中于95 ℃下加热5 min进行解链。待其冷却至室温,取一支EP管,加入178 μL 0.1 mol/L Tris-HCl缓冲溶液(pH=7.0,含0.1 mol/L KCl),2 μL的ThT溶液,最后加入20 μL G4溶液混合,使G4最终浓度为100 nmol/L。
1.2.2 Pb2+的荧光检测往上述G4-ThT溶液(分别含有100 nmol/L G4和20 μmol/L ThT)中加入2 μL 不同浓度的Pb2+标准溶液,充分振荡3 min后进行荧光检测。荧光测试条件:激发波长为425 nm,发射波长扫描范围450~600 nm,激发/发射狭缝宽度均为5 nm。
1.2.3 样品前处理中药材独活经粉碎研磨后,精密称取0.5 g,置于四氟乙烯消解罐中,加5 mL HNO3,混匀,浸泡过夜后,置于微波消解炉内进行消解。待消解完全,加热消解罐至红棕色气体挥尽且溶液体积约为2 mL。将冷却后的溶液用超纯水转至25 mL容量瓶中定容。加标试样的制备是先将定量的Pb2+标准溶液与样品粉末一并加入消解罐中,随后同法进行样品处理。
2 结果与讨论
2.1 检测原理
利用Pb2+与ThT之间对G4的竞争作用,构建检测Pb2+的荧光传感器的检测原理如图1所示。在Tris-HCl缓冲溶液中,富G碱基的寡核苷酸片段自发折叠成非常稳定的反平行G4的空间构型。与此同时,溶液中的ThT也随之嵌入到该G4结构中。由于嵌入后ThT结构中连接苄胺环和苯硫醚环的C-C键旋转自由度受到G4结构的束缚,刚性结构得到增强,从而增强了其荧光信号值。而该反平行结构的G4结构也能够结合Pb2+,所以当溶液中存在Pb2+时,Pb2+会将ThT从该G4结构中竞争出来,从而导致体系荧光下降,因此,通过体系荧光强度的改变可以实现对Pb2+的检测。

图1 利用G4-ThT检测Pb2+的原理图Fig.1 Schematic diagram for the detection of Pb2+ with G4-ThT
2.2 可行性分析
实验首先对传感器的可行性进行了研究。在图2中,曲线a是G4-ThT在Tris-HCl缓冲溶液中的荧光光谱,此时体系的荧光非常强,这是由于ThT中的苄胺环和苯硫醚环转动受到了G4的束缚。而往该溶液体系中加入500 nmol/L的Pb2+后,可以发现荧光强度明显降低(图2曲线b)。其主要原因是Pb2+将ThT从G4结构中竞争出来,使得ThT中的苄胺环和苯硫醚环又能够自由地围绕C-C键自由旋转,从而使分子荧光受到抑制。该体系荧光降低程度与Pb2+浓度相关,因此可用于Pb2+的检测。
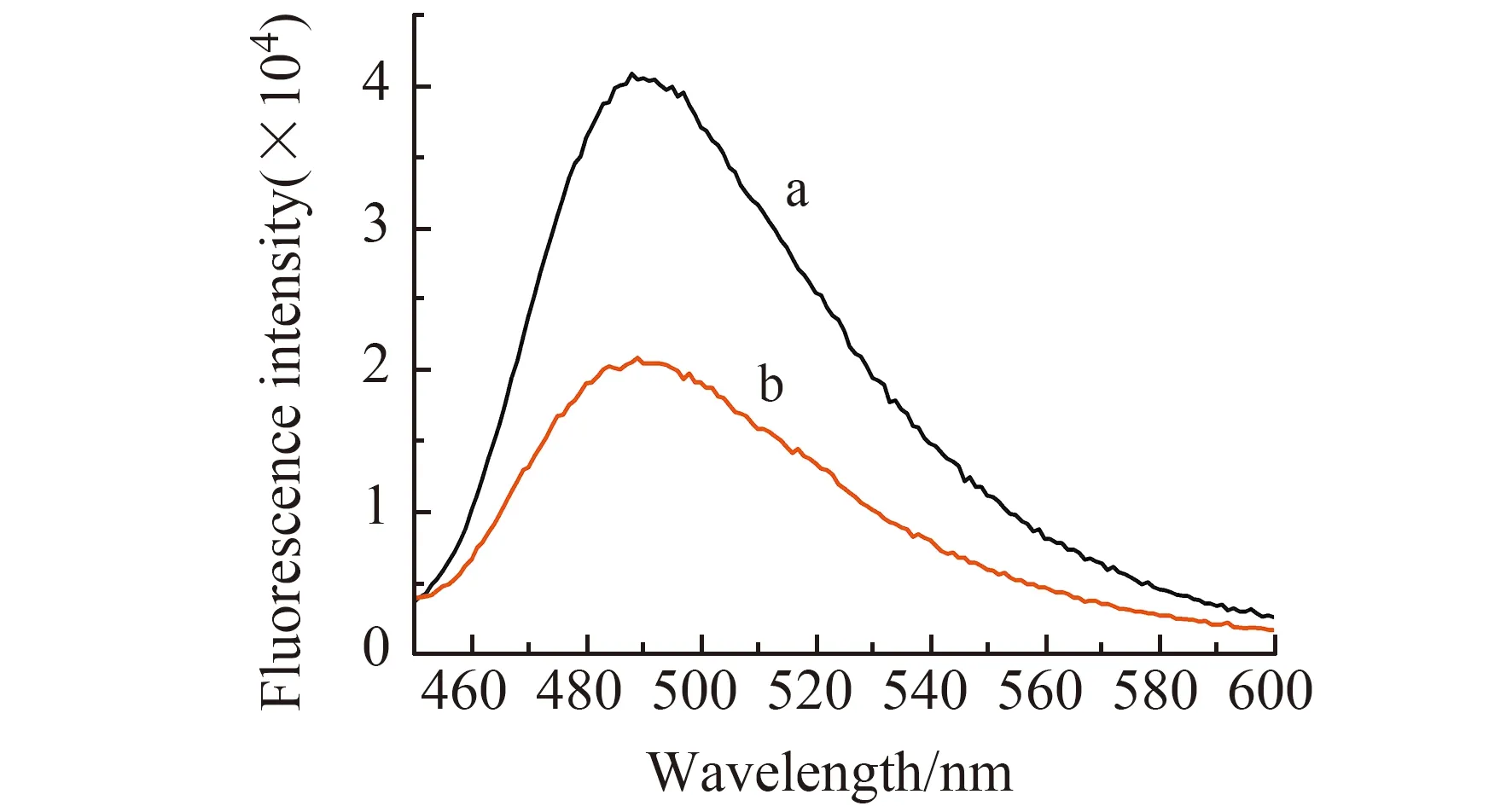
图2 加入Pb2+前(a)后(b)G4-ThT体系的荧光光谱图Fig.2 The fluorescence spectra of G4-ThT before(a) and after(b) addition of Pb2+
2.3 实验条件的优化
2.3.1 ThT与G4反应时间及ThT浓度实验首先考察了ThT与G4的作用时间及ThT的浓度对体系荧光强度的影响,结果如图3所示。从图3(A)可以看出,在开始的10 min内,体系的荧光信号强度随着反应时间的延长而逐渐增大,在10 min后荧光信号达到稳定值,且不再随着时间的延长而发生明显变化。实验进一步在固定反应时间为10 min的条件下,考察ThT浓度的影响。从图3(B)可见,随着ThT浓度增大,体系的荧光强度逐渐增强,当ThT浓度为20 μmol/L时,荧光达到最大值。因此,在随后的实验中ThT浓度均采用20 μmol/L。

图3 (A)ThT与G4不同作用时间下的荧光强度;(B)不同ThT浓度存在时的荧光强度Fig.3 (A) The fluorescence intensity under different reaction time between ThT and G4;(B) The fluorescence intensity under different ThT concentrations
2.3.2 Pb2+与G4-ThT体系的反应时间实验进一步考察了Pb2+与G4-ThT体系反应时间与荧光强度的关系,结果如图4所示。随着反应时间的增加,荧光强度逐渐减弱,表明体系中ThT Pb2+所取代,逐渐从体系中释放出来。当反应时间为5 min,荧光强度降低了86.3%,而时间继续延长,荧光强度几乎未出现明显的改变,表明此时的竞争反应达到平衡。因此,Pb2+与体系的反应时间选定为5 min。

图4 不同反应时间下的荧光强度Fig.4 The fluorescence intensity under different reaction time
2.4 线性范围及检测限考察
在上述实验得出的最优条件(即反应时间为5 min,ThT的浓度为20 μmol/L)下,研究了不同浓度的Pb2+对体系荧光强度的影响。从图5(A)中可以看出,随着Pb2+浓度的增加,荧光强度逐渐降低。Pb2+的浓度在5~1 000 nmol/L范围时,其浓度的对数与荧光强度呈现良好的线性(图5(B)),线性方程为:F=41 891-8 935lgc(R2值为0.9910)。当信噪比为3时,该方法对Pb2+的检测限达到1.6 nmol/L。

图5 (A)不同浓度的Pb2+存在时的荧光光谱图;(B)线性曲线Fig.5 (A)The fluorescence spectra under different concentrations of Pb2+ ;(B)The linear relationship
该方法与已报道的方法对比如表1所示。从表中可以看出,与已报道的一些方法相比,本方法具有比较高的检测灵敏度和宽的线性检测范围。

表1 本方法与已报道方法对比情况表
2.5 选择性
以几种常见金属离子为干扰离子,如Mn2+、Ca2+、Ba2+、Na+、Mg2+、Zn2+,考察体系对于这些干扰离子的响应情况,这些金属离子浓度均为20 μmol/L,而Pb2+的浓度为1 μmol/L。结果如图6所示(纵坐标ΔF代表体系的荧光变化值,ΔF=F0-F,其中F0和F分别为加入金属离子前后体系的荧光值)。从图中可以看出,当高浓度的干扰离子存在时,体系的荧光强度变化几乎不明显,然而Pb2+存在时,却引起荧光强度的急剧变化。这表明该体系对Pb2+有较好的选择性。

图6 不同离子存在下的荧光强度变化值ΔFFig.6 The change of fluorescence intensity ΔF in the presence of different ions
2.6 实际样品检测
实验考察了该荧光传感器用于中药材独活提取液中Pb2+的检测(样品前处理见“1.2.3”,并按“1.2.2”的步骤对其进行检测)。由于样品中的Pb2+含量实际未检出,故进行了加标回收实验,检测结果如表2所示。从表中可以看出,利用该荧光传感器检测提取液中的Pb2+,其回收率在86.5%~107.4%范围,表明该方法可以用于实际样中Pb2+的测定。
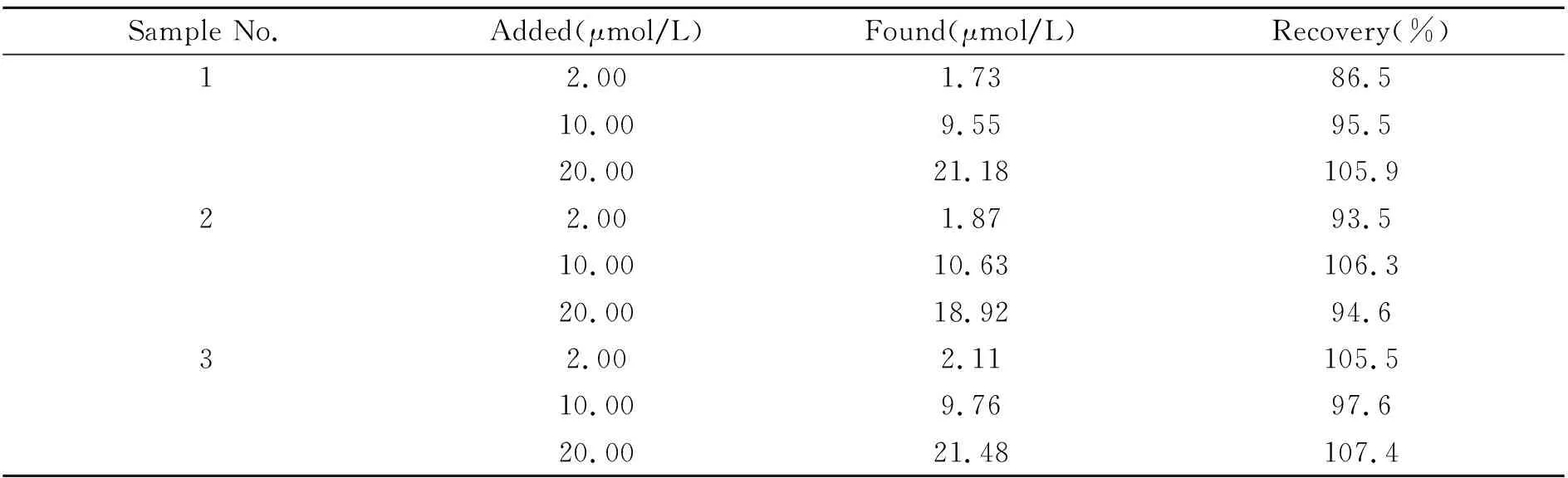
表2 加标回收实验
3 结论
本文利用G -四链体为载体,以ThT作为嵌入剂,构建了一种基于竞争原理的荧光生物传感器用于Pb2+的检测,并用于中药材独活实际样品中Pb2+含量的测定。该方法操作相对简便快速,且具有比较高的灵敏度和选择性,有望用于实际样品中Pb2+含量的快速检测。
