鸡源Cathelicidins家族抗菌肽研究进展
2022-07-23彭练慈田洪亮陈红伟方仁东西南大学动物医学院重庆北碚400715
彭练慈,芦 懿,田洪亮,陈红伟,叶 超,方仁东 (西南大学 动物医学院,重庆 北碚 400715)
随着全球多重耐药菌株的日益增加,能有效控制感染的抗生素急剧减少。此外,许多慢性炎症性疾病的常用治疗方法(如皮质类固醇)会增加感染的风险及产生具有耐药性的顽固性病原体[1]。因此,迫切需要开发既可以杀死病原菌又可以解决有害炎症的新型抗菌药物。宿主防御肽(host defense peptides,HDPs)作为宿主自身分泌的小分子多肽,广泛分布于不同动物体内,具有广谱的抗菌活性[2]。
抗菌肽主要通过诱导细胞膜的极化导致菌体破裂而发挥作用,由于不涉及其他靶标,因此不易产生细菌耐药性,在新型抗菌药物的研发领域具有很大的优势和潜力。CATHs家族的抗菌肽作为宿主防御肽中的重要抗菌肽家族,除了具有更广谱高效的抗微生物活性,还具有低细胞毒性、低溶血、抗肿瘤、抗炎、抗氧化、促进伤口愈合和免疫调节等多种重要活性[3-4],在新型抗感染及免疫调节药物的研发领域具有巨大的潜力。
在所有CATHs生物活性的研究中,人源CATH (LL-37)的研究最为广泛。近年来,牛、马、猪等哺乳动物CATHs的生物活性也受到兽医领域研究者的广泛关注[5-8],但是关于鸡源CATHs的报道并不多。自2006年和2007年相继发现鸡体内的CATHs后,近十几年来,鸡源CATHs的研究也取得了一定的进展,其生物活性也在逐步被挖掘。现对鸡源CATHs结构与活性的关系、分布与表达、抗微生物活性、免疫调节活性等方面进行综述,并对其应用前景进行综合分析。
1 鸡源CATHs结构与活性的关系
迄今为止,鸡CATHs包括fowlicidin-1 (cathelicidin-1,CATH-1)、fowlicidin-2 (cathelicidin-2,CATH-2 )、 fowlicidin-3 (cathelicidin-3,CATH-3)和cathelicidin-B1 (CATH-B1)[9-10]。
CATHs 的前体由N-端信号肽区域(29~30 aa)、中间保守cathelin区域(94~114 aa)和高度特异的C-末端成熟肽区域 (12~100 aa)构成[3]。编码C-末端成熟肽区域的序列具有多样性,导致形成不同长度、不同电荷密度和结构差异的成熟抗菌肽。所有CATHs都带正电荷,使CATHs可以和带负电荷的细菌细胞膜相互作用,从而发挥抗菌活性,且不易产生耐药性。
CATH-1、CATH-2和CATH-3具有α-螺旋结构,都是由中间的铰链区域将C-末端的α-螺旋结构和N-末端的氨基残基连结而成[11-13]。XIAO等[11]研究表明fowlicidin-1的α-螺旋结构包含的8个氨基残基与其抗菌、溶血及中和LPS活性紧密相关。BOMMINENI等[14-15]证实fowlicidin-1在体内外均具有广谱抗菌活性及免疫调节活性。fowlicidin-3的α-螺旋结构功能区是由第17 位甘氨酸扭结连结9~25位的氨基残基构成[12],具有广谱抗菌活性,但是QU等[16]研究表明,fowlicidin-3中间铰链区(-AGIN-)并无抗菌活性,反而能增加溶血活性和细胞毒性。与fowlicidin-3相反的是,XIAO等[13]和VAN DIJK等[17]研究表明,CATH-2的铰链区域(氨基残基13~20)对其抗菌活性和免疫调节活性具有重要作用。这些研究结果说明抗菌肽的结构对其功能的发挥起了关键性的作用,抗菌肽结构与活性关系的研究对于优化抗菌肽序列、增强生物活性及抗菌肽的应用具有指导性的意义。与其他3种抗菌肽研究相比,关于CATH-B1的结构知之甚少,它的氨基酸序列已被预测,但分子构象尚未确定[10]。PENG等[18-19]最新的研究表明CATH-B1具有良好的抗病毒及免疫活性,但是它的结构与活性的关系还有待进一步研究。
2 鸡源CATHs的分布与表达
CATHs在上皮细胞、黏膜表面和皮肤少量表达,主要是由中性粒细胞和单核吞噬细胞释放。首先以失活的前体形式储存在粒细胞的分泌颗粒中,当机体受到病原微生物入侵时,被弹性蛋白酶切割为成熟的抗菌肽释放到机体中进而发挥生物学功能。VAN DIJK等[20]和SEKELOVA等[21]分别通过抗体及液相色谱-质谱法检测到CATH-1、CATH-2和CATH-3蛋白均在异嗜性粒细胞中表达,类似于人源CATH (LL-37)在中性粒细胞中大量表达[22],分布于机体的全身。GOITSUKA等[10]发现CATH-B1蛋白在法氏囊的上皮细胞中表达,值得一提的是,此上皮细胞是病原入侵粘膜淋巴组织的主要靶标,说明CATH-B1在法氏囊抵御病原入侵中起到了重要作用。但是,目前并未检测其他组织是否有CATH-B1蛋白的表达,因此它的表达分布还需进一步的研究。
鸡CATHs基因在机体中的表达更为广泛,主要是在皮肤、呼吸道、胃肠道和淋巴器官中表达[23]。与蛋白表达类似,CATH-1、CATH-2、CATH-3的mRNA在骨髓细胞中大量表达,而CATH-B1 mRNA在法氏囊中大量表达[10]。有趣的是,CATH-2 mRNA也在(禽尾部)油脂腺中表达,脂腺分泌物中含有抗菌物质,这些抗菌物质可以转移到皮肤并防止感染[24]。此外,4种CATHs mRNA在胚胎时期就开始表达[25-26],之后在发育成熟的早期,在肺脏、法氏囊、肠道等不同组织中表达量逐步上调[23],说明抗菌肽在体内的广泛分布对抵抗病原体的入侵起着重要作用。
鸡CATHs表达受体内外炎性或微生物刺激等多种因素的影响。VAN DIJK等[20]在感染肠炎沙门菌8 h后肉鸡空肠的异嗜性细胞中观察到大量的CATH-2。与沙门菌感染相反,空肠弯曲菌感染不会诱导募集异嗜性细胞到小肠,并且小肠中的CATH-2 mRNA表达在感染48 h后下调[27]。空肠弯曲菌也会下调CATH-1和CATH-3 mRNA表达,但是并不影响CATH-B1 mRNA表达[28]。PENG等[18]最新的研究发现,禽致病性大肠杆菌(APEC)感染巨噬细胞(HD11和原代单核细胞分化的巨噬细胞)可诱导CATH-B1 mRNA表达。这些研究结果表明,不同的病原感染可诱导不同种类抗菌肽的表达,抗菌肽的表达有助于宿主抵御病原的感染,但是抑制抗菌肽的表达可能也是病原逃逸宿主清除的机制之一。
维生素D和短链脂肪酸可诱导不同细胞表达LL-37,近期研究结果表明,它们也可诱导鸡CATHs的表达。RODRIGUEZ等[29]发现饲喂维生素D可增加鸡脾脏CATH-1和CATH-B1的表达水平。SUNKARA等[30]发现短链脂肪酸(丁酸盐)在巨噬细胞HD11中诱导CATH-B1的表达,口服丁酸盐可诱导鸡空肠和盲肠外植体CATH-B1的表达,而且经丁酸盐处理后的巨噬细胞具有更好的抗菌能力。人源CATHs被维生素D和短链脂肪酸诱导表达的机制已经被广泛研究,目前诱导其它动物源CATHs表达的机制并不清楚,这也是鸡源CATHs研究的空白之一,但是寻找高效诱导CATHs表达的化合物是宿主抵御病原侵入的有效途径之一,也是减少或替代抗生素使用的有效途径之一。
3 鸡源CATHs的抗微生物活性
抗菌活性是抗菌肽最经典的功能之一(图1),CATH-1、CATH-2、CATH-3均具有广谱的抗菌活性,对金黄色葡萄球菌、大肠杆菌、沙门菌、肺炎球菌、绿脓杆菌以及一些耐药菌株等均具有良好的抗菌作用,其最小抑菌浓度(MIC)可低至0.4 μmol/L[9,12]。CATH-B1与其他3种抗菌肽相比,其抗菌谱较窄,对大肠杆菌、金黄色葡萄球菌和绿脓杆菌有效,当被测试的菌液浓度低至2×103CFU时,其MIC的范围是0.63~2.5 μmol/L[10],但是当菌液浓度提高至5×105CFU时,CATH-B1的MIC增加至12.5 μmol/L[31]。值得一提的是,大多数抗菌肽在生理环境中的抗菌活性降低,已成为抗菌肽应用的一大难题。VELDHUIZEN等[32]研究表明血清对CATH-1、CATH-2、CATH-3的抗菌活性并无太大影响,并且不会引起多重耐药菌的耐药性。除了在体外具有抗菌作用,抗菌肽在体内也具有抗感染活性。CUPERUS等[33]发现CATH-2对感染APEC的小鸡具有明显的保护作用,通过减少肺组织中的细菌感染量,最终降低了动物的死亡率。这些研究结果表明,鸡源CATHs具有被研制成为新型抗菌药物的潜力。
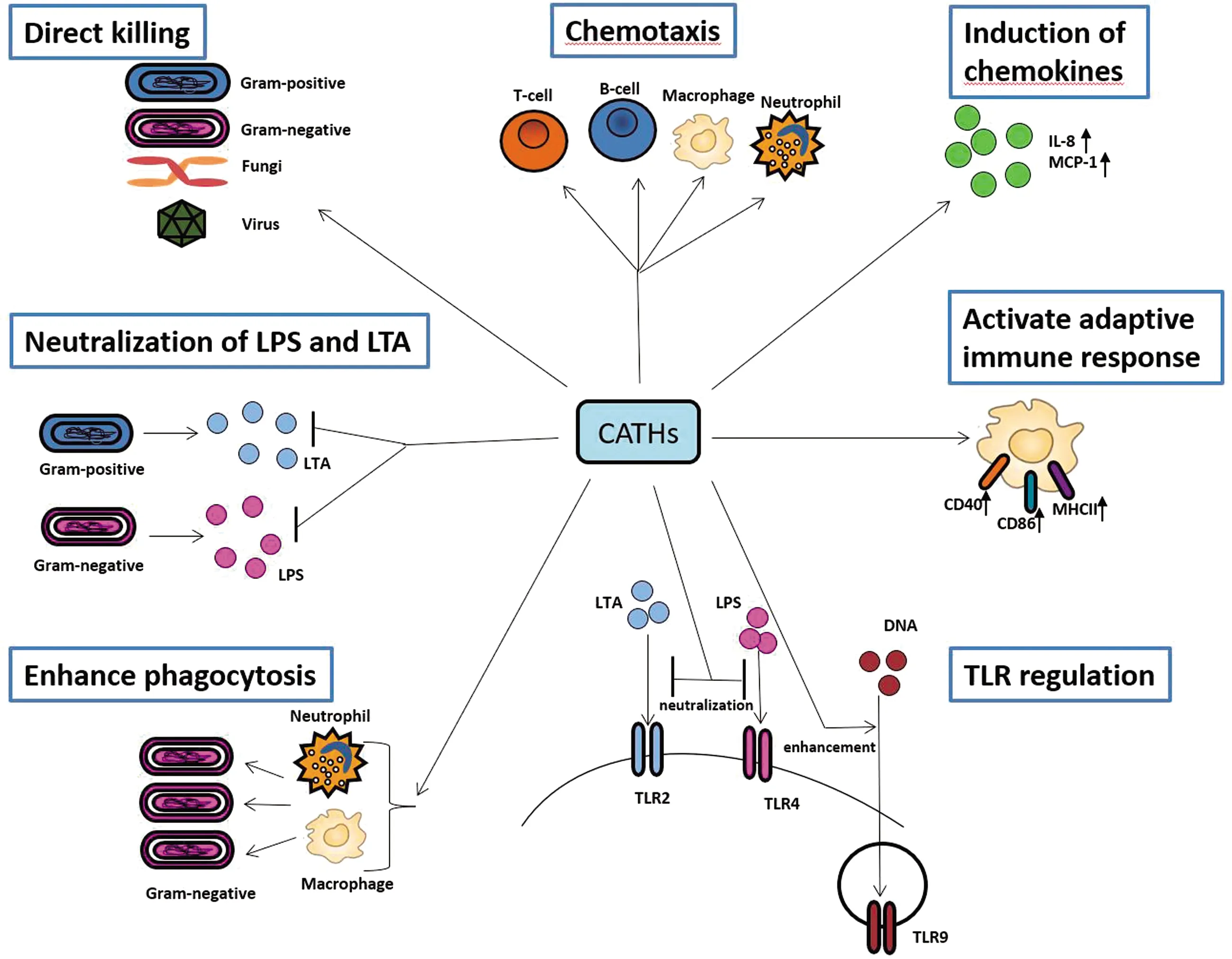
图1 鸡源CATHs的生物活性总结图
鸡源CATHs除了具有抗浮游菌活性外,MOLHOEK等[34]和CHEN等[35]研究表明CATH-2也可以抑制细菌生物被膜的形成。ORDONEZ等[36]报道CATH-2具有抗真菌活性,并且能在5 min内快速渗透进真菌细胞膜内。它们的抗菌机理主要是作用于细菌细胞膜,通过细菌细胞膜渗透进菌体内从而杀死细菌。有趣的是,SCHNEIDER等[37]发现CATH-2在低于MIC浓度下依然能渗透进菌体内阻碍细菌DNA和核糖体的合成,此外还会诱导细菌外膜囊泡的释放,这些由抗菌肽诱导形成的外膜囊泡为疫苗的研发提供了新的思路。
除了具有抗菌活性,鸡源CATHs在近期首次被报道具有抗病毒活性。PENG等[19]发现4种CATHs在体外均具有一定的抗流感病毒(IAV)活性,其中CATH-B1具有最好的抗病毒活性,主要通过干扰病毒表面蛋白血凝素活性从而抑制病毒与细胞结合,最终阻止病毒的入侵。由于CATH-B1蛋白在机体分布位置的特殊性,推测CATH-B1在法氏囊内具有特殊的抗病毒功能,例如抑制传染性法氏囊病毒(IBDV)的复制,但是此活性还需进一步的研究。
4 鸡源CATHs的免疫调节活性
人源CATH(LL-37)的免疫调节功能已经被广泛研究。LL-37可以抑制LPS诱导的免疫反应、调节免疫细胞的迁移分化和调控Toll样受体(TLRs)的激活。LL-37可以直接作用于类甲酰肽受体(FPRL1)诱导细胞的趋化,也可以作用于P2X7受体诱导炎症小体的激活。近期文献报道,LL-37通过诱导溶酶体释放组织蛋白酶B(cathepsin B)从而激活NLRP3炎症小体,最终导致IL-1β和IL-18的释放[38]。
鸡源CATHs与LL-37具有一些相似的功能活性(图1)。4种鸡源CATHs 都可以与LPS/LTA结合,抑制TNF-α、IL-1β、IL-8 和IL-6等炎性因子的产生[12,15,17-18,31]。BOMMINENI等[15]研究表明CATH-1在体外能直接诱导巨噬细胞的活化,增强细胞因子、细胞标志物CD86和MHC-Ⅱ的表达。KRAAIJ等[39-40]研究发现,CATH-2也可以增加巨噬细胞表面的CD86、MHC-Ⅱ、MRC1、CD40等抗原递逞受体的表达,也可以影响T和B细胞标志蛋白的表达。CATH-2也可以直接刺激细胞产生巨噬细胞趋化蛋白-1(MCP-1)[17]。研究发现,CATH-B1可以增强巨噬细胞对细菌的吞噬能力[18]。这些研究表明抗菌肽对先天和后天免疫均具有重要作用,而且可能通过作用于细胞内的受体从而发挥免疫调节作用。
在4种鸡源CATHs免疫调节活性机制的研究中,CATH-2的研究最为广泛。COORENS等[41-42]研究表明,CATH-2可以通过与病原的相互作用抑制TLR2和TLR4的活化,还可以与DNA结合,增强细胞对DNA的吞噬,从而增强DNA介导的TLR9的激活,但是目前尚不清楚与CATH-2直接作用的胞内具体受体分子。以后的研究可以通过单细胞测序的技术筛选出CATH-2在胞内的靶向受体分子,为抗菌肽作为免疫调节药物的研发奠定基础。
5 鸡源CATHs应用前景分析
由于CATHs家族抗菌肽具有广谱的抗菌活性,最初的研究都专注于开发抗菌肽成为新型抗菌药物,但是近十几年的研究发现抗菌肽对于机体的免疫起着至关重要的作用。目前,鸡源CATHs被发现具有抗炎、增强抗原呈递及吞噬活性、正向调控获得性免疫等功能(图1)。因此,在针对各种临床感染疾病的药物研发背景下,开发抗菌肽作为抗感染及免疫调节药物缓解慢性疾病诱导的炎症等具有良好的前景。最近,CATHs的外源性给药已被用于多种动物感染模型,例如,LL-37能保护小鼠免受铜绿假单胞菌、流感病毒的感染[43],卵内注射 CATH-2 可保护鸡呼吸道抵御大肠杆菌感染[33]。除此之外,PENG等[44]最新的研究表明,猪源抗菌肽与IL-4/6联合形成的壳聚糖纳米颗粒增强了小鼠的免疫保护作用。这些研究都说明抗菌肽具有开发成为抗感染药物的巨大潜力,为兽医临床实现“减抗、替抗、协抗”提供科学的理论依据。值得注意的是,目前已有少数的抗菌肽处于临床测试中,例如LL-37用于临床治疗下肢静脉溃疡[43],这些测试为抗菌肽应用于兽医临床提供了参考依据。
不可避免地,CATHs抗菌肽的临床应用依然面临在体内易降解、制剂难成形、合成成本高等挑战。但是随着抗菌肽的广泛研究,可以通过合成D型氨基酸肽、乙酰化或酰胺化修饰肽链、有针对性的替代非必须氨基酸等方法增加抗菌肽的稳定性[45]。CUPERUS等[33]通过合成D型CATH-2提高了抗菌肽在体内的稳定性,从而使其高效地发挥抗菌活性。也可以利用材料工程技术和体内追踪技术,建立把抗菌肽包裹在可降解高分子材料中心的制备方法,通过调节载体材料的亲水疏水性及分子量,调控抗菌肽的释放时间,有效的解决抗菌肽在体内易降解及作用时间短的难题,提高抗菌肽在体内的利用效率。PENG等[46]通过使用纳米粒子材料靶向运输抗菌肽或减缓抗菌肽在体内的释放,从而提高抗菌肽抗菌能力。还可以通过筛选出促进抗菌肽表达的化合物,基于这些化合物的饲料添加剂可以有效地刺激抗菌肽表达从而提高动物的免疫保护作用,最终相对降低抗菌肽的合成成本[29]。虽然鸡源CATHs的应用还处于初级阶段,但是其功能研究已经取得了较大的进展,鸡源CATHs广谱高效的抗菌活性和免疫调节活性已经在兽医领域展示了一定的应用前景。此外,近年来材料学科的迅速发展,不同学科之间的交叉融合,也将为抗菌肽的临床应用提供坚实的基础。
