非洲猪瘟流行病学及诊断技术研究进展
2022-07-23张交儿仇华吉罗玉子中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室黑龙江哈尔滨150069
宋 浩,张 丽,张交儿,仇华吉,罗玉子 (中国农业科学院 哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
非洲猪瘟(African swine fever,ASF)是由ASF病毒(ASFV)引起的一种猪急性、热性、广泛出血性传染病,病死率高达100%[1]。鉴于ASF对国家生猪生产及其相关产业的严重危害,世界动物卫生组织(OIE)将其列为法定报告动物疫病,我国将其列为一类动物传染病。该病可以通过多种途径传播,如通过感染的家猪、野猪、软蜱、猪肉及其制品、受污染的车辆、人员、设施等传播到其他地区[2-3]。ASFV感染猪可能表现出高热、沉郁、厌食、皮肤发绀、呕吐、鼻出血和便血等临床症状,类似于猪瘟(classical swine fever,CSF)和猪繁殖与呼吸综合征(porcine reproductive and syndrome,PRRS)等其他猪病,需要通过实验室诊断进行区分[4-5]。
2018年8月,ASF首次传入我国辽宁省,随后迅速蔓延至全国33个省市,严重威胁我国的生猪健康和稳定生产,造成直接经济损失达数百亿元。由于目前尚无商品化的ASF疫苗和治疗手段,因此该病的防控主要依靠快速早期诊断和扑杀感染猪群。随着ASFV在我国的长期流行和传播,感染猪出现了非典型临床症状,死亡率降低,具有很大的隐蔽性,给ASF防控带来了挑战。因此,可靠的早期诊断技术和流行病学监测对ASF防控和净化至关重要。本文从ASF的病原学、流行病学、最新的实验室诊断技术研究进展进行综述,以期提高人们对该病的认识,掌握其流行趋势,为其诊断及防控提供借鉴和思路。
1 病原学
ASFV是非洲猪瘟相关病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的成员[6]。ASFV是一种胞质双链DNA(double-stranded DNA,dsDNA)病毒,具有线性的、无节段的基因组,长度为170~194 kb[7],包含151~167个开放阅读框(open reading frames,ORFs);病毒基因组由中间的125 kb 保守区域和紧邻末端的2个编码多基因家族(multigene families,MGFs)的可变末端组成,MGFs包括MGF100、MGF110、MGF300、MGF360、MGF505/530等基因[8]。MGFs多与ASFV逃避宿主免疫系统有关,其长达20 kb的区域可以发生基因的缺失和插入,这些突变可能有助于病毒产生抗原变异,从而使病毒逃逸宿主免疫系统的攻击[9-11]。ASFV病毒粒子结构复杂(图1),有多层膜和蛋白质层[12],从内到外依次是基因组(genome)、内核心壳(core shell)、内膜(inner envelope)、衣壳(capsid)、囊膜(outer envelope)。其最外层的蛋白外壳是一个二十面体的衣壳,主要由病毒基因B646L编码的蛋白p72组成,基于B646L基因末端核苷酸的差异,可以将ASFV分为24种基因型[13]。

图1 ASFV结构示意图
ASFV在不同温度和pH下存活时间不同。在高温环境下,56℃ 70 min或60℃ 20 min可灭活病毒。ASFV在pH值为4~10的无血清培养基中保持稳定,但pH值低于4或者高于11.5,几分钟内即会灭活病毒。ASFV对乙醚和氯仿敏感,此类有机溶剂可以通过破坏囊膜使病毒失活,但ASFV能够抵抗蛋白酶和核酸酶的降解作用[14]。一些消毒剂,如2%~3%次氯酸钠、2%氢氧化钠、过硫酸氢钾、0.3%福尔马林作用30 min,均可灭活该病毒。
2 流行病学
2.1 ASF流行分布ASF最早于1921年在肯尼亚首次被发现,随后在非洲大多数国家流行,并于20世纪中叶传入欧洲[15]。1957年从非洲西南部安哥拉传入葡萄牙,1959年再次传入葡萄牙,然后经过贸易往来传播到西班牙。此后,疫情到达加勒比地区的一些国家(古巴、多米尼加共和国和海地)以及巴西,对这些国家的生猪行业以及乡村零散养猪户造成灾难性影响。1960年ASF传入伊比利亚半岛,并在30年后被根除。目前,ASF在意大利撒丁岛的一些地区以及大多数撒哈拉以南的非洲国家仍然是地方流行病。
2007年,随着疫情传入欧洲高加索地区(格鲁吉亚),ASF在世界的流行分布发生了重大变化,欧洲各个地区都开始受到疫情波及,全球ASF疫情防控局势恶化,疫情在2008年蔓延至亚美尼亚、俄罗斯和阿塞拜疆[16],2012年传入乌克兰,2013年传入白俄罗斯,2014年传入拉脱维亚、波兰、立陶宛和爱沙尼亚,2016年传入摩尔多瓦,2017年传入捷克共和国和罗马尼亚[15,17]。2017年3月,俄罗斯联邦伊尔库茨克报告了ASF疫情,此地与之前报告疫情的地区相距数千公里,距离中国边境仅约1 000 km。这标志着该病首次从中东欧传播到俄罗斯联邦东部,距离中国边境相对较近[18]。2018年6-7月,中国辽宁省沈阳市附近某猪场暴发ASF,这是我国首次暴发ASF疫情[19]。自此,ASF在中国迅速传播,并在许多省市暴发,导致大量生猪死亡[20-21];同年,欧洲部分国家(匈牙利、保加利亚和比利时)报告ASF疫情。2019年,蒙古、越南、柬埔寨、朝鲜、老挝、缅甸、东帝汶、菲律宾、韩国和印度尼西亚等我国临近国家相继暴发ASF;同年,该病传入斯洛伐克和塞尔维亚。2020年,希腊、巴布亚新几内亚、印度、德国等无疫区国家接连被OIE通报首次发生ASF疫情。2021年7月,美国农业部 (USDA)报告,从多米尼加共和国采集的猪样本中发现了ASFV。自1921年ASF被确认以来,全球数十个国家/地区暴发了ASF疫情(表1)。虽然ASFV不会对人类健康构成风险,但它严重威胁食品安全,并限制疫区国家的生猪生产,造成重大的经济损失。中国作为世界上最大的猪肉生产和消费国,猪肉需求占全球的1/2,ASF对中国的影响尤其严重。
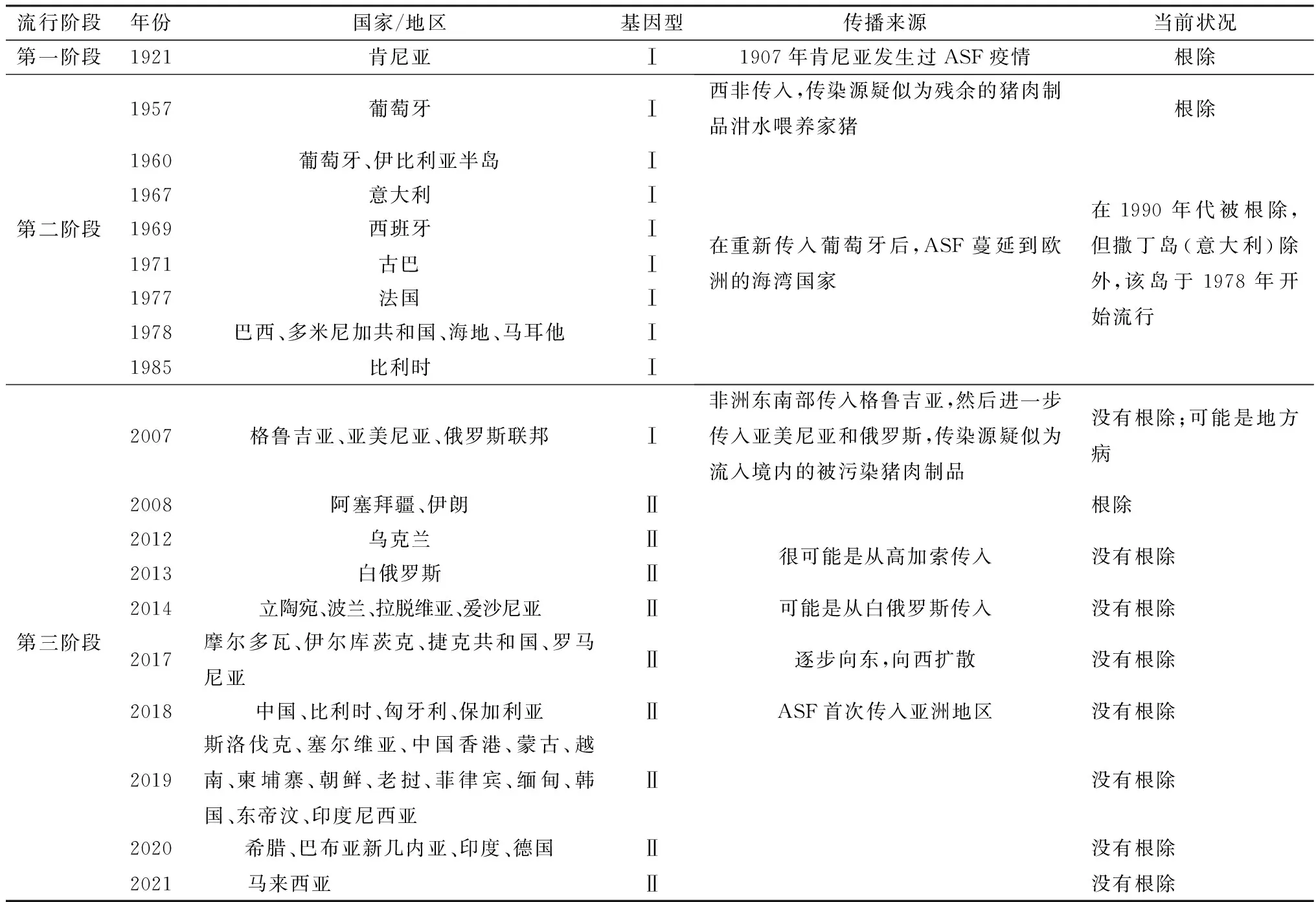
表1 ASF流行过程
2.2 分子流行病学
2.2.1ASFV基因型分布多样性 分子流行病学已被证明有助于调查ASF的流行病学模式,以及当这种疾病引入新的地区时可能的原因。基于红细胞吸附抑制(hemadsorption inhibition,HAI)试验可以将32株ASFV分成8个血清群[22]。基于编码p72蛋白的单一基因序列可以确定24个具有多个亚型的地理相关基因型,这说明了ASF流行病学的复杂性[13]。
过去,研究人员通过酶切位图绘制,对不同的基因组区域进行测序来分析ASFV的遗传变异。当前研究ASFV分子流行病学的方法是对编码p72蛋白的B646L基因的3′端进行序列分析,至少可区分24种基因型[13]。但是,该分型不能区分病毒毒力的差异。基于以上分型,进一步对编码内膜蛋白p54的E183L基因的全长序列进行分析,可以辨别中等毒力的毒株。此外,对其他基因组区域如编码p30蛋白的CP204L基因、位于I73R和I329L基因之间的串联重复序列和B602L基因内的中央可变区(CVR)进行分析,可以区分密切相关的毒株[23]。
ASFV基因型分布具有多样性,其中基因Ⅰ和Ⅱ型流行最广。在撒哈拉以南的非洲地区,有24种已知的ASFV基因型都已经被鉴定出[23]。而基因Ⅰ型ASFV自2006年以来广泛流行于部分欧洲地区,已有文献证明基因Ⅰ型ASFV来自西非。2007年,在欧洲整个高加索地区检测到来自非洲东南部的基因Ⅱ型ASFV。此后,基因Ⅱ型ASFV开始从格鲁吉亚向周边国家传播。2018年,中国暴发了ASF疫情,ZHAO等[24]对从中国分离的ASFV进行序列分析,结果表明,传入我国的ASFV属于基因Ⅱ型,与格鲁吉亚、俄罗斯、波兰公布的毒株全基因组序列同源性约为99.95%。随后,其他亚洲国家,如越南、韩国、老挝等相继暴发了ASF疫情,有科研人员对分离株进行分析,证实了ASFV流行株为基因Ⅱ型。基于以上的流行病学分析,ASFV跨国境传入的途径有以下几点:一是生猪及其产品的国际贸易和走私;二是国际旅客携带的猪肉及其产品;三是国际运输工具上的餐厨剩余物;四是野猪迁徙。因此,面对ASF疫情的发生,有必要加强病毒溯源调查,并采用分子流行病学方法分析,以进一步查明来源途径,更好地防控ASF。
2.2.2ASFV的基因重组 ASFV基因组包含1个约125 kb的保守中心区域和2个可变末端,可变区导致不同毒株基因组大小存在差异[25]。ASFV的基因组因发生点突变或者插入/缺失(indel)会导致表型的多样性。例如,MGF成员的缺失,可能会降低病毒的复制或毒力,这可能有助于软壁虱的病毒感染[26]。
基因重组是指控制不同性状的基因重新组合,产生大量的变异类型,但只产生新的基因型,不产生新的基因。据报道,同源重组经常发生在这几类病毒中,如疱疹病毒、禽流感病毒、逆转录病毒和冠状病毒,同源重组在病毒进化中发挥了重要作用[27]。DIXON等[12]对几个ASFV基因组进行了研究,结果表明ASFV在进化过程中发生了同源重组。然而,目前在基因组水平上缺乏对ASFV同源重组的全面研究,这种重组对病毒遗传多样性和进化的作用尚不清楚。最近,湖南大学研究团队通过生物信息学方法分析了数据库中已有的39个ASFV基因组,发现病毒基因组片段的indel对于基因组多样性的贡献远大于点突变(图2)[28]。该研究证实了ASFV基因组存在的大量重复元件有利于基因重组的发生,导致了病毒基因组的多样性以及病毒表型(如抗原/致病性等)的多样性。
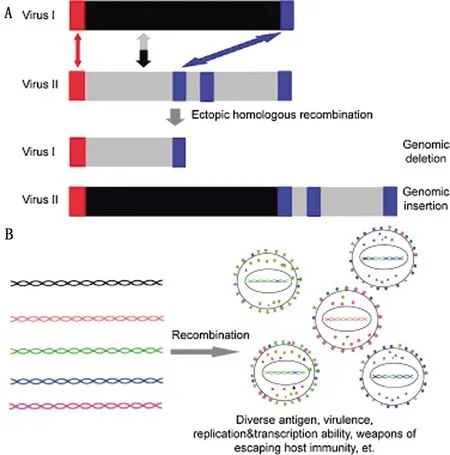
图2 ASFV基因重组(A)和遗传多样性(B)[35]
ASFV在流行过程中,为了能够在不同环境下生存,其基因组会发生一些突变和重组,导致变异株的出现。最近,我国国家ASF专业实验室发现了低致死率的ASFV基因Ⅱ型变异株[29]。张艳艳等[30]从主动监测的样品中分离到1株源自湖北某地的ASFV变异株,经基因组测序发现,其EP402R基因(CD2v)和上游相邻的EP153R基因出现部分缺失,导致病毒血吸附特性丧失。动物感染试验表明,变异株毒力低但传播性强。病毒变异给ASF早期诊断带来了阻碍,警示我们必须加强ASF流行病学监测及流行株的基因组变异分析。
3 非洲猪瘟的实验室诊断
开展ASF流行病学监测,可对病原溯源,为该病流行趋势提供预测、预警,更好地指导ASF防控。在进行流行病学调查过程中,快速准确的诊断是前提。
当前,ASFV实验室诊断方法主要分为两类,第一类为病原学诊断,包括针对病毒本身的检测方法(病毒分离和红细胞吸附试验)以及针对病毒核酸的分子生物学检测技术;第二类为血清学诊断,主要依靠检测机体由于暴露于病毒而产生的抗体或感染个体中的病毒抗原。
3.1 病原学诊断
3.1.1病毒分离和红细胞吸附试验 病毒分离或红细胞吸附(haemadsorption,HAD)试验是检测ASFV的“金标准”之一。ASFV可感染原代猪骨髓细胞、原代白细胞或肺泡巨噬细胞,并且在感染的细胞中进行复制,产生致细胞病变效应(cytopathic effect,CPE)和HAD现象,这是ASFV感染细胞特有的特征,可用于诊断。HAD指的是感染ASFV的猪外周血单核细胞或巨噬细胞会吸附在猪红细胞表面,而呈现出特征性的“玫瑰花环”,该方法是由MALMQUIST等[31]在1960年建立。但是,并非所有ASFV毒株都具有HAD特性,ASFV在流行过程中,会出现一些非红细胞吸附毒株[32]。如果需要进一步确诊,可采用PCR或者荧光抗体试验(fluorescent antibody test,FAT)等方法进行验证。通过检测活病毒进行诊断有一定局限性,因为ASFV在我国属于一类动物疫病病原,涉及活病毒操作有严格限制,必须在生物安全3级(P3)及以上实验室开展。因此,病毒分离多用于病毒的分子生物学研究。
3.1.2病毒核酸检测 病毒核酸检测方法具有特异性强、灵敏度高和快速的特点,已成为ASFV检测的主要方法[33]。目前,ASFV核酸检测方法包括荧光定量PCR(qPCR)、全基因组测序、等温核酸扩增法等。其中,qPCR是当前应用最广泛的方法,也被OIE作为ASF早期诊断的“金标准”技术[34]。
(1)qPCR法:目前ASFV核酸检测针对的位点主要是基因组中的高度保守区域,即以编码p72蛋白的B646L基因作为检测靶标,也有少数使用9GL基因作为靶标检测ASFV。
qPCR比基于凝胶的普通PCR速度更快,灵敏度更高。在普通PCR的反应体系基础上加入荧光化学物质,将荧光信号与DNA扩增联系起来,最后通过机器读取结果。常见的qPCR法有荧光染料法和探针法。以SYBR GreenⅠ为代表的核酸染料法通用性好,成本低,游离状态下,SYBR GreenⅠ发出的荧光较弱,但是结合到双链DNA的双螺旋小沟区域后,荧光信号显著增强。探针法主要是在PCR反应中利用标记荧光染料的特异性寡核苷酸探针来检测产物,从而大大减少了假阳性的发生,专一性更高。目前,qPCR使用最广泛的是TaqMan探针。为了及时控制突如其来的ASF疫情,2018-2019年,中国动物疫病预防控制中心对符合要求的ASFV检测试剂盒先后进行2次评审,以快速应对ASF诊断需求。2020年农业农村部发布公告,要求所有未参加或未通过中国动物疫病预防控制中心比对试验的ASFV诊断制品,以及通过比对试验但目前未申请注册的ASFV诊断制品,一律停止生产销售。目前,已有多个ASFV检测试剂盒通过农业农村部批准并取得文号,包括中国农业科学院哈尔滨兽医研究所联合哈尔滨国生生物科技股份有限公司等单位研制的ASFV荧光PCR检测试剂盒(表2)[35]。国外批准的ASFV检测试剂盒也以qPCR居多,ELISA试剂盒次之(表2),其中qPCR中的VetMAXTMASFV Detection Kit经过欧盟ASF参考实验室(CISA-INIA)验证。自2015年起在东欧和亚洲疫情爆发中广泛使用,应用于临床确诊以及家猪和野猪中ASFV感染的筛查。

表2 国内外已批准使用的非洲猪瘟检测试剂盒
基因缺失减毒疫苗(例如MGF 360、MGF 505和CD2v基因缺失)可能是目前最有前途的候选ASF疫苗之一[36]。LIN等[37]在2020年开发了一种三重qPCR法检测ASFV基因组的B646L、MGF 360-14L和CD2v基因,用于鉴定ASFV基因缺失毒和野毒,该方法不与猪的其他病毒DNA发生交叉反应。GUO等[38]建立了基于B646L和MGF 505-2R基因的双重TaqMan qPCR方法,该方法可单独或同时特异性检测B646L和MGF 505-2R基因,用以区分野毒和MGF基因缺失毒株。
(2)多重PCR:由于ASF临床症状与CSF、PRRS等其他猪病症状表现相似,临床上难以区分。因此,有必要开发一种多重PCR方法同时检测这些症状相似的疾病。LIU等[39]于2020年建立了针对ASFV、CSFV和猪非典型瘟病毒(atypical porcine pestivirus,APPV)的多重PCR方法,结果表明,该方法具有特异性强、灵敏度高和稳定等特点。
(3)数字PCR(digital PCR,dPCR):dPCR是近几年发展起来的一种核酸定量分析技术。与qPCR不同,dPCR对结果的判定不依赖于扩增曲线循环Ct值,不受扩增效率的影响,能够直接读出DNA的分子个数,进而实现对起始样本核酸分子的绝对定量。在此基础上,美国应用生物系统公司(ABI)利用密封芯片分割样本到数千个反应井中进行独立的PCR扩增,开发了另外一种dPCR,该方法称为纳米流体芯片数字PCR (cdPCR)。JIA等[40]于2020年通过对ASFV B646L基因的部分序列设计特异性引物和探针利用cdPCR技术检测ASFV,并与OIE推荐的VetMAXTMASFV qPCR检测试剂盒进行对比。结果表明,cdPCR的敏感性不及qPCR,但这也是cdPCR首次成功用于ASFV检测。
(4)等温核酸扩增法:等温核酸扩增技术是近年来发展起来的基于恒温扩增的新型核酸扩增技术,主要包括环介导等温扩增(loop-mediated isothermal amplification,LAMP)、重组酶聚合酶扩增(recombinase polymerase amplification,RPA)、重组酶介导等温扩增(recombinase aided amplification,RAA)。该技术不需要昂贵的热循环仪,只需要恒温设备即可完成扩增反应,具有操作简便、性价比高等特点,且具有较高的敏感性和特异性。
3.2 血清学诊断
3.2.1酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) ELISA的原理是利用酶标抗原或抗体来检测相对应的抗原或抗体的免疫学技术,具有特异性强、敏感性高、重复性好、检测速度快等优点,并且ELISA使用96孔板来检测,因此非常适用于“群体”检测。ELISA种类很多,包括用来检测抗体的间接ELISA和阻断ELISA、检测抗原的双抗体夹心ELISA等。表2展示了部分经过验证的ASFV ELISA检测试剂盒,其中,ID Screen©ASF Indirect是基于多种抗原(p72、p30和pp62)的间接ELISA抗体检测试剂盒;INGENASA公司的INGEZIM PPA COMPAC K3是基于p72蛋白的竞争ELISA抗体检测制品,是欧盟区域使用最广泛的试剂盒。
过去已经开发出许多针对ASFV蛋白的抗原ELISA方法,包括直接、间接和夹心ELISA。一般认为ASFV抗原ELISA的敏感性不如PCR[41]。首次用于检测ASFV的直接ELISA可以检测到50~500 HAD50/mL的ASFV[42]。后来建立了一种基于针对p72蛋白的单克隆抗体(monoclonal antibody,MAb)的夹心ELISA对同源抗原的检测高度敏感。HUTCHINGS等[43]建立了2种间接夹心ELISA用于检测ASFV抗原,一种是使用多克隆抗体,另一种是使用MAb和多克隆抗体的组合。2种检测方法均检测到了来自多种现场分离株的抗原,但是发现使用多克隆抗体的检测方法比使用MAb的方法敏感性更高。
3.2.2化学发光免疫分析法(chemiluminescent immunoassay,CLIA) CLIA是由HALMAN等[44]将化学发光与抗原抗体免疫反应相结合建立的一种方法。CLIA结合了高度敏感的化学发光反应和高度特异性的免疫反应,是目前使用最广泛的免疫分析技术。CLIA分为3种类型:酶促化学发光免疫分析(chemiluminescent enzyme immunoassay,CLEIA)、直接化学发光免疫分析和电化学发光免疫分析。CLELA是以酶标记抗原或抗体进行免疫反应,免疫反应复合物上的酶再作用于发光底物,在信号试剂作用下发光,用发光信号测定仪进行发光测定,酶标抗体或抗原的浓度决定了化学发光的强度(图3)。辣根过氧化物酶(HRP)和碱性磷酸酶(ALP)为CLEIA常用的标记酶,发光底物以鲁米诺(luminol)、AMPPD为代表,相较于传统免疫技术(放射免疫技术、酶免疫技术、荧光免疫技术等),CLIA具有自动化程度高、特异性好、精确度高、检测范围广等优势,在检验医学中有多方面的应用,但是在兽医学中的临床应用相对较少。近年来关于化学发光法检测技术在动物疫病诊断中的应用只有伪狂犬病病毒、猪细小病毒、圆环病毒等几篇报道[45-46]。

图3 基于化学发光法的间接ELISA原理图
3.2.3侧向流动免疫层析法(lateral flow immunoassay,LFA) LFA试纸条是一种定性色谱分析方法,体积小、携带方便,适合于疾病现场诊断。该技术已开发出多种检测方法,如胶体金免疫层析试纸条和荧光免疫层析试纸条。目前,胶体金试纸条检测存在一定的不足,如敏感性和特异性低、缺乏定量能力。因此,高敏感性和具有定量能力的荧光免疫层析技术在人类和动物疫病诊断中更受欢迎。荧光免疫层析技术主要由纳米颗粒荧光微球(图4A)和LFA试纸条组成,其基本原理为:用荧光微球标记特异的MAb,将另一种特异的MAb预先固定于硝酸纤维素膜的检测区(T线),将抗鼠IgG抗体固定于硝酸纤维素膜的质控区(C线);加入待测样品后,基于侧向流动免疫层析原理,样品中的抗原与荧光微球标记抗体结合后,流经检测区,与另一种特异性MAb结合,形成抗体-抗原-荧光微球标记抗体复合物;同时剩余的荧光微球标记抗体在质控区与抗鼠IgG结合,形成抗体-荧光微球标记抗体复合物;在紫外光激发下,检测区出现荧光条带为阳性结果,未出现荧光条带为阴性结果(图4B)。近年来,已开发出许多基于荧光微球的试纸条用于定量或半定量检测[47],但是常规的荧光染料并不理想,因为它们易于发生光漂白并且稳定性差或量子产率低。掺杂镧系元素的聚苯乙烯纳米颗粒荧光微球可以克服这些问题,同时具有简单、快速、易于生产的优势,已应用在多种疾病的诊断[48-49]。

图4 荧光微球抗原检测试纸条原理图
血清学检测技术因简便、成本低和无需特殊的仪器设备,而成为最常用的检测手段。由于没有商业化的ASF疫苗,因此抗体检测尤其重要,ASFV抗体阳性意味着动物当前或者曾经发生了感染。此外,ASFV抗体在感染早期即可出现,并且可持续长达数月甚至数年。然而,在特急性和急性感染中,猪通常在抗体转为阳性前已死亡。因此,基于抗体的监测对于检测存活的动物,阐明ASF的流行病学特征(即自病毒引入猪场以来的时间)以及检测涉及低毒力ASFV分离株的传播至关重要[50-51],对于实施ASF根除计划也是不可缺少的[52]。
4 小结与展望
在过去的100年中,ASF一直是世界上最危险的动物传染病之一,尽管许多国家投入了大量时间、精力和经费,但仍缺乏有效的疫苗和治疗方法。过去的研究工作表明,基于物理或化学灭活的ASF疫苗、亚单位疫苗、核酸疫苗和基于病毒载体的疫苗都无法诱导保护性免疫[53-54]。减毒ASFV分离株已被证明可以对同源毒株提供免疫保护,但由于野毒和疫苗毒之间可能会发生重组,产生新毒株,具有安全隐患,阻碍了疫苗的研发进程[55]。目前防控ASF入侵和传播只能依靠流行病学监测、早期诊断和严格的生物安全措施。
目前,我国的ASF形式已由急性型转为亚急性型,流行趋势逐渐放缓,感染猪出现低死亡率、临床症状不明显等弱毒株感染特征。2020年以来,在我国各地区主动监测的样品中发现了ASFV变异株,分离株的基因组序列发生了不同程度的变化,包括核苷酸突变、插入、缺失或替换等。其中,CD2v基因相对于其它基因突变频率更高,导致部分毒株血吸附特性丧失,毒力减弱,感染动物临床症状不明显,给ASF防控带来了挑战。另外,据有关媒体报道,在我国一些猪场鉴定出新形式的ASFV,即所谓人工改造的非法疫苗株,该病毒缺失MGF和/或CD2v基因,毒力减弱。同时,我国现地出现了基因Ⅰ型弱毒株,全基因组序列分析显示,与葡萄牙的弱毒分离株NH/P68和OURT 88/3具有高度的同源性,基因组左可变区的MGF基因存在大片段缺失。目前我国ASFV毒株类型多样化,基因Ⅱ型野毒株和人工改造的非法疫苗株(基因缺失毒株)之间,基因Ⅰ型弱毒株与基因Ⅱ型野毒株之间都存在重组的可能性。因此,有必要定期对我国各地区进行ASF流行病学监测,以快速掌握ASFV的流行趋势和遗传变异规律,更好地应对变异株所带来的复杂情况。
变异株的出现有多种原因,第1个可能是因为我国生猪养殖规模大,提高了病毒的流行范围和频率;第2个可能是由于病毒在我国长期流行,为了适应环境而做出一些改变,包括病毒毒力减弱、感染猪临床症状不明显等。早期的急性型ASF致死率高,而当前出现的变异株毒力减弱、潜伏期延长,死亡率降低,更容易向外界散播病毒,病毒也更容易在猪群中生存。还有一部分原因在于非法的ASFV疫苗株在猪场中流行,可能导致病毒加速变异。非法ASFV疫苗的使用使我国ASF流行病学更加复杂,防控难度加大。ASFV弱毒株感染隐蔽性更强、临床症状出现更晚、不易被察觉,目前的病原学及血清学检测技术亟待升级,以便更快、更准确地进行ASF监测。
当前开发的检测技术大多是基于qPCR的诊断方法,需要较长的样本准备和分析时间以及昂贵的仪器,不适合现地快速检测。血清学检测技术,如ELISA抗体检测适合于群体检测,但由于感染后抗体的产生是滞后的,因此通过抗体检查也很难筛查出处于潜伏期内的猪只,并且ELISA抗体检测敏感性和准确性存在着一定的不足。胶体金试纸条虽然适合现地检测,并且在十几分钟内就可判定结果,但同样存在着敏感性和准确性不足的问题。随着ASF持续传播,迫切需要开发敏感、特异、适合现场检测的快速诊断方法。在ASF流行之际,人类的新型冠状病毒肺炎(COVID-19)也正在发生大流行,许多国内外学者开发出新的快速检测技术用于防控该病,诸如免疫IgM/IgG抗体检测[56]、纳米孔测序技术[57]、化学发光法[58]等检测方法。另外,CRISPR基因编辑技术也被应用于COVID-19诊断,利用Cas9、Cas12、Cas13等核酸酶开发出一系列新的检测技术,可以快速准确地检测病毒[59-61]。ASF诊断技术也正朝向这些领域发展,相信会有更多可靠便捷的诊断技术和产品问世,推动ASF的有效防控。
