一种快速易行的大鼠渗出性肺炎模型的构建
2022-07-23王银龙王广泽汪培嘉许小琴扬州大学兽医学院江苏扬州225009
王银龙,严 静,王广泽,张 玥,汪培嘉,许小琴 (扬州大学 兽医学院,江苏 扬州 225009)
渗出性肺炎(exudative pneumonia,EP)是肺炎的一种,病理变化以肺泡腔及支气管大量的炎性渗出为主,并常伴有肺泡、肺间质及支气管的充血、出血等,是多种肺部疾病发生的病理基础。其发病机制较为复杂,夏平凡[1]认为,EP的形成与水通道蛋白(aquaporin,AQPs)及黏蛋白(MUC5AC)的表达关系密切。为探讨AQPs体系与EP发生发展的关系,诸多研究人员陆续报道了通过滴鼻、手术气管滴入、气管弥散等攻菌方式用肺炎克雷伯杆菌(Klebsiellapneumoniae,KP)制备大鼠肺炎模型,取得了较好的效果,为肺炎疾病的研究做出了重要的贡献[2-5]。然而,单用KP 1周2次滴鼻,需要8周以上才能成模,虽然手术时间较短,但对环境、设备、人员等条件要求高,而且其不能很好的模拟自然性肺炎的发病过程。童明庆等[6]在建立小鼠肺炎克雷伯杆菌性肺炎模型时发现,如果提前给予小鼠腹腔注射一定量的氢化可的松和环磷酰胺等免疫抑制剂,可大大提高小鼠肺炎模型的稳定性,并减少所需造模时间。据报道,脂多糖(lipopolysaccharide,LPS)作为革兰阴性菌细胞壁的特有成分,可作用于目标细胞膜的TLR4受体,引发炎症反应,造成动物机体免疫力明显降低[7-8]。为模拟临床疾病特征,简化造模方法,缩短造模时间,本研究采用低剂量LPS腹腔注射后,每天以低剂量KP双侧滴鼻5 d的方法建立大鼠EP模型,检测大鼠的临床和病理变化,探究该造模方法的可行性。
1 材料与方法
1.1 实验动物50只体质量(200±10)g的6周龄SPF级Wistar雄性大鼠购于斯贝福(北京)生物技术有限公司,实验动物使用许可证号为SCXK(京)2019-0010。饲养环境温度为(26±2)℃,相对湿度为(60±10)%,自然光照,自由采食和饮水。
1.2 主要试剂KP购自中国兽医药品监察所,保藏于兽医微生物菌种保藏管理中心,保藏编号为CVCC4080;LPS购自北京索莱宝科技有限公司;AQP3抗体、AQP5抗体、MUC5AC抗体、荧光标记的二抗均购自英国Abcam公司;IL-1β、IL-6、TNF-α ELISA试剂盒均购自上海酶联生物科技有限公司。
1.3 主要仪器EPOCH-M491酶标仪,美国BioTek公司产品;RM-2016组织切片机、MC-15光学显微镜、TCSSP8STED超高分辨率共聚焦显微成像系统,德国Lecia公司产品;Western Blot-6000化学发光成像系统,上海勤翔科学仪器有限公司产品。
1.4 实验动物分组及处理方法将50只大鼠随机分为A组(高剂量,H-KP)、B组(低剂量,L-KP)、C组(LPS)、D组(LPS+L-KP)、E组(Con),每组10只。适应性饲喂3 d。D组:于试验第1天腹腔注射2 mg/kg LPS,其后,连续5 d鼻腔滴注接种50 μL 1×107CFU/mL KP菌液;A组:于试验第2天开始,鼻腔滴注接种50 μL 1×109CFU/mL KP菌液,连续5 d;B组:于试验第2天开始,鼻腔滴注接种50 μL 1×107CFU/mL KP菌液,连续5 d;C组:于试验开始第1天腹腔注射2 mg/kg LPS;E组:于试验第2天开始,鼻腔滴注50 μL PBS溶液,连续5 d。各组均在造模结束后3 d(72 h)处死,试验分组及处理见表1。

表1 试验分组及处理
1.5 观测指标
1.5.1临床症状 观察大鼠整体状态,记录大鼠出现咳嗽、喷嚏等呼吸道症状的时间;体温:采用电子温度计测量肛温;呼吸频率:大鼠安静状态,以腹部起伏1次计1次呼吸数,计时1 min,每组计3次,取平均数。
1.5.2炎性指标 攻菌结束后,用过量戊巴比妥钠溶液麻醉,剖开腹腔,腹腔静脉采血并分装至EDTA抗凝管和离心管,分别留作白细胞计数和IL-1β、IL-6、TNF-α炎性因子测定;每组随机选择3只大鼠(选择的大鼠不再用于肺组织采样),剖开颈部皮肤,暴露气管,远心端结扎,用4 mL PBS反复冲洗肺组织3~5次,收集1 mL灌洗液分装至2个离心管,分别留作IL-1β、IL-6、TNF-α炎性因子测定。
1.5.3剖检及病理组织切片观察 打开大鼠胸腔,观察肺部组织病理变化,取出肺组织置于10%多聚甲醛中固定36 h,制作石蜡切片,进行HE染色,光学显微镜下观察。
1.5.4MUC5AC表达检测 选择1.5.3制作的石蜡切片,进行免疫组织荧光染色,在超高分辨率共聚焦显微镜下观察并照相。
1.5.5AQP3、AQP5表达检测 打开大鼠胸腔,取右肺组织,通过Western blot检测组织中AQP3、AQP5的表达量。
1.6 统计学分析试验结果以采用SPSS 20.0软件处理数据,运用方差分析进行统计,结果以平均值±标准差表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 大鼠临床症状观察结果攻毒结束后,A、B、C、D造模组大鼠均出现不同程度的临床症状,具体表现:造模结束后,D组大鼠体温极显著高于E组(P<0.01),并且显著高于B、C组(P<0.05)(图1A); D组大鼠每分钟呼吸数极显著高于E组(P<0.01),并且极显著高于B组(P<0.01)(图1B);D组从第攻毒第3天有大鼠出现咳嗽,至造模结束共有8只大鼠出现明显的咳嗽症状,占总数8/10,高于A组的3/10、B组的2/10、C组的0/10、D组的0/10(图1C)。

A.处死前体温;B.每分钟呼吸次数;C.出现咳嗽症状的大鼠个数。与E组相比,*示 P<0.05,**示P<0.01;与D组相比,#示P<0.05;##示P<0.01。下同图1 不同造模方法对大鼠临床症状的影响(n=10)
2.2 大鼠炎性指标测定结果攻毒结束后,A、B、C、D造模组大鼠炎性指标均出现不同程度的变化,具体表现:造模结束后,D组大鼠白细胞总数极显著高于E组(P<0.01),其中嗜中性粒细胞数量显著高于E组(P<0.05)(图2A);D组大鼠血清中IL-6表达量显著高于E组(P<0.05)(图2B);D组大鼠肺泡灌洗液中IL-6表达量显著高于E组(P<0.05),且显著高于C组(P<0.05);IL-1β表达量显著高于E组(P<0.05);TNF-α表达量极显著高于E组(P<0.01),且显著高于A、B、C组(P<0.05),(图2C)。
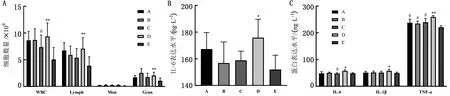
A.白细胞及3分类计数;B.血清中IL-6表达量;C.肺泡灌洗液中IL-6、IL-1β、TNF-α表达量图2 不同造模方式对大鼠炎性指标的影响(n=10)
2.3 剖检及病理切片观察结果剖检结果显示:A组有2只大鼠肺部组织可见充血点,右肺中叶可见明显坏死灶;B组有1只大鼠肺部组织可见纹理增粗现象;C组7只大鼠肺部组织无明显病理变化;D组有6只大鼠肺部组织可见充血、出血点,右肺中叶可见明显坏死灶,其中3只左肺下叶尖、右肺上叶、右肺下叶尖可见明显的充血区域;E组7只大鼠肺组织均完整,结构清晰,呈水粉色。病理组织切片显示:A组大鼠肺部组织可见支气管管壁增厚、管腔狭窄,肺泡腔内大量的炎性渗出;B、C组大鼠肺组织支气管粘膜及肺泡结构完整,C组大鼠可见支气管内壁增厚现象; D组大鼠肺组织可见支气管粘膜断裂,部分柱状上皮细胞脱落,肺泡结构紊乱大小不一,肺泡壁增厚、塌陷,肺泡腔可见大量的炎性渗出物;E组大鼠肺组织支气管黏膜完整,纤毛整齐、丰富,肺泡结构完整,交织呈网状结构(图3)。
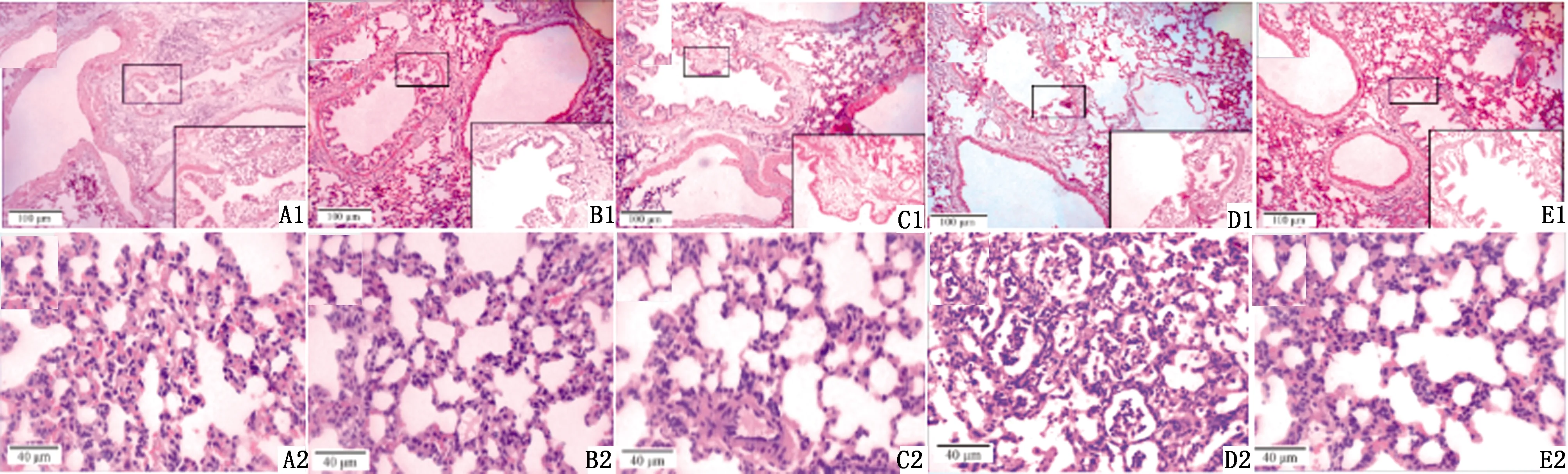
A.H-KP组;B.L-KP组;C.LPS组;D.LPS+L-KP组;E.空白组。A1、B1、C1、D1、E1.以肺组织支气管为主视野;A2、B2、C2、D2、E2.以肺组织肺泡腔为主视野图3 不同造模方式对大鼠肺部组织病理变化的影响(HE染色,400×;n=7)
2.4 肺部组织MUC5AC免疫荧光检测结果免疫荧光检测结果显示,D组大鼠肺部组织MUC5AC平均荧光强度显著高于E组(P<0.05);其余组的荧光强度和E组无明显差别(表2)(图4)。

对肺部组织MUC5AC进行绿色荧光染色处理,其中每个样品按“回”字形至少随机拍摄10张照片,不同组别样品观察时只调节共聚焦显微镜“Z”轴,其余光源强度等条件均不作改变,图中展示了各组代表性的结果(400×)图4 不同造模方法对大鼠肺组织MUC5AC表达量的影响

表2 不同造模方法对大鼠肺组织MUC5AC表达量的影响(n=6)
2.5 肺部组织AQP3、AQP5 蛋白表达检测结果Western blot检测结果显示,与E组比较,D组大鼠肺组织中AQP3表达量显著性降低(P<0.05);A、D组大鼠肺组织AQP5表达量极显著降低(P<0.01)(表3,图5)。

表3 不同造模方法对大鼠肺组织AQP3、AQP5表达量的影响(n=6) ×105

A.H-KP组;B.L-KP组;C.LPS组;D.LPS+L-KP组;E.空白对照组图5 Western blot检测不同造模方法对大鼠肺部组织AQP3(左)、AQP5(右)表达量的影响(n=6)
3 讨论
EP为非经典医学名词, 主要指以肺泡腔有大量炎性渗出为病理特征的肺部炎症,是多种肺部疾病病理发展的基础,尤其在慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)[1]和 急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)疾病进程中扮演了关键的角色[9]。单纯性EP动物临床表现为明显的精神萎顿、体温升高、呼吸加快并伴有频繁的咳嗽症状;剖检可见肺泡、支气管充血、出血及肺泡腔大量的炎性渗出物等病理变化。一个理想的EP动物模型应能够准确呈现上述症状,且方法简便、易行。目前常用的造模方法是用KP菌液长周期、间隔性单侧滴鼻,该方法稳定性好、个体差异小,效果较好,但是需要的时间周期长,人为不确定因素干扰大;部分学者采用手术方法,剖开气管,滴注KP菌液,该方法时间短,但是个体差异性大,并且需要一定的技术和设备,不利于制备规模化的动物模型。据报道,呼吸障碍是EP动物最早出现的临床症状[10]。推测可能是由于外界病原微生物通过呼吸进入呼吸道定植,或者动物机体免疫下降,呼吸道中条件性致病菌增殖所致[11]。LPS作为革兰阴性细菌细胞壁特有成分,为一种强效的致炎因子,腹腔注射可引起动物严重的炎症反应,导致动物机体免疫力下降。因此,为模拟这一临床症状,本研究先给大鼠腹腔注射LPS,然后连续双侧滴鼻接种KP,5 d后检查发现,模型组大鼠剖检肺部组织病理变化符合预期并且与临床呼吸障碍存在相关性,达到较好的造模效果。
AQPs是一个具有跨膜转运水分子功能的蛋白家族,在哺乳动物体内已发现数十种AQPs,其中AQP1、AQP3、AQP4、AQP5在肺部组织大量表达[12-13]。AQPs以同源四聚体结构存在于细胞膜,类似于“沙漏”横跨细胞膜内外,水分子可不与AQPs结合,仅靠渗透和质子排斥便可横跨细胞膜[13],极大提高水分子的运输效率。HILL等[14]和MA等[15]发现,敲除体外培养的哺乳动物上皮细胞的AQPs基因,细胞水转运率会减少80%~90%。VERKMAN[16]发现,敲除大鼠的AQPs基因,大鼠整体水转运率也会减少50%~60%,说明AQPs在动物机体水转运过程中扮演了至关重要的作用。这也引起了研究EP学者的注意,EP的典型症状为支气管及肺泡大量炎性渗出物,这些炎性渗出物的形成和AQPs的关系及相互作用机理,成为众多学者研究的热点。有研究表明,将小鼠的AQPs基因敲除,小鼠肺泡毛细血管通透性明显下降[17];另有研究结果显示,肺部炎症的发生时,AQP1和AQP5出现表达降低的现象[18];罗建红等[19]发现,在构建大鼠肺炎模型时,模型组大鼠肺组织APQ1、AQP4、AQP5的表达显著降低,而TNF-α、IL-6表达明显上升。杨志军等[20]对大鼠肺炎模型进行治疗研究时发现,治疗组大鼠TNF-α表达量显著性降低,AQP1、AQP5表达量显著性升高,说明水通道蛋白参与肺部组织炎症的进程,并可能与炎性反应进程及部分炎性因子的表达呈负相关关系。
黏蛋白(mucoprotein,MUC)是一类主要由上皮杯状细胞分泌的糖蛋白,正常情况下,MUC5AB为呼吸道黏液的主要组成部分,但在病理情况下,呼吸道黏液则以MUC5AC为主[21]。OKUDA等[22]认为,MUC5AC的表达量和呼吸道炎症的进程成正相关关系。刘敏等[23]在用鸡卵白蛋白构建小鼠气道高分泌模型时发现,模型组小鼠肺组织MUC5AC及其mRNA表达量较空白对照组显著增高。张骞等[24]在用香烟联合LPS法构建大鼠慢性肺阻塞模型时发现,模型组大鼠肺组织MUC5AC表达量与空白组比较显著升高,在用药物治疗取得一定效果后,肺组织MUC5AC表达量较模型组显著性降低;说明MUC5AC与AQP3、AQP5一样参与了肺部组织的炎症进程,而且与炎性反应进程及部分炎性因子的表达呈正相关关系。
肿瘤坏死因子α-水通道蛋白-黏蛋白调节轴(TNF-α-AQPs-MUC5AC regulating shaft,TAM-R)为解释调控呼吸道黏液分泌的假想模型。目前,没有明确证实其有上下游调节关系,只是基于众多学者研究肺部炎症进展时发现,TNF-α分泌增多的情况下,AQPs表达量会显著性降低,MUC5AC分泌量会显著性增加,并且在治疗后,AQPs表达量升高时,MUC5AC会相应的降低[25]。CHEN等[26]发现,敲除气道腺体AQPs基因后5 d,MUC5AC的合成和分泌量分别增加了57.9%和85.3%。学者们便根据因果关系预测TAMR的存在,但具体、明确、严谨的调节关系还有待于进一步研究。
本研究对大鼠进行造模干预后发现,与空白组大鼠相比,模型组大鼠肺组织AQP3、AQP5表达量显著性下降,MUC5AC表达量显著性升高;血液中IL-6表达量显著性高于空白对照组,肺泡灌洗液中IL-6、TNF-α、IL-1β表达量显著高于空白对照组,表明大鼠在被LPS致弱的情况下,KP感染导致肺部组织充血、出血及大量的炎性渗出物,使动物体温上升,在KP感染后5 d,便导致肺部组织充血、出血及大量的炎性物渗出,动物出现体温上升、呼吸障碍等典型的渗出性肺炎症状。该造模方法具有操作简单、耗时短等特点,为探讨EP与炎症进程及AQPs的关系,以及EP治疗药物的研究提供了快速易行的试验动物模型。
