猪群免疫应激及运输应激检测指标的筛选
2022-07-23崔亮亮苏娜瑛陈永林吕志凯孙秀秀王璐梦刘晓丽张万坡胡薛英谷长勤程国富华中农业大学动物医学院湖北武汉430070
崔亮亮,苏娜瑛,陈永林,吕志凯,孙秀秀,王璐梦,刘晓丽,张万坡,胡薛英,谷长勤,程国富 (华中农业大学 动物医学院,湖北 武汉 430070)
我国一直以来都是猪肉消费大国,近年来生猪养殖规模不断扩大,但由于应激对猪的福利和生产性能产生不良影响,集约化养猪场的应激问题日益引起人们的关注。由各种应激原(免疫、运输、高温、低温、微生物感染等)引起的应激使机体发生代谢紊乱,甚至出现损伤及死亡,造成了巨大的经济损失。随着动物福利的普及和养殖水平的提高,生产过程中所面临的应激原也越来越少。但是,异地育肥的养殖模式导致猪在生产过程中至少被运输1次,接种的疫苗种类与次数更是繁多,使运输应激和免疫应激仍是现代养殖中不可避免的问题,对养殖生产造成了很大的负面影响。在应激反应中,机体的神经-内分泌系统激活,同时免疫系统也被激活。细胞因子可作为一种介质调节神经-内分泌系统与免疫系统之间的复杂网络,使机体能够在一定限度内维持平衡[1]。其中,IL-1β、IL-6、TNF-α 3种促炎细胞因子在应激领域中的研究最多[2-4]。急性期反应是机体的一种非特异性反应,合成的急性期蛋白对机体有广泛防御意义(杀死感染微生物、修复受损组织、恢复机体平衡等)[5]。正常情况下,机体血液中的急性期蛋白浓度很低,而在应激原的刺激下,浓度会发生显著改变,这就使得急性期蛋白易于检测。在应激反应中,研究最多的有CRP、HP、SAA、AGP、Apo-A1、pig-MAP等。因此,本试验以现代猪场中最常见的运输应激与免疫应激为研究对象,研究了应激时细胞因子与急性期蛋白的变化规律,期望能够找到合适的指标用来检测猪的应激。
1 材料与方法
1.1 材料
1.1.1试验动物 35日龄左右的二元杂交(大白×长白)仔猪购自广西贵港市某规模化猪场。
1.1.2主要仪器 核酸/蛋白质浓度测定仪(型号:DU-640)购于美国Beckman公司;高速冷冻离心机(型号:5424R)购于德国EPPENDORF公司;荧光定量PCR仪(型号:Step One Plus)购于美国ABI公司;酶标仪(型号:MK3)购于美国Thermo Fisher Scientific公司。
1.1.3主要试剂 猪圆环病毒2型灭活疫苗(WH株)购于武汉科前生物股份有限公司;RNA isolater(商品号:R401-01)购于南京诺唯赞生物科技有限公司;HiScript II Q RT SuperMix for qPCR (+gDNA wiper)(商品号:R223-01)购于南京诺唯赞生物科技有限公司;ChamQ Universal SYBR qPCR Master Mix(商品号:Q711-02)购于南京诺唯赞生物科技有限公司;Pig IL-6 ELISA Kit(商品号:CSB-E06786p)购于武汉华美生物工程有限公司;Pig SAA ELISA Kit(商品号:CSB-E13309p)购于武汉华美生物工程有限公司;Pig Apo-A1 ELISA Kit(商品号:CSB-E06834p)购于武汉华美生物工程有限公司;Pig-MAP ELISA Kit(商品号:CSB-E13425p)购于武汉华美生物工程有限公司;Pig AGP ELISA Kit购于南京建成生物工程研究所。
1.1.4引物设计及合成 从NCBI数据库网站中获取β-actin、CRP、HP、SAA、AGP、Apo-A1、pig-MAP序列并设计引物,引物序列见表1,由武汉生工生物工程公司合成。
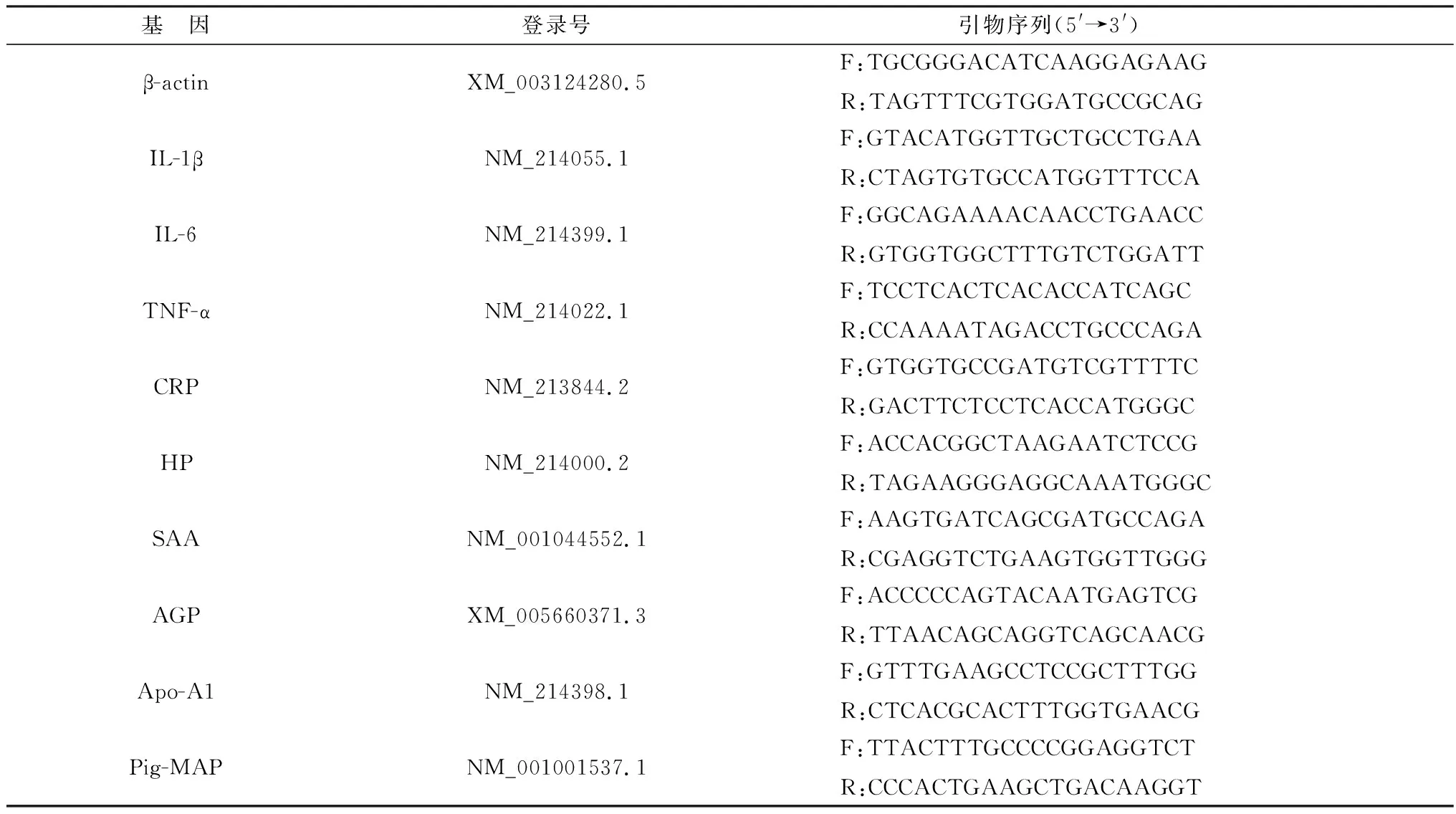
表1 荧光定量PCR引物相关信息
1.2 方法
1.2.1试验动物分组及处理 将仔猪分为3组,分别为对照组(3头)、免疫应激组(4头)、运输应激组(4头)。首先从健康猪群中随机选择7头仔猪作为对照组和运输应激组。随后给栏内剩余仔猪注射2 mL 猪圆环病毒2型灭活疫苗(WH株),部分仔猪迅速出现了明显的应激症状(呼吸急促、皮肤发红、惊厥等),从中随机选取4头作为免疫应激组,4 h 内剖杀;运输应激组仔猪参照文献[6],采用敞篷车模拟公路运输4 h后剖杀,时速约为30 km/h,环境温度约为12℃;对照组不做任何处理,直接剖杀。剖检前用灭菌离心管采集猪血液备用,剖杀后迅速采集肝组织样品液氮速冻后保存于-80℃保存。
1.2.2肝组织RNA提取、cDNA合成、荧光定量PCR检测 使用TRIzol法提取肝组织总RNA,应用反转录试剂盒分两步进行反转录,第1步加入4× gDNA wiper Mix 4 μL, Total RNA 1 μg,加RNase Free H2O补齐至16 μL,42℃水浴2 min。第2步在第1步的反应液中加入5×HiScriptⅡqRT SuperMixⅡ4 μL,混匀后置于PCR仪,50℃反应15 min,85℃反应5 s,获得cDNA,将cDNA置于-20℃ 保存。荧光定量PCR采用SYBR GreenⅠ嵌合荧光染料法进行,反应体系:2× ChamQ Universal SYBR qPCR Master Mix 5 μL,上下游引物各1 μL,cDNA 1 μL,ddH2O 3.6 μL。避光混合反应体系,短暂离心后将样品置于Applied Biosystems StepOnePlus实时荧光定量PCR仪中进行反应。反应条件为:95℃预变性5 min;95℃变性30 s,60℃退火30 s和72℃延伸1 min,共40个循环。
1.2.3血清分离及酶联免疫吸附测定 待血液常温凝固2 h后于3 000 r/min室温离心15 min,取上清,分装后保存于-80℃ ,用于后续酶联免疫吸附测定。采用双抗夹心酶联免疫法测定IL-6;采用酶联免疫竞争法测定SAA、Apo-A1、AGP、pig-MAP,具体试验时严格按照ELISA试剂盒说明书操作。

2 结果
2.1 运输应激组肝组织细胞因子与急性期蛋白转录水平变化利用qPCR技术检测运输应激组肝组织细胞因子与急性期蛋白转录水平变化。结果如图1所示,与对照组相比,运输应激组肝组织IL-6表达量显著下降(P<0.05);IL-1β、TNF-α相对表达量无显著性改变;CRP、HP、SAA、pig-MAP表达量显著上升(P<0.05),其中CRP、SAA、pig-MAP表达量的增加极显著(P<0.01);AGP相对表达量无显著性改变;Apo-A1相对表达量极显著下降(P<0.01)。

图1 运输应激组仔猪肝组织细胞因子与急性期蛋白转录水平分析
2.2 运输应激组血清中细胞因子与急性期蛋白含量变化通过ELISA技术检测运输应激组血清中IL-6、SAA、AGP、Apo-A1、pig-MAP含量。结果如图2所示,同对照组相比,运输应激组血清中IL-6含量极显著降低(P<0.01);SAA、pig-MAP含量显著升高(P<0.05),其中pig-MAP含量的极显著升高(P<0.01);Apo-A1浓度显著降低(P<0.05);AGP浓度无显著性变化。
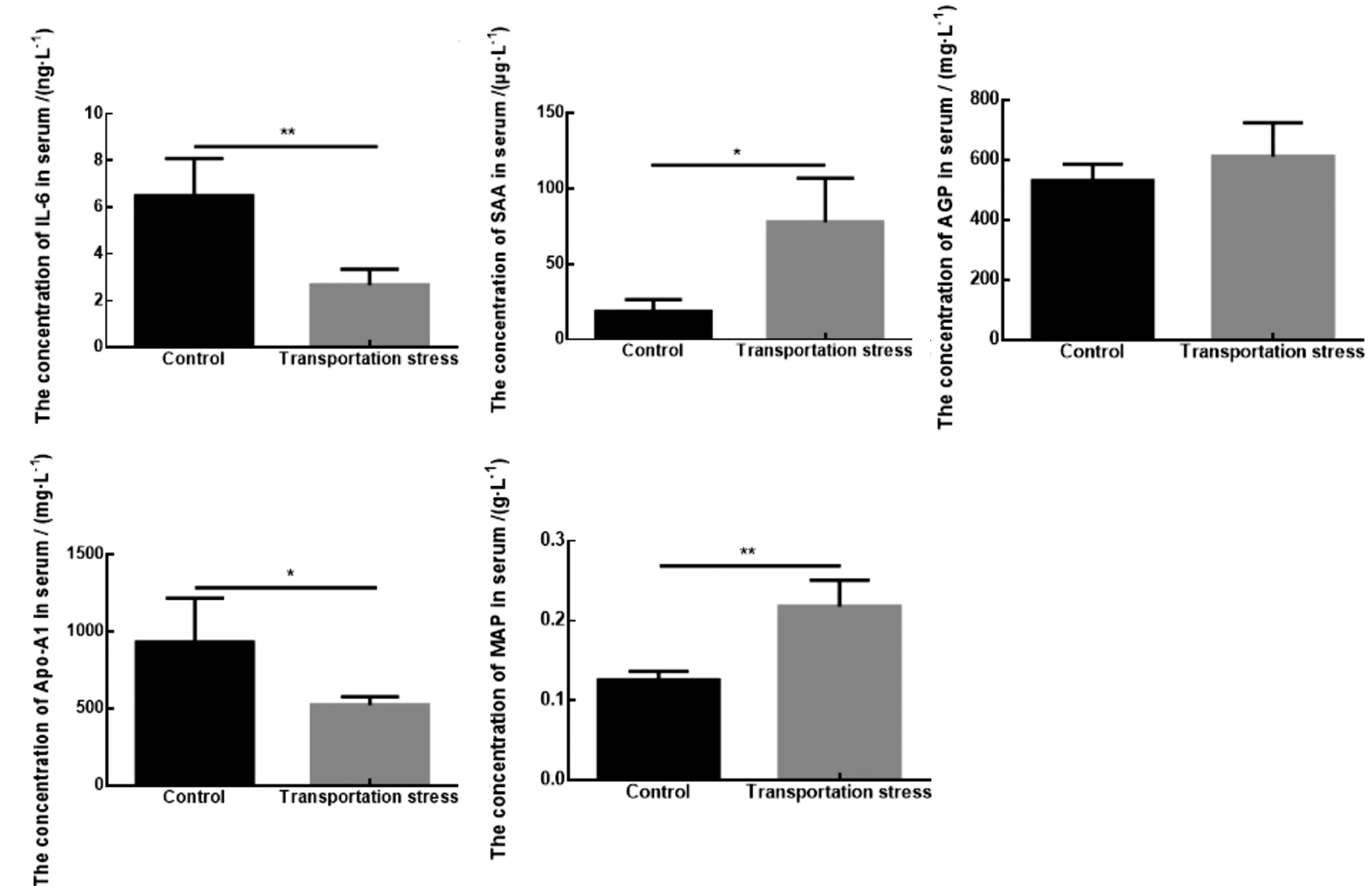
图2 运输应激组血清中细胞因子与急性期蛋白的浓度测定
2.3 免疫应激组肝组织细胞因子与急性期蛋白转录水平变化利用qPCR技术检测免疫应激组肝组织细胞因子与急性期蛋白转录水平变化。结果如图3所示,与对照组相比,免疫应激组肝组织IL-1β表达量极显著增加(P<0.01);IL-6相对表达量极显著增加(P<0.01);TNF-α相对表达量无显著性差异;CRP、HP、SAA、AGP表达量无显著性改变;Apo-A1相对表达量极显著下降(P<0.01);pig-MAP相对表达量显著增加(P<0.05)。
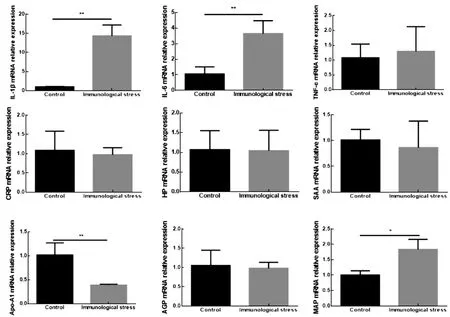
图3 免疫应激组仔猪肝组织细胞因子与急性期蛋白mRNA的表达分析
2.4 免疫应激组血清中细胞因子与急性期蛋白浓度变化通过ELISA检测免疫应激组血清中IL-6、SAA、AGP、Apo-A1、pig-MAP浓度。结果如图4所示,免疫应激组血清中IL-6浓度极显著高于对照组(P<0.01);pig-MAP浓度显著高于对照组(P<0.05);Apo-A1极显著低于对照组(P<0.01);SAA、AGP浓度与对照组无显著性差异。
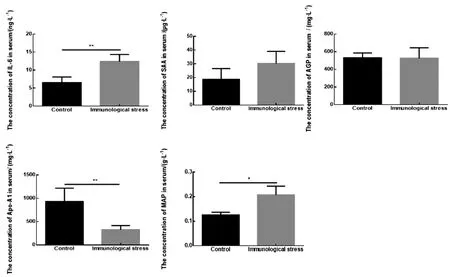
图4 免疫应激组血清中细胞因子与急性期蛋白的浓度测定
3 讨论
本试验以最常见的免疫应激与运输应激为对象,检测了在应激中研究最多的3种细胞因子。IL-1β、IL-6、TNF-α由单核细胞、巨噬细胞等细胞合成并分泌,可激发机体炎症、参与免疫,并可以刺激肝细胞生成急性期蛋白,在应激过程中有重要的作用[7],因此本试验以其作为检测指标。运输应激和免疫应激时,IL-6 mRNA表达都出现改变,但变化规律不同,利用ELISA检测血清中IL-6的浓度,结果显示与mRNA水平的变化一致。在许多有关应激的研究中,细胞因子在应激中表达变化也不相同,没有一个统一的变化规律。但是,也有研究表明IL-6可作为一个合适的应激标记物[8]。总的来说,细胞因子网络是一个稳态系统,受神经-内分泌-免疫网络的复杂调控,并受到应激原种类及强度的影响,在应激过程中处于一种动态的变化,导致各种应激研究中没有一个统一的变化规律。综上所述,细胞因子虽然在应激过程中有所变化,但是变化的方向及幅度受众多因素的影响,不适宜作为应激的检测指标。本试验中IL-6虽然在2种应激中出现了不同改变,但也可以作为猪场的一个预警指标,高于或低于正常水平都预示着机体处于不健康的状态。
本试验中,免疫应激组和运输应激组都出现了pig-MAP mRNA上调和Apo-A1 mRNA下调的现象,据此我们又利用ELISA检测血清中的浓度,结果显示与mRNA水平的变化一致。在前期试验中,通过滴鼻的方式使8周龄仔猪感染Ⅰ型胸膜肺炎放线杆菌引起猪应激,发现Apo-A1在应激时显著下调,pig-MAP虽未发生显著上调,但也有上升的趋势,这也与本次试验中两种应激的研究结果基本一致[9]。许多研究也认为急性期蛋白可作为猪应激的检测指标,但具体急性期蛋白的种类及组合不尽相同。HEEGAARD等[10]研究了3种细菌(胸膜肺炎放线杆菌、猪链球菌、猪滑膜支原体)、1种寄生虫(弓形虫)、1种病毒(猪呼吸和生殖综合征病毒)感染、1种无菌炎症引起的猪应激反应急性期的变化规律,最终结果显示最佳的3种蛋白质组合分别是CRP、ApoA1、pig-MAP和CRP、Apo-A1、HP,其次是2种蛋白质组合CRP、pig-MAP和Apo-A1、pig-MAP。本试验结果与之基本一致。CARPINTERO等[11]对非洲猪瘟和伪狂犬病的研究也发现,Apo-A1和pig-MAP 是适宜的检测指标。但SORENSEN等[12]对自然感染猪繁殖与呼吸综合征病毒、伪狂犬病病毒、猪圆环病毒2型和猪肺炎支原体的猪的研究,以及对患有尾巴和耳朵咬伤、关节炎和其他急性炎症的猪的研究表明HP是最佳的标志物,但是其研究中没有涉及Apo-A1的表达改变。CARPINTERO等[13]认为Apo-A1是一种敏感的急性期蛋白,可作为检测标志物。本试验通过2种应激模型及前期的感染试验得出MAP和Apo-A1是最适宜的应激检测指标,其中MAP是正向急性期蛋白,Apo-A1是负向急性期蛋白,这2种急性期蛋白在应激过程中的变化相反,也比只有正向或负向1种急性期蛋白更加有利的去检测应激。同时,急性期蛋白的半衰期比较长,应激发生后其浓度会迅速发生显著性变化,并可在48 h甚至更久的时间内维持较高水平,这也使其更便于检测[14-15]。Apo-A1和pig-MAP的组合相对于单一检测指标可以增加应激检测的准确性,相对于3个以上检测指标组合也可以节约时间和成本。
