高NEFA血症通过内质网应激加剧奶牛乳腺上皮细胞炎性通路的活化
2022-07-23岳锴铭蒲旭东高文文刘国文李心慰吉林大学动物医学学院吉林长春130062
岳锴铭,蒲旭东,高文文,刘国文,王 哲,李心慰 (吉林大学 动物医学学院,吉林 长春 130062)
酮病是围产期高产奶牛常见高发的能量代谢障碍疾病,围产期奶牛由于干物质摄入不足,启动泌乳等导致奶牛处于能量负平衡(negative energy balance,NEB)状态,进而导致脂肪组织的大量动员,脂解产生大量的非酯化脂肪酸(non-esterified fatty acids,NEFA),使血液中NEFA浓度显著升高,少量NEFA进入肝脏后能被完全氧化,而大量NEFA在肝细胞内发生不完全氧化,产生大量的酮体,进而导致奶牛酮病的发生[1-2]。酮病奶牛产奶量降低,乳品质受损,且乳腺存在明显的氧化应激和升高的非感染性炎症[3]。酮病奶牛脂解产生的NEFA约有1/2被乳腺上皮细胞吸收[4]。高浓度的NEFA具有显著的细胞脂毒性,所以酮病奶牛乳腺组织的高水平非感染性炎症可能与高浓度的NEFA有关,但需要进一步确证。奶牛乳腺上皮细胞(bovine mammary epithelial cell,BMEC)是负责奶牛乳腺中合成乳脂、乳蛋白的主要细胞[5]。内质网负责蛋白质的易位、折叠和翻译后修饰且参与脂质的合成[6]。当细胞代谢压力过大时,未折叠或错误折叠的蛋白质积聚,内质网的稳态被改变,从而引起内质网应激[7]。因此,当奶牛处于围产期,乳腺组织面临着巨大的泌乳压力,BMEC对内质网折叠蛋白和脂质生物合成功能的需求增加,易发生内质网应激。
内质网应激是细胞的防御性机制,短暂的内质网应激通过激活未折叠反应(unfolded protein response,UPR)和减少蛋白质聚集恢复蛋白质稳态,而长期或严重的内质网应激则会对细胞造成损伤[8]。已有研究表明,在肝细胞、胶质细胞、β细胞、巨噬细胞和肠上皮细胞中,内质网应激均参与炎性反应,是炎性反应的上游重要信号通路[9-11]。炎性反应是细胞的适应性机制,可以保护机体免受病原或其他异体物质的侵害。核因子κB(nuclear factor κB,NF-κB)是炎性反应的关键调控因子,参与了许多细胞内信号通路和遗传信息的转录调控。其中,p65与DNA的反式结合是NF-κB信号通路发挥作用的关键[12]。当炎性反应过度时,NF-κB信号通路被激活,细胞释放过量的炎性因子如肿瘤坏死因子α(TNF-α)、白介素- 6(IL-6)、白介素- 1β(IL-1β),导致组织损伤和生产性能下降[13]。
研究表明,高浓度的NEFA可以引起奶牛肝细胞的内质网应激和激活NF-κB炎性信号通路。目前,关于高浓度的NEFA对BMEC内质网和炎性通路影响的研究报道较少。本研究采用BMEC体外细胞模型,探究高浓度NEFA对BMEC内质网应激和炎性通路的影响及潜在机制,为揭示酮病导致乳腺组织损伤的机制提供数据支持。
1 材料与方法
1.1 主要仪器与试剂D-37520低温高速离心机购自德国Thermo Fisher公司;CO2细胞培养恒温箱购自日本三洋公司;通用型电泳仪购自美国Bio-Red公司;胶原酶Ⅲ购自索莱宝公司;DMEM/F12培养液、青霉素/链霉素、澳源特级胎牛血清购自Hyclone公司;NEFA、焦磷酸二乙酯(DEPC)、十二烷基硫酸钠(SDS)、牛血清白蛋白(BSA)、甘氨酸和双抗均购自Sigma公司;蛋白酶及磷酸酶抑制剂、RIPA裂解液、BCA法蛋白浓度测定试剂盒购自北京普利莱基因技术有限公司;TRIzol和反转录试剂盒购自TaKaRa公司;Lipofectamine 3000购自Invitrogen 公司;GRP78、P-p65、p65抗体购自Abcam公司;P-IRE1α、IRE1α、β-actin抗体均购自CST公司。
1.2 BMEC的分离与培养选用的荷斯坦奶牛均来自吉林省长春市某奶牛场。动物使用方案经吉林大学动物使用与护理伦理委员会批准。首先,对所有的奶牛都进行了常规体检,以确保没有其他并发症,然后挑选处于泌乳期(120±20)d的荷斯坦奶牛,从乳腺的右或左后1/4处采集乳腺组织样本。解剖后,从乳腺取出实质样本。将组织切成片状,用0.5%的胶原酶Ⅲ在38℃下消化3 h。溶液用74 μm的滤网依次过滤,并在4℃下以150×g离心10 min。将细胞培养于含有10%胎牛血清,500 μg/L氢化可的松、1 μg/L催乳素、10 μg/L表皮生长因子和100 IU/mL青霉素/链霉素的DMEM/F-12培养基中,置于37℃、5% CO2的培养箱中培养48 h。然后先用100 μmol/L的胰酶消化3min以去除成纤维细胞,再用胰酶消化5 min,将细胞传代培养,重复此操作以纯化上皮细胞。
1.3 BMEC的鉴定为了检验分离纯化的BMEC,使用免疫荧光分析检测BMEC中细胞角蛋白-18(CK-18)的表达情况。固定细胞后,用TritonX-100进行细胞打孔,用山羊血清封闭45 min,加入一抗孵育过夜,以荧光二抗孵育45 min后用DAPI染核,封片后镜下观察。
1.4 不同浓度NEFA处理BMEC将BMEC置于含有10%胎牛血清,5%青霉素/链霉素的DMEM/F-12培养基中,在37℃、5% CO2细胞培养箱内培养。将BMEC接种于6孔板中,加入含2% BSA的F12培养基,分别用浓度为0,0.3,0.6,1.2 mmol/L NEFA对BMEC进行处理。
1.5 细胞培养与重组慢病毒转染细胞针对IRE1α参考序列,根据RNAi序列的设计原则,设计合成IRE1α基因特异性shRNA,序列如表1所示,送往上海吉玛基因公司构建载体shIRE1α及其阴性对照shNC重组慢病毒质粒。使用含10% FBS的RMPI-1640培养液培养BMEC细胞,并置于37℃、5% CO2的培养箱中。待细胞生长至培养皿底面积的80%,用0.25%的胰酶常规消化细胞,调整细胞密度至1×105个/mL,接种至12孔板中,培养24 h后,将培养基更换为OptiMEM,按Lipofectamine 3000使用说明书方法将shIRE1α或shNC转染入BMEC,沉默IRE1α表达,6 h后将培养基更换为含10% FBS的RMPI-1640培养液,转染24 h后进行后续相关试验。BMEC转染试验分为4组,分别是shNC组,NEFA(1.2 mmol/L)+shNC组,shIRE1α组、NEFA(1.2 mmol/L)+shIRE1α组。

表1 shRNA序列及相关信息
1.6 Western blot法检测GRP78、P-IRE1α、IRE1α、P-p65、p65 将细胞置于冰上,加入1 mL预冷磷酸盐缓冲液(PBS),用细胞刮轻柔地将细胞刮下并收集于离心管内,洗涤细胞3次(4℃,800 r/min离心5 min),弃上清,加入适量含蛋白酶及磷酸酶抑制剂的RIPA细胞裂解液,冰上裂解30 min,每10 min充分振荡细胞以充分裂解,裂解完成后收集裂解上清(4℃,14 000×g离心10 min)。使用BCA法测定蛋白质量浓度,按照体积比4∶1加入5×蛋白上样缓冲液。95℃金属浴5 min使蛋白变性。按照电泳、转膜、封闭、一抗4℃过夜孵育、TBST洗膜(6 min,3次)、二抗室温孵育45 min和TBST洗膜(6 min,3次)的试验步骤进行Western blot。最后将PVDF膜放入数字成像仪,滴入适量显影液进行曝光。
1.7 qRT-PCR法检测GRP78、TNF-α、IL-6、IL-1β细胞总RNA的提取按照TRIzol试剂说明书进行操作,测定RNA质量浓度,取2 μg总RNA按照反转录试剂盒说明合成cDNA,采用Roche SYBR Green (ROX)染料法进行qRT-PCR,检测GRP78、TNF-α、IL-6、IL-1β的mRNA表达水平。
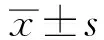
2 结果
2.1 BMEC的免疫荧光鉴定利用免疫荧光法对分离培养的BMEC中的骨架蛋白CK-18的表达进行检测。如图1所示,纯化后细胞的胞浆染为绿色,细胞核染为蓝色,表明细胞中有CK-18表达,证明所分离的细胞是上皮细胞。

A.蓝色荧光部分为染色的细胞核;B.绿色荧光部分为染色的CK-18;C.A与B叠加图像图1 免疫荧光法检测BMEC中CK-18的表达(标尺=10 μm)

表2 PCR引物序列及相关信息
2.2 不同浓度NEFA对BMEC的内质网应激的影响分别用浓度为0,0.3,0.6和1.2 mmol/L的NEFA处理BMEC 24 h。如图2所示,NEFA处理后,IRE1α磷酸化水平、GRP78的蛋白与mRNA水平呈现NEFA浓度依赖性升高,0.6,1.2 mmol/L NEFA处理组显著高于对照组(P<0.05,P<0.01)。

A.0,0.3,0.6,1.2 mmol/L NEFA刺激BMEC 24 h后P-IRE1α、IRE1α、GRP78的蛋白丰度;B.A中IRE1α磷酸化水平定量分析结果;C.A中GRP78蛋白水平定量分析结果;D.0,0.3,0.6,1.2 mmol/L NEFA刺激BMEC 24 h后BMEC中GRP78的mRNA表达水平图2 不同浓度NEFA对内质网应激的影响
2.3 不同浓度NEFA对BMEC的NF-κB信号通路与TNF-α、IL-6、IL-1β的mRNA水平的影响如图3所示,0.6,1.2 mmol/L NEFA处理组NF-κB p65的磷酸化水平,TNF-α、IL-6、IL-1β的mRNA水平显著高于对照组(P<0.01)。

A.0,0.3,0.6,1.2 mmol/L NEFA刺激BMEC 24 h后P-p65和p65的蛋白丰度;B.A中p65磷酸化水平定量分析结果;C.0,0.3,0.6,1.2 mmol/L NEFA刺激BMEC 24 h后TNF-α的mRNA水平;D.0,0.3,0.6,1.2 mmol/L的NEFA刺激BMEC 24 h后IL-6的mRNA水平;E.0,0.3,0.6,1.2 mmol/L NEFA刺激BMEC 24 h后IL-1β的mRNA水平图3 不同浓度NEFA对BMEC的NF-κB信号通路与TNF-α、IL-6、IL-1β mRNA水平的影响
2.4 IRE1α对内质网应激与NF-κB信号通路的影响如图4所示,与shNC组相比,shIRE1α组的IRE1α与p65磷酸化水平、GRP78蛋白水平显著降低(P<0.01);与NEFA(1.2 mmol/L)+shNC组相比,NEFA(1.2 mmol/L)+shIRE1α组的IRE1α与p65磷酸化水平、GRP78蛋白水平显著降低(P<0.05,P<0.01)。
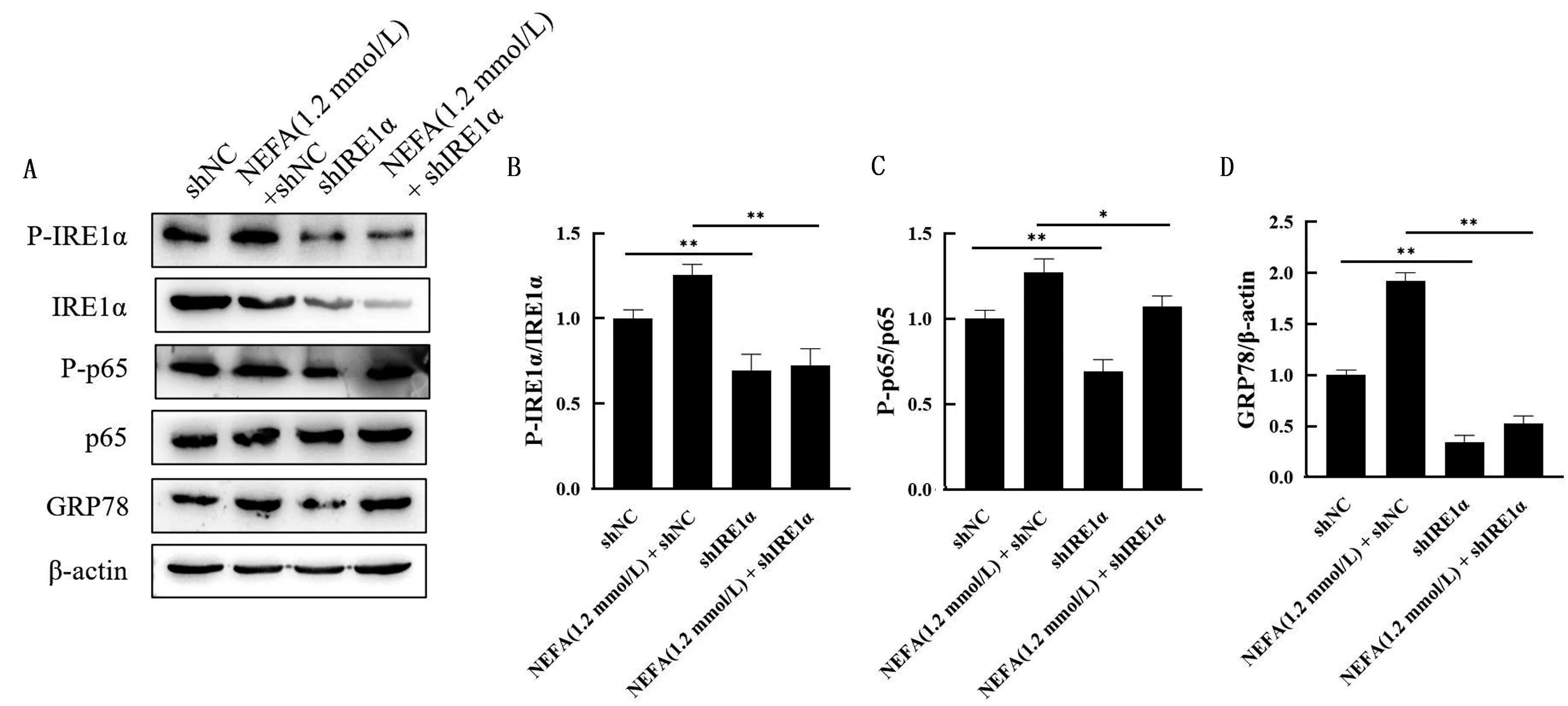
A.用1.2 mmol/L NEFA,shNC,shIRE1α分别以及共同处理BMEC后P-IRE1α、IRE1α、P-p65、p65和GRP78的蛋白丰度;B.A中IRE1α磷酸化水平定量分析结果;C.A中p65磷酸化水平定量分析结果;D.A中GRP78蛋白水平定量分析结果图4 IRE1α对内质网应激与NF-κB信号通路的影响
2.5 沉默IRE1α对BMEC中TNF-α、IL-6、IL-1β mRNA水平的影响如图5所示,与shNC组相比,shIRE1α组的TNF-α、IL-6、IL-1β的mRNA水平显著降低(P<0.05,P<0.01)。与NEFA(1.2 mmol/L)+shNC组相比,NEFA(1.2 mmol/L)+shIRE1α组的TNF-α、IL-6、IL-1β的mRNA水平显著降低(P<0.01)。

A.用1.2 mmol/L NEFA、shNC、shIRE1α分别以及共同处理BMEC后的TNF-α表达水平;B.用1.2 mmol/L NEFA、shNC、shIRE1α分别以及共同处理BMEC后的IL-6表达水平;C.用1.2 mmol/L NEFA、shNC、shIRE1α分别以及共同处理BMEC后IL-1β的表达水平图5 沉默IRE1α对NEFA诱导的BMEC的TNF-α、IL-6、IL-1β的mRNA水平的影响
3 讨论
围产期是奶牛酮病和脂肪肝等能量代谢障碍疾病的高发期,在此过程中奶牛乳腺面临着巨大的代谢压力,由于代谢紊乱,乳腺泌乳能力降低并引起一些病理损伤,例如酮病奶牛产奶量降低,乳腺非感染性炎症水平显著增加,进而加剧氧化应激等,这均与围产期奶牛的高NEFA血症密切相关[1-2]。因为酮病奶牛存在严重的能量负平衡,脂肪组织脂解产生大量的NEFA,高浓度NEFA具有细胞脂毒性,但NEFA是如何引起乳腺炎性水平增加的目前未见报道。
内质网是调节蛋白质生物合成、折叠、脂质生物合成、凋亡和钙稳态的重要细胞器[14]。GRP78是内质网应激的标志分子,能与UPR的中心分子PERK、ATF6、IRE1α相结合,使机体处于稳态[15]。当代谢压力过大时,细胞内蛋白质加工失调,大量未折叠或错误折叠的蛋白在内质网内蓄积,与GRP78竞争性结合PERK、ATF6、IRE1α,导致GRP78增多,造成内质网应激[16-17]。为了探究围产期奶牛高NEFA血症对BMEC内质网应激的影响,本试验使用不同浓度的NEFA处理BMEC,结果表明NEFA能够通过激活IRE1α通路加剧BMEC的内质网应激。此外,温佳楠等[18]报道BHBA也能够诱导永生化牛乳腺上皮细胞发生内质网应激。
IRE1是最保守的内质网应激传感器,能通过其C端胞质部分的激酶和核糖核酸内切酶活性调节炎性通路[19]。内质网应激和炎性反应都是由压力刺激引发的防御反应,然而,炎性反应是一把双刃剑,炎性反应释放的炎性物质可通过免疫和代谢途径靶向特定细胞,从而帮助激活适应性免疫,修复受损组织[8];但如果炎性反应长期持续,则会引发细胞功能障碍和死亡[20]。NF-κB是炎性反应的关键调节因子,它由5个成员组成,p50、p52、p65 (RelA)、c-Rel和RelB,其中p65是调控炎性反应的关键核转录因子,p65的过度活化及其效应分子的激活是许多慢性疾病发病机制的组成部分,如类风湿性关节炎、炎症性肠病、多发性硬化甚至神经退行性病变[21]。史晓霞[22]研究表明,NEFA能激活奶牛肝细胞的NF-κB信号通路,从而提高下游炎性因子的含量。此外,由于围产期巨大的泌乳压力,酮病奶牛的乳腺常伴随较严重的炎性反应[23]。本试验结果显示,NEFA能够使BMEC的p65磷酸化水平升高,激活NF-κB信号通路,从而诱导TNF-α、IL-6、IL-1β的mRNA水平增加,说明高浓度的NEFA可以激活BMEC的炎性通路。
最近的研究表明,内质网应激诱导的UPR信号能够激活NF-κB信号通路产生炎性因子TNF-α,进一步促进炎性反应[24-25]。此外,WEN等[26]报道,通过添加内质网应激诱导剂可以激活乳腺细胞系MCF-7 NF-κB信号通路引起炎性反应。因此,为了检测在BMEC中NEFA诱导的内质网应激对炎性反应的作用,本试验用shIREα转染BMEC,结果显示沉默BMEC的IRE1α后可以显著降低高NEFA所活化的NF-κB信号通路,p65磷酸化水平显著降低,TNF-α、IL-6和IL-1β的mRNA表达水平也显著降低。说明沉默IRE1α能够缓解NEFA所引起的乳腺上皮细胞的炎性反应,所以IRE1α是未来防控围产期奶牛乳腺炎性损伤的重要靶点,为筛选作用于内质网的药物奠定了研究基础。
综上所述,本研究发现NEFA能诱导BMEC产生内质网应激,并激活NF-κB炎性信号通路,引起炎性损伤,沉默IRE1α能够缓解NEFA所引起的乳腺上皮细胞的炎性反应。本研究为探究围产期奶牛高NEFA血症引起乳腺损伤的分子机制奠定了基础。
