非洲猪瘟病毒和猪圆环病毒2型双重SYBR GreenⅠ荧光PCR检测方法的建立
2022-07-23于新友李天芝王金良姚春阳沈志强山东绿都生物科技有限公司山东滨州56600山东省滨州畜牧兽医研究院山东滨州56600
于新友,李天芝,王金良,姚春阳,沈志强* (.山东绿都生物科技有限公司,山东 滨州 56600;.山东省滨州畜牧兽医研究院,山东 滨州 56600)
非洲猪瘟病毒(African swine fever virus,ASFV)感染猪后可引起非洲猪瘟(African swine fever,ASF),该病是一种烈性、高度接触性传染病[1]。临床表现为猪高热、呕吐、皮肤出血、血便[2],死亡猪剖检可见内脏各器官广泛出血[3]。ASV于2018年8月首次在我国沈阳某猪场被检出[4],至今在我国猪场流行已近3年时间,临床有变异毒株出现,病毒毒力变弱,猪场疫情逐渐缓和,一些猪场出现感染猪病死率低的现象[5]。猪圆环病毒2型(porcine circovirus type 2,PCV2)是圆环病毒科圆环病毒属成员[6],感染猪后可引起圆环病毒病,在世界猪群中广泛流行,临床表现为断奶仔猪多系统衰竭综合征、皮炎肾病综合征、母猪繁殖障碍、肠炎等[7]。PCV2是一种免疫抑制性病原,可导致猪免疫抑制[8]。PCV2可与多种病原混感,病原对外界环境抵抗力强,能耐受多种消毒剂,猪群一旦发病,很难从猪群中清除,给世界养猪业造成了严重的经济损失[9]。
疫苗中外源病毒污染不仅影响疫苗的有效性,给接种动物造成巨大的安全隐患,还可能会引起严重的生物安全问题[10],因此,一定要重视活疫苗中外源病毒的污染情况,保证使用纯净合格的疫苗。防止ASFV污染主要依赖生物安全和检测,最核心的就是防止病原通过人员、物料、车辆、生物制品等外来物品携带进场,因此,ASFV是当前进场疫苗的必检项目之一。疫苗生产中用到的胰酶多为猪源材料制备,发生PCV2污染的几率很高。疫苗成品中不应带有ASFV、PCV2等外源病毒污染,这2种外源病毒为成品疫苗出厂前或使用前必须检验的项目。亟需开发一种快速检测试剂盒,以满足实际疫苗快速品控需求。
荧光PCR 已作为一种快速、灵敏、便宜的检测方法被广泛使用,与传统PCR检测比,敏感性高,反应后不需要通过电泳检测PCR产物,减少了实验室发生气溶胶污染的风险。因此荧光PCR检验可作为生物制品外源病毒的一种检验手段。目前同时检测ASFV和PCV2 2种病原的双重SYBR GreenⅠ荧光PCR方法未见报道。为提升检测效率,本试验建立了一种能快速检测ASFV和PCV2的双重SYBR GreenⅠ荧光PCR检测方法。
1 材料与方法
1.1 质粒、毒株和检测样品含ASFV和PCV2特异性基因片段的质粒pMD-p72和pMD-ORF1由通用生物系统(安徽)有限公司合成;猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪乙型脑炎病毒、猪流行性腹泻病毒、口蹄疫病毒(从市售灭活疫苗中采用氯仿抽提获得)等由本实验室保存;伪狂犬病活疫苗样品为从市场购买的不同厂家生产的不同批次产品。
1.2 主要试剂和仪器SYBR Green Pro Taq HS预混型qPCR试剂盒购自湖南艾科瑞生物工程有限公司;Simply P病毒DNA/RNA提取试剂盒购自杭州博日科技公司;质粒小量制备试剂盒购自百泰克生物科技公司;MyGo Pro荧光PCR扩增仪购自青岛巴菲特生物公司。
1.3 引物设计与合成从GenBank中下载ASFV p72和PCV2 ORF1的基因序列,用分子生物学软件DNAStar进行分析,根据保守部分设计特异性引物,由通用生物系统(安徽)有限公司合成。
1.4 病原核酸的提取按试剂盒说明书提取猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪乙型脑炎病毒、猪流行性腹泻病毒、口蹄疫病毒等病原的核酸,-20℃保存备用。
1.5 双重荧光PCR检测方法的建立和优化将ASFV的干粉状引物F1、R1 和PCV2的干粉状引物F2、R2,分别用无菌超纯水稀释至15 μmol/L。按SYBR Green Pro Taq HS预混型qPCR试剂盒说明书配制反应体系,总体积为20 μL,其中2×SYBR Green Pro Taq HS Premix 10 μL,模板质粒pMD-p72 1 μL、质粒pMD-ORF1 1 μL,不断调整优化引物在反应体系中的加入量,用超纯水补足20 μL。以超纯水为模板的阴性对照,混匀后置于MyGo Pro荧光PCR扩增仪中。设定反应程序,分别以50,51,52,53,54,55,56,57,58,59,60℃等不同退火温度进行扩增反应。
1.6 灵敏度检测将合成的模板质粒pMD-p72和pMD-ORF1分别转化大肠杆菌DH5α,挑取阳性克隆,置于LB液体培养液中,37℃温箱振荡培养过夜,用质粒小量制备试剂盒提取质粒。测定浓度和纯度后,分别将质粒pMD-p72和pMD-ORF1 10倍比系列梯度稀释,作为模板加入到荧光PCR反应体系中,用建立的双重荧光PCR方法进行扩增。
1.7 特异性试验将1.6中稀释后的同浓度梯度质粒pMD-p72和pMD-ORF1等体积混合制备混合质粒pMD-p72/ORF1。分别以质粒pMD-p72、pMD-ORF1、pMD-p72/ORF1以及提取猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪乙型脑炎病毒、猪流行性腹泻病毒、口蹄疫病毒等病原的核酸为模板,用建立的双重荧光PCR方法进行扩增,检验方法的特异性。
1.8 重复性试验分别选取1.6中梯度稀释质粒pMD-p72和pMD-ORF 的3种稀释度样品为模板,每个稀释度设3个重复,分别进行双重荧光PCR检测,对熔解曲线Tm值进行分析,计算批内和批间变异系数。
1.9 干扰性试验为验证同一反应体系中模板浓度高的样本是否干扰浓度低样本的扩增效果,将质粒pMD-p72和pMD-ORF1按不同浓度配比组合(5.6×105和3.2×101copies/μL;5.6×101和3.2×106copies/μL;5.6×107和3.2×102copies/μL),组成质粒混合液,用建立的ASFV和PCV2双重SYBR GreenⅠ荧光PCR方法进行扩增。
1.10 临床样品采集与检验每瓶猪伪狂犬病毒活疫苗用2 mL生理盐水进行稀释,取1 mL疫苗以12 000 r/min离心2 min,取上清为模板,用建立的双重荧光PCR方法进行检测,并同时以国家标准GB/T 18648-2020规定的和中华人民共和国兽药典三部(2015年版)中提供的ASFV和PCV2的标准检测方法进行检测,比较分析其检测结果。
2 结果
2.1 引物的筛选通过大量试验,初步筛选出可同时检测ASFV和PCV2的引物组合,引物信息见表1。

表1 引物和探针序列及相关信息
2.2 双重荧光PCR检测方法的建立和优化PCR加样反应体系优化后,确立了体系中引物的最适加入量:20 μL反应体系中F1 0.7 μL、R1 1.0 μL、F2 0.8 μL和R2 1.5 μL;优化退火温度后确立的最佳退火温度为54℃;确立的荧光PCR反应程序:95℃预变性3 min;94℃变性5 s,54℃退火20 s (此处收集荧光),40个循环。扩增结束后,进行熔解曲线分析,步骤为以0.1℃/s的速率升温至97℃,连续收集荧光,绘制产物的熔解曲线(图1)。
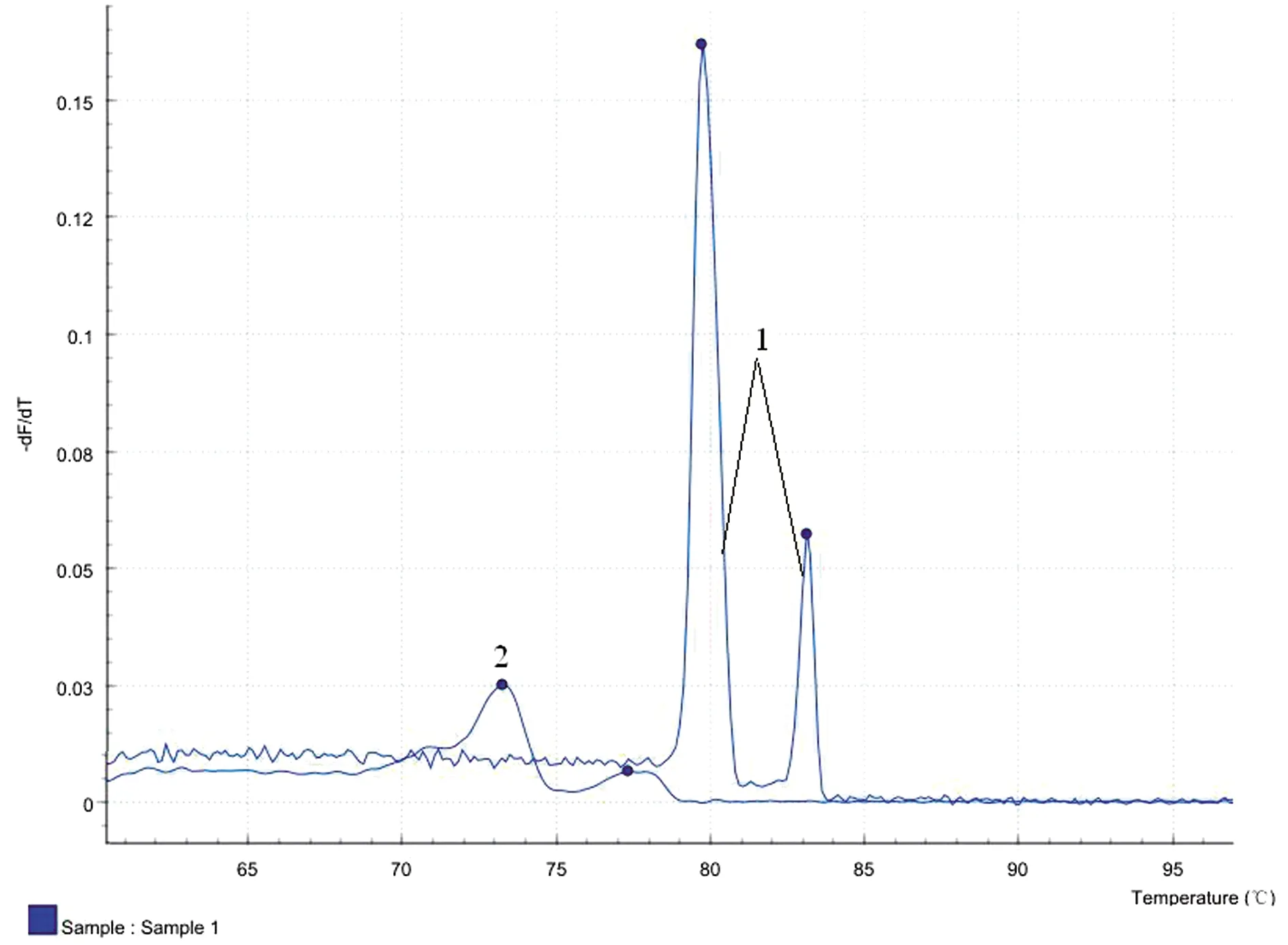
1.质粒标准品模板;2.阴性对照图1 双重荧光PCR反应熔解曲线分析
2.3 灵敏度检测测定质粒pMD-p72的浓度为5.6×109copies/μL,10倍比梯度稀释后,进行荧光PCR扩增反应,结果显示,对质粒pMD-p72的最低检测限度为5.6 copies/μL。测定质粒pMD-p72的浓度为3.2×109copies/μL,10倍比梯度稀释后,进行荧光PCR扩增反应,结果显示对质粒pMD-p72的最低检测限度为3.2 copies/μL。
2.4 特异性试验用建立的双重SYBR GreenⅠ荧光PCR方法进行检测,结果显示,质粒pMD-p72有特异性峰,Tm值为(83.16±0.5)℃,质粒pMD-ORF1有特异性峰,Tm值为 (80.12±0.5)℃,质粒pMD-p72/ORF1有双峰,Tm值分别为(83.16±0.5)和(80.12±0.5)℃。猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪乙型脑炎病毒、猪流行性腹泻病毒、口蹄疫病毒等核酸均无(83.16±0.5)或(80.12±0.5)℃特异性Tm值(图2),表明所建方法特异性良好,与其他病原基因无交叉扩增反应。
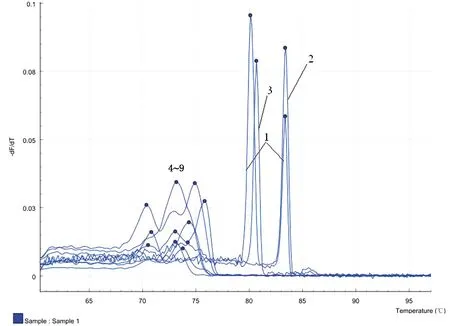
1.质粒pMD-p72/ORF1;2.质粒pMD-p72;3.质粒pMD-ORF1;4~9.分别为猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪乙型脑炎病毒、猪流行性腹泻病毒和口蹄疫病毒图2 双重荧光PCR扩增特异性
2.5 重复性试验质粒pMD-p72稀释后选取5.6×105,5.6×103,5.6×101copies/μL 3种不同浓度,每种浓度重复3次,进行双重荧光PCR检测。质粒pMD-ORF1稀释后选取3.2×105,3.2×103,3.2×101copies/μL等3种不同的浓度,每种浓度重复3次,进行双重荧光PCR检测。记录所检测样品Tm值,分别计算组内变异系数(CV)及组间变异系数。结果显示,2组质粒组内和组间变异系数均不超过于1%,表明方法具有良好的重复性(表2)。

表2 荧光PCR组内和组间重复性试验结果
2.6 干扰性试验2种高低不同浓度的质粒组合在同一PCR扩增体系中进行双重荧光PCR检测时,依然能检测出低浓度质粒样本,结果不受高浓度质粒干扰,表明所建方法适合临床混合样本中低浓度样本检测。
2.7 临床样品检测对收集的14份疫苗样本,采用建立的双重荧光PCR进行检测,结果显示ASFV阳性样本0份,PCV2阳性样本0份。同时参照相关国家标准GB/T 18648-2020规定和中华人民共和国兽药典规定的检测方法进行检测,结果显示,本研究建立的双重荧光PCR方法与这些检测的结果完全一致。
3 讨论
疫苗生产中需要用到细胞、血清、胰蛋白酶等动物源性材料,存在外源病毒污染的风险。传统外源病毒检测方法操作繁琐,费时、费力,亟需开发疫苗中外源病毒快速、简单的检测方法[11]。荧光PCR方法具有检测速度快、敏感性高、操作简便等特点,已经被广泛应用于各病原检测。荧光PCR方法可分为染料法和探针法2种,与探针法荧光PCR方法相比,染料法不需要合成昂贵的探针,研发成本低。染料法与探针法相比对,引物要求更高,双重PCR方法对引物的挑选更为严格,也是建立方法的关键。与探针法荧光PCR不同,染料法扩增结束后增加了一步熔解曲线分析,随温度升高,一半扩增产物发生解链时的熔解温度为Tm峰值,每个峰值代表不同产物。通过对Tm峰值的差别进行分析,可实现病原的多重检测,且对荧光PCR仪器要求低,通用性好。目前尚无检测ASFV和PCV2的双重SYBR GreenⅠ荧光PCR检测方法。
ASFV基因组是双链DNA,大小为170~190 kb,p72基因保守性好,在是ASFV分子检测常选用的靶基因[12]。ORF1基因编码PCV2复制相关蛋白,保守性好,是PCV2分子检测常选用靶基因。本试验建立的同时检测ASFV和PCV2的双重SYBR GreenⅠ荧光PCR方法,仅需40 min即可完成2种病原的快速筛查。双重荧光PCR检测方法能否成功建立,引物的设计非常关键,本试验通过大量引物筛选初步找到4条能用的引物,引物退火温度相近,引物之间不相互干扰,优化了各引物加入量,检测结果与单重荧光PCR一致,但可降低成本,减少繁琐的加样步骤。ASFV和PCV2的特异性Tm峰值分别为 (83.16±0.5)和(80.12±0.5)℃,方法特异性好,不与猪常见病原发生交叉反应。对ASFV和PCV2的最低检测限度为5.6和3.2 copies/μL。选取不同浓度ASFV和PCV2质粒样本测试,结果显示所建方法具有良好重复性,2组质粒模板的Tm值组内和组间变异系数均不超过于1%。应用双重荧光检测14份伪狂犬活疫苗样品,同时参照相关国家标准GB/T 18648-2020和中华人民共和国兽药典规定的检测方法进行检测,检测结果完全一致,但可节约时间,减少费用,提高检测效率。不同试剂和不同仪器扩增同一目标产物的Tm值可能会不同,有的偏差较大。本试验中2种病原的Tm值是使用现有的试剂盒和仪器得到的,但2种产物的Tm值差数不变。2种不同目标产物的Tm值虽有波动,但不超过1℃,而且2种产物的Tm值差在2℃以上,因此,可以在同一管中检测并区分ASFV和PCV2。本研究所建ASFV和PCV2双重SYBR GreenⅠ荧光PCR方法可用于这2种病原的快速检测,为疫苗中外源病毒的快速检测提供了一种简便的方法。
