酸性矿山废水微生物组时空演变特征及微生物-矿物互作机制
2022-07-22冯乙晴郝立凯郭圆徐绯徐恒
冯乙晴,郝立凯,郭圆,徐绯,徐恒
1. 中国科学院地球化学研究所/环境地球化学国家重点实验室,贵州 贵阳 550081;2. 中国科学院第四纪科学与全球变化卓越创新中心,陕西 西安 710061;3. 中国科学院大学, 北京 100049;4. 四川大学,四川 成都 610065
酸性矿山废水(Acid Mine Drainage,AMD)是以硫铁矿为主的矿石和尾矿暴露于空气、水等介质中,在由微生物主导作用下反应产生的低pH、高SO42−且富含各种重(类)金属的废水(Akcil et al.,2006;Moncur et al.,2009)。AMD会对受纳环境系统产生十分严重的危害,如加重岩溶含水层的污染(Ren et al.,2021),改变有毒金属的赋存形态并影响区域土壤微生物群落(Pan et al.,2021),是世界范围内最严重的环境问题之一(Simate et al.,2014)。
微生物是 AMD形成过程的主要驱动者,对AMD元素环境地球化学循环、生物成矿和污染修复具有重要作用(Johnson et al.,2003;Nordstrom et al.,2015)。尽管AMD酸度极高,但使用传统的培养方法和高通量组学方法,已鉴定出了多种多样的微生物,包括细菌、古菌和真核生物(主要是真菌和藻类)(Olsson et al.,2015;Chen et al.,2016;Abinandan et al.,2019;Abinandan et al.,2020)。近年来,微生物组学技术(基因组学、转录组学、蛋白组学、代谢组学、表型组学)的快速发展为原核微生物、真核微生物的群落多样性特征和时空演变特征研究打开了广阔视角(Edwards et al.,2000)。该技术能够识别微生物群落的基因、功能和代谢特征(Schloss et al.,2005;Sahoo et al.,2021),为AMD微生物群落、功能和代谢多样性的时空演变特征研究提供了技术支持,也为AMD生物处理系统的工程应用提供了理论支撑(Hallberg,2010;Villegas-Plazas et al.,2019)。
本文系统综述了微生物组学技术在AMD系统研究中的应用及其在不同时间序列(尾矿酸化过程、生物膜发育过程和生物处理过程及季节演替)和空间尺度(地理隔离、局部空间中的纵横分布、精细尺度)上的演变特征,分析了微生物群落在AMD系统铁硫生物地球化学循环和水体自净中的重要作用,进一步梳理了AMD系统中微生物-矿物相互作用的可能机制,最后提出了整合微生物组学技术和矿物学分析技术在AMD微生物生态演替、进化和应用研究中的展望,以期从生态学、地球化学和矿物学等多学科角度为AMD污染修复提供科学依据。
1 组学技术在AMD微生物学研究中的应用
1998年,Handelsman et al.(1998)首次将“宏基因组”定义为特定环境中全部微生物及其遗传信息的集合。自 2006年以来,随着高通量测序和质谱等技术的飞跃发展,以“DNA—RNA—蛋白质—代谢物”为中心法则的多组学技术(图1)彻底改变了微生物学领域。Stulberg et al.(2016)将微生物组定义为在特定环境下的多物种微生物群落,强调运用宏基因组技术对微生物从群落到功能、代谢等层面进行全面分析。此后,随着微生物生态研究的深入,转录组学、蛋白组学、代谢组学和表型组学等技术逐步发展并得到广泛应用。
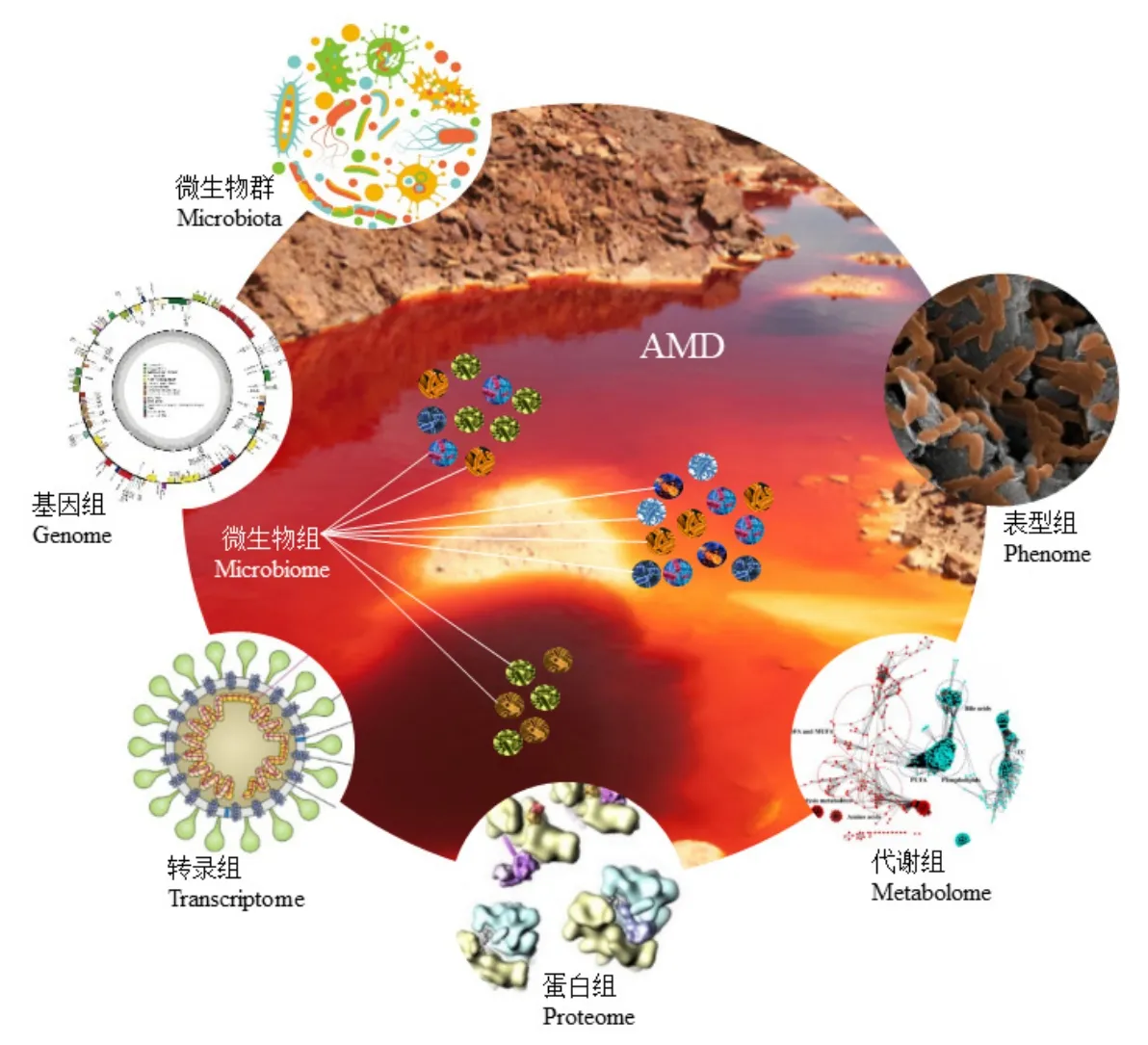
图1 多组学技术在AMD微生物生态学研究中的应用Figure 1 Application of multi-omics techniques in microbial ecology of AMD
宏基因组学有助于确定AMD系统中关键的微生物过程及其群落组成在不同的生态位之间的相互作用,并可指导AMD生物处理中的微生物群落组装以高效去除或提取水体中的金属元素(Allen et al.,2005;Desoeuvre et al.,2016;Liu et al.,2019c;Liu et al.,2019a;Liu et al.,2019b;Grettenberger et al.,2021;Pan et al.,2021)。2004 年,Tyson et al.(2004)运用宏基因组学技术从AMD生物膜中获得了完整的LeptospirillumⅡ和Ferroplasmatype Ⅱ基因组序列,以及LeptospirillumⅢ、FerroplasmatypeⅠ和G-plasma的部分基因组序列。此后,研究人员进一步发现变形菌门(Proteobacteria)、硝化螺菌属(Nitrospira)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、产水菌门(Aquificae)和候选糖杆菌(Candidate saccharibacteria)代表了 AMD微生物群落的主要谱系,其中铁硫氧化细菌——Acidithiobacillus(γ-Proteobacteria)、Leptospirillum(Nitrospirae)和Ferrovum(β-Proteobacteria)为优势属(Hua et al.,2015;Méndez-García et al.,2015;Chen et al.,2016)。
转录组学研究识别了可以解释极端微生物功能特征的基因序列,其中部分序列可能是通过水平基因转移获得的,如已被确定的Galdieria suluraria(Schönknecht et al.,2013)和嗜酸Chlamydomonas eustigma(Hirooka et al.,2017)的基因组序列。此外,该组学研究还揭示了嗜酸微藻在酸性和富金属环境中生存的独特基因,强调采用多组学方法(图1)进行系统研究的必要性,以明确重金属毒性和微生物适应性反应之间的分子机制(Olsson et al.,2015;Long et al.,2016;Puente-Sánchez et al.,2016;Olsson et al.,2017;Tripathi et al.,2021),以及AMD系统中常见和稀有原核生物的生态作用(Hua et al.,2015)。
蛋白质组学研究证明了AMD系统中金属抗性和耐酸性蛋白的重要性,表明与特异性功能相关的基因片段和与某种功能相关的蛋白质组分之间存在差异,这可能是微生物在极端酸性、富金属环境中适应特定生态位的关键机制(Tyson et al.,2004;Ram et al.,2005;Lo et al.,2007;Zhang et al.,2019),而代谢途径和基因表达谱重建分析揭示了其潜在的生理机制(Anantharaman et al.,2016;Long et al.,2016)。例如,Whitaker et al.(2006)发现了AMD生物膜群落中的单核苷酸多态性,揭示了极端条件下微生物群落的种群动态和进化;Xie et al.(2011)通过分析微生物对AMD金属胁迫的代谢特性,发现菌株对高浓度 Cu的耐受性响应是下调氨基酸代谢途径,以此作为其在AMD中的一种生存机制;还有研究发现,微生物可通过调节膜脂质成分来应对极端酸性环境胁迫(Dean et al.,2019)。
运用表型组学可进一步直观揭示AMD环境中微生物-矿物作用(Microbial-mineral Interaction,MMI)特征,研究发现MMI是驱动AMD表型性状(如离子强度、pH、pO2、ORP等)演化的主要作用力,促使其积累异质性较大的次级产物或中间产物,以及形成时间和空间序列上的离子和pH梯度(Xia et al.,2020),最终导致AMD系统微生物群落、功能、代谢等的演化。
组学技术在 AMD系统微生物生态学研究中的广泛应用为 AMD生物处理中微生物菌群组装提供了理论指导,同时有助于生物浸矿技术的开发和应用。
2 AMD微生物组时空演变特征
微生物群落的形成过程取决于空间、时间及系统发育尺度,不同的生态过程可能在不同规模的生态系统上占主导地位,研究AMD微生物组的时空演变特征有助于明确哪些生态过程对微生物群落的构建具有重要作用(Ladau et al.,2019)。基于生态位的微生物群落形成过程由环境的多样性模式和 pH、氧化梯度等环境化学梯度变化主导(Lozupone et al.,2007),而基于尾矿酸化过程(图2a①)、生物膜发育过程(图2c)、生物处理过程(图2d)和水热驱动的季节演替(图2a、b)的不同时间序列及基于局部(图2a②、③、④)和精细空间尺度的AMD系统所提供的生态位独特多样,适应极端酸性和有毒金属环境的微生物能够在这些独特的生态位上进行活跃的代谢。AMD生物处理是一个多尺度的复杂问题,借助微生物组学技术可以充分理解其复杂的微生物群落结构是如何发挥作用的,及其组分在各自的生态位上的作用规律,从而为AMD生物处理提供生态学理论指导。
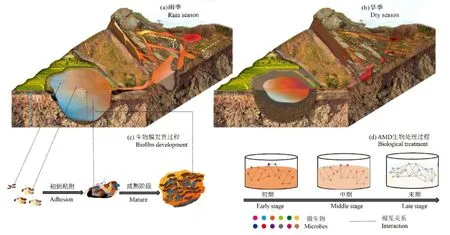
图2 AMD微生物群时空演变特征Figure 2 Spatio-temporal evolution characteristics of microbiota in AMD
2.1 AMD微生物组在不同时间序列上的演变特征
2.1.1 不同尾矿酸化过程
矿山尾矿酸化是AMD的主要成因。研究人员大多采用空间替代时间(图2a①)的方法对与尾矿酸化相关的微生物多样性和群落功能的动态变化进行研究(Huang et al.,2011;Chen et al.,2013;Liu et al.,2014;曹子敏等,2019),结果表明,大多数优势菌系的α多样性和相对丰度与pH值具有显著相关性,pH在调节嗜酸微生物群落结构和功能方面具有重要性(Belnap et al.,2011a),尾矿酸化的不同阶段具有不同的微生物群落组成特征(Tan et al.,2008;Belnap et al.,2010;Belnap et al.,2011b;Chen et al.,2013;Dean et al.,2019;Abinandan et al.,2020)。例如,未发生酸化的尾矿中的微生物种群与中酸性或极酸性尾矿中的微生物种群具有显著差异,古菌、A. ferrooxidans和Leptospirillumspp.的丰度在黄铁矿发生氧化前很低(Huang et al.,2011);而在极酸性尾矿中,Ferrovum成为优势种群,其在铅锌矿尾矿的生物地球化学过程中具有重要作用(Tan et al.,2008;Huang et al.,2016)。也有研究表明,AMD微生物多样性在体系pH 低于3.0时才出现显著下降(Chen et al.,2014)。值得注意的是,AMD系统微生物群落Simpson多样性指数的结果符合中期物种丰富度假说(Howard et al.,2003),即尾矿酸化中期微生物物种最丰富。最后,在AMD自然衰减过程中,由于酸胁迫程度降低,产酸铁硫氧化菌和(类)金属相关菌群以及特定菌群的丰度呈上升趋势(Liu et al.,2019c)。
2.1.2 不同生物膜发育过程
AMD系统中微生物群落结构、代谢过程和功能表达均以生物膜为发生场所(Denef et al.,2010)。生物膜发育一般经历初始粘附阶段(低发育)、成熟阶段(高发育)和分离阶段,而不同基因型微生物群体在生物膜发育的不同阶段占主导地位(图2c)(Wilmes et al.,2009a;Liu et al.,2020),表明这种群落分化可能引发不同的生态策略(Denef et al.,2010)。在生物膜中观察到的微尺度上的异质性反映了AMD生态系统中微生物群落的高度多样性(Simmons et al.,2008;Yelton et al.,2013;Røder et al.,2019;Pandey et al.,2021),证明了 AMD细菌和古菌在相对较短的时间尺度(几年)上通过突变、迁移和基因重组(包括质粒或噬菌体的水平基因转移)发生进化(Yelton et al.,2013)。在生物膜低发育阶段,来自嗜铁氧化的LeptospirillumⅡ细菌的蛋白质占据蛋白质组的绝大多数;而在成熟阶段,生物膜定植体蛋白质丰度较高,古菌占据优势地位(Mueller et al.,2010),此时生物膜上的微生物具有更多样的异养代谢过程(Wilmes et al.,2009b;Justice et al.,2012)。快速的适应性进化促使LeptospirillumⅡ 种群成为成熟生物膜中的主要初级生产者和最活跃的铁氧化菌,从而推动了AMD的形成(Denef et al.,2012)。
2.1.3 不同生物处理过程
微生物是AMD生物处理器的主导者,而生物处理效率的提高有赖于对其群落组成、功能和基因的深入探析。在 AMD生物处理过程中,系统 pH逐渐上升,微生物群落的结构和丰度都发生了变化(图2d)(彭玙萍等,2020),其中,古菌总数量在不同生物处理阶段之间波动,真菌群落丰度则随着处理时间的推移出现波动或下降,而细菌丰度呈先上升后下降趋势(Drury,1999;Deng et al.,2016;Coral et al.,2018)。在连续搅拌槽式反应器中,由于厌氧环境不适合某些微生物生存,微生物丰度在生物处理过程中呈逐渐下降趋势(Akinpelu et al.,2021)。此时,严格厌氧和兼性厌氧的厚壁菌门微生物之间表现出协同作用,从而成为AMD生物处理器中的优势菌群(Kamika et al.,2014;Méndez-García et al.,2015;Teng et al.,2017),尤其是芽孢杆菌(Bacilluspp.),对AMD的极酸性具有较高的适应能力,是对受污染环境进行生物修复的理想材料(Coral et al.,2018;Akinpelu et al.,2021)。随着AMD生物处理进程的推进,携带关键功能基因的微生物种群丰度和多样性不断增加,尤其是硫酸盐还原菌(Lin et al.,2021)。
2.1.4 季节演替
水热驱动的干湿季变化导致 AMD环境条件(温度、养分、水量补给等)出现季节性变化(图2a、b)(Fonyuy et al.,2008),其微生物群落多样性、优势种群一般也随之发生相应的季节性变化(Baker et al.,2009;Tan et al.,2009;Hao et al.,2017;Xin et al.,2021)。雨季AMD生物膜易被雨水冲洗,依附生物膜生长的特定菌群的多样性可能会下降(Denef et al.,2012)。例如,加利福尼亚州铁矿AMD生物膜中细菌种群比例以1月份的最高(95%),真核生物几乎不存在;而古菌群落比例以7月和9月的最高(50%),冬季几乎不存在。研究揭示了细菌和古菌种群变化与电导率和降雨量存在相关关系(Edwards et al.,1999)。对安徽省南山受AMD污染湖泊的研究也证实了原核生物群落和真核生物群落均表现出强烈的季节性变化,其中真核生物群落季节变化比原核生物群落变化更剧烈;光自养藻类(初级生产者)与原生动物或鞭毛虫(顶级消费者)为适应四季更替形成了独特的食物网,温度是主导这些微生物群落季节性变化的环境因子;棕鞭藻和衣藻(导致冬季高水华)因生长温度不同,分别出现在秋夏季和冬春季(Hao et al.,2017;Xin et al.,2021;裴理鑫等,2016;曹子敏等,2019)。Lake Paitu的原核生物组成存在明显的季节变化,但在大多数季节,Ferrovum是主要的铁氧化细菌;衣藻是该湖泊主要的真核生物,在 12月底高度繁殖,为异养细菌提供了丰富的营养物质(Xin et al.,2021)。而在樊口尾砂氧化带和氧化锋中,以嗜酸Ferroplasma acidiphilum为主的古菌是该矿区土著原核微生物的优势物种,季节变化虽未导致土著微生物群落组成发生显著变化,但春季微生物多样性指数显著高于冬季,且优势物种丰度也发生了一定变化(Huang et al.,2011)。
2.2 AMD微生物组在不同空间尺度上的演变特征
2.2.1 地理隔离
AMD系统微生物生态学的相关研究表明,pH是主导AMD微生物群落组成、功能和代谢的决定性因素(Sul et al.,2011;Kuang et al.,2013;Huang et al.,2016)。尽管地理距离较远且基质类型不同,AMD系统微生物主要群体均为嗜酸菌(Sul et al.,2011;Huang et al.,2016)。从尾矿(Gupta et al.,2017)、矿坑(Gonzalez-Toril et al.,2013)、地表水(Villegas-Plazas et al.,2019)、沉积物(Jin et al.,2022)、土壤和孔隙水(Pan et al.,2021)等不同的AMD环境中分离出的微生物,其16S rRNA序列具有高度相似性(Edwards et al.,2000;Golyshina et al.,2000;Kuang et al.,2013;谢学辉等,2009),主要类群均为变形菌门、酸杆菌门、厚壁菌门、硝化螺旋菌门(Nitrospirae)、放线菌门和广古菌门(Euryarchaeota)等,参与这些类群的能量生产、营养代谢和生物反应的基因是该微生物群落结构的主导基因。而来自世界各地的AMD系统的微生物群落的16S rRNA基因测序数据表明,AMD水体及生物膜中的微生物群落多样性通常低于受其影响的土壤/沉积物及生物反应器中的(Villegas-Plazas et al.,2019)。地理隔离导致的不同AMD空间类型对微生物群落异质性的贡献有限(Kuang et al.,2013)。然而,AMD环境中的微生物谱系并不是随机分布的,而是在更小的空间尺度上呈现出更强的系统聚类趋势。
2.2.2 局部空间
2.2.2.1 水平分布
在AMD特定地点的连续性空间中(图2a②),其环境地球化学条件常沿水平方向存在多个梯度分布,如河流上游—下游、梯田下层—上层(刘帆等,2019),导致其微生物群落结构和功能基因,如异化亚硫酸盐还原酶基因(Moreau et al.,2010)、砷相关基因(Desoeuvre et al.,2016),沿环境化学梯度呈多样性分布。研究人员采集了AMD单向径流上游和下游两个位点(相距约140 m)的生物膜进行研究,发现LeptospirillumⅢ 基因型在上游生物膜中占据主导地位,在下游采集的3个生物膜中仅有1个出现同类现象,而即使上下游位点都存在LeptospirillumⅢ,其基因组也是不同的(Denef et al.,2012)。在铀浓缩厂的入口和出口处,氧化还原梯度变化塑造了原生含水层厌氧、微氧生境中的微生物群落结构,AMD的注入使这些微环境中的微生物群落结构发生了剧烈的变化,细菌丰度和多样性都出现大幅下降(Coral et al.,2018)。在受AMD污染梯田中,上层田土壤微生物种群以酸杆菌占优,而下层田以广古菌占优,金属杆菌(Metallibacterium)、钩端螺杆菌(Leptospirillum)和微古念珠菌(Candidatus microrarchaeum)显著富集于下层田中,富集在较低层区域的细菌类群具有不同的代谢策略,其固碳和硫氧化过程相对活跃(Xu et al.,2020;Sun et al.,2020b)。在 AMD 汇入河流中,从上游站点的样本中鉴定出的操作分类单元(Operational Taxonomic Unit,OTU)数量更多,微生物多样性也更高(Pan et al.,2021)。
2.2.2.2 垂直分布
在受AMD污染的水体(图2a③)和土壤(图2a④)/沉积物中,通常存在多个环境化学条件的垂直分布梯度,这种垂直环境梯度驱动了微生物群落多样性和结构的分化,而pH值是影响该垂向空间微生物分布格局的关键驱动因素(Gao et al.,2020;She et al.,2021a;Zhou et al.,2022)。相关研究表明,与自然水体的分层相比,AMD湖泊中pH、重金属和硫酸盐浓度等的化学分层通常较显著。底层水体由于环境选择压力较小,微生物群落多样性和丰度较高(Torres et al.,2015;Salmon et al.,2017;She et al.,2021a)。原核微生物群落结构在AMD湖泊水体垂直梯度上存在显著变化,微生物多样性随深度增加而增大,其中变形菌门在表层水中占主导地位,厚壁菌门和广古菌门则富集于底层,这是由于上层水体承受的酸胁迫较强,导致微生物的环境选择压力突出,故微生物多样性显著降低,物种共现频率升高。这种由酸胁迫主导的环境效应驱动了湖泊AMD微生物群的聚集和共存,奠定了AMD湖泊微生物群落功能的垂向分布格局(España et al.,2009;Cerón et al.,2014;Falagán et al.,2014)。此外,光强度、溶解氧和有机质含量的垂直变化亦对 AMD水体微生物的群落的分布具有重要影响(Grettenberger et al.,2020;She et al.,2021b)。同样地,在AMD污染土壤中,酸性水在土壤垂直剖面上引起的地球化学梯度改变了有毒金属形态,并富集了适应不同环境化学条件的土壤微生物群落(Li et al.,2019;Pan et al.,2021)。
2.2.3 精细尺度
在精细尺度上研究微生物群落组成和物种丰度的变化有助于准确判定驱动群落结构变化的决定因素(Doney et al.,2012;Stocker,2012)。目前,在AMD系统中进行精细尺度上的微生物群落研究鲜有报道,以Liang et al.(2017)研究为代表,其将采样量定义为不同的独立空间尺度,研究了不同精细空间尺度(1 mL—10 L)下AMD微生物群落组成的变化。结果表明,在门水平上,大尺度样品中广古菌门的相对丰度明显高于小尺度样品中的,而厚壁菌门的相对丰度则呈现相反的趋势;在属水平上,γ-Proteobacteria和Nitrospira的相对丰度在不同空间尺度上存在显著差异,而α-Proteobacteria的丰度在不同空间尺度上保持相对稳定。微生物群落组成具有明显的空间体积依赖性,空间尺度差异越大,样品间微生物群落组成差异越显著。研究推测,群落组成在精细尺度上的异质性可能是共存物种之间相互作用的结果(Stocker,2012),生物和生态相互作用驱动细菌群落重组的速率比水体本身的物理运动速率更快(Yannarell et al.,2004;Yannarell et al.,2005;Lear et al.,2009)。
3 微生物驱动的AMD系统Fe-S生物地球化学循环
在AMD生态系统中,铁和硫的微生物氧化是产生 Fe3+和 SO42−的重要地球化学过程,且在特定环境条件下,铁还原菌(IRB)和硫酸盐还原菌(SRB)可以还原Fe3+和SO42−,完成该生态系统的铁硫循环(Baker et al.,2003;Schippers et al.,2010;Sahoo et al.,2021)。在pH<3的AMD中,铁硫元素的氧化以微生物作用为主,如氧化亚铁钩端螺旋杆菌(Leptospirillum ferrooxidans)(Vera et al.,2013)、氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)(Feng et al.,2022)等均能加速金属硫化矿的氧化,该微生物氧化速率比化学氧化速率高30—300倍(Nordstrom et al.,2018)。AMD酸度沿水流方向逐渐衰减,水体中的 Fe3+和 SO42−在该衰减过程中极易发生再沉淀,形成多种铁硫次生矿物。此过程消耗了水体中部分O2和H+,致使AMD水体出现局部相对厌氧和中性环境,为Citrobactersp.、Geobacter、Acidiphilium、Desulfovibrio、Thiomonas和Halethiobacillus等IRB和SRB的生长、代谢创造了生存条件(Garcia-Rios et al.,2021;汪涵,2018;姜梦戈,2020)。这些次生矿物的稳定性差,而Fe-S功能微生物群的存在使得AMD中的次生矿物极易发生矿相转变,形成结晶度更高的赤铁矿、针铁矿等(Bao et al.,2018)。此外,在AMD生物修复过程中,铁氧化菌可充分将 Fe2+及其他重金属元素氧化,进而通过吸附、沉淀去除AMD系统中的金属元素;在外源有机物支持下,AMD水体SRB可高效还原SO42−,促进金属硫化物沉淀从而净化 AMD(方迪等,2010);同时,该过程产生的碱度(HCO3−)可提高处理水体 pH(Senko et al.,2009;Deng et al.,2016;Singh et al.,2022;方迪等,2010)。
近些年来,研究人员对硫化矿的地球化学和微生物学进行了大量研究,以了解AMD生态系统中微生物群落和功能多样性的形成机制(Moreau et al.,2010;Giloteaux et al.,2013;Méndez-García et al.,2015;Quatrini et al.,2018;Sun et al.,2020a;Qian et al.,2021)。研究表明,影响AMD污染梯田微生物多样性和相互作用的主要环境因子是pH、Fe(Ⅲ)和硫酸盐(Xu et al.,2020)。在受AMD长期影响的水体中,铁和硫代谢微生物占主导地位,是介导硫酸盐矿物转化的功能微生物(Bao et al.,2018),同时不同的嗜酸性微生物群在极端酸性环境中占据不同的生态位,进而通过对铁和硫的代谢作用反作用于酸性环境(Xin et al.,2021)。例如,β-Proteobacteria中的Ferrovum在AMD环境中具有重要的生物地球化学循环作用,主要是促进铁的快速氧化(Hallberg et al.,2006;Havig et al.,2017),常与异养嗜酸菌或其他铁氧化菌共存(Kipry et al.,2013);Leptospirillum也可能参与金属和硫代谢,一般认为其为携带异化硫酸盐还原基因的铁氧化菌(Goltsman et al.,2009)。特定AMD系统的不同位点中总S和 SO42−含量的显著变化可能导致硫代谢微生物群落和功能的差异。随着 SO42−浓度的降低,与S循环有关的功能基因dsrAB和aprAB的丰度也相应降低,表明较高的 SO42−浓度可能促使硫酸盐发生生物还原反应(Sun et al.,2020a)。总Fe和 Fe(Ⅲ)均与 S氧化、SO42−还原显著相关,表明铁代谢相关微生物对S的地球化学循环具有影响(Valente et al.,2008;Chen et al.,2014;Liu et al.,2014;Sun et al.,2020a;Pan et al.,2021)。
综上所述,AMD系统Fe-S生物地球化学梯度对微生物群落结构和功能具有显著的影响,而铁和硫的相关微生物种群对环境梯度变化的响应又驱动Fe-S生物地球化学循环。
4 微生物对AMD生物成矿的控制机制
4.1 矿物在AMD系统中的演变特征及环境效应
AMD环境中矿物的种类、赋存状态、理化性质决定了其污染潜力和环境危害性(Gomes et al.,2006;Valente et al.,2009),其性能由其所处环境的地球化学条件决定(Valente et al.,2013;Meng et al.,2014),如离子浓度、酸度、水含氧量等。微生物介导了AMD硫化矿物溶解(McGuire et al.,2001),同时,原生矿物再沉淀形成次生矿物的过程也与微生物作用密切相关(Clarke et al.,1997;Sanchez-Espana et al.,2011;Caraballo et al.,2019)。铁元素广泛存在于金属硫化矿中,因此铁氧化物矿物是最普遍的次生矿物,主要包括赤铁矿、施氏矿物、黄钾铁矾和针铁矿等。这些次生矿物具有巨大的比表面积、丰富的表面官能团、较强的吸附能力和良好的沉淀作用,可在不同pH条件下吸附、络合、共沉淀AMD系统中的金属元素,实现水体自净(Burgos et al.,2012;Ayora et al.,2016;Baleeiro et al.,2018;Zhang et al.,2021;周立祥,2008)。
近年来,对AMD系统铁相次生矿物的类型、特征、形成条件和环境响应等方面进行了大量研究,发现IRB和SRB都能介导施氏锰矿石和黄钾铁矾的转化(Senko et al.,2009;Coggon et al.,2012;Carbone et al.,2013),微生物活性是驱动AMD河流沉积物中施氏矿物、黄钾铁矾转化为针铁矿的主要作用力(Bao et al.,2018),针铁矿的沉淀和相变过程在控制AMD有毒微量金属的环境化学行为中发挥着重要作用(Jiang et al.,2013;Kim et al.,2014;Baleeiro et al.,2018;Hajji et al.,2019;Kim et al.,2021)。然而,在多变的地球化学条件下,某些相变是可逆的,如施氏矿物可能转化为针铁矿或黄钾铁矾,黄钾铁矾可能被针铁矿或施氏矿物取代(Samborska et al.,2013)。若环境中缺乏足够的钾,则可能形成黄铵铁矾或草黄铁矾等;若环境中含有较多的 PO43−,可能形成红磷铁矿等磷酸盐矿物(Lu et al.,2019)。pH<3时,富含Na+、K+、NH4+等一价阳离子的 AMD,在微生物诱导下容易形成黄铁矾类矿物;当AMD中一价阳离子浓度较低时,则易形成施氏矿物(Zhu et al.,2012;Vithana et al.,2015;周立祥,2008)。微生物促使 AMD铁硫次生矿物发生矿相转变的第一步是Fe(Ⅲ)的还原(Bao et al.,2018),在pH较高和相对厌氧环境中,IRB和SRB直接将次生矿物中的Fe(Ⅲ)还原为 Fe(Ⅱ)(Jones et al.,2006;Ouyang et al.,2014)。第二步是稳定相矿物的形成(Ouyang et al.,2014),微生物还原产生的Fe(Ⅱ)极易被吸附在不稳定相矿物表面,在厌氧条件下与矿物中的Fe(Ⅲ)发生电子转移,从而催化针铁矿的形成(Burton et al.,2007)。
微生物作用类型及环境化学微环境决定了生物成矿的终点物质的类型、形态和性质(Rodriguez-Navarro et al.,2007;Baumgartner et al.,2013;Hasiotis et al.,2019),同时,MMI驱动了AMD矿物的演变过程、相变平衡及金属元素赋存形态的动态变化,对AMD污染水体净化具有重要作用(Liu et al.,2018;Lu et al.,2021;刘奇缘等,2017)。
4.2 AMD微生物-矿物相互作用机制
AMD微生物成矿作用是生物和非生物反应相互作用的结果(Melton et al.,2014)。AMD系统元素地球化学行为受次生矿物的反应(如氢氧化铁的溶解)的强烈控制(Elghali et al.,2021),而微生物可以通过直接或间接氧化还原反应参与 AMD铁生物地球化学循环(Melton et al.,2014)。大部分可溶性Fe(Ⅱ)和Fe(Ⅲ)与溶解有机物络合充当电子穿梭体极大地促进了微生物铁循环,加速了微生物介导的整个氧化还原过程(Kügler et al.,2019)。
目前的共识是铁氧化微生物在无氧和微氧环境中通过铁氧化过程获取能量,分泌带状胞外有机物(生物大分子)作为“模板”,调控矿物的生长(Banfield et al.,2000;Chan et al.,2011;徐轶群等,2013)。这些有机物主要是由一些含有高比例酸性氨基酸(特别是天冬氨酸)和磷酸化酶组分的蛋白质、多糖和糖蛋白组成的大分子群,能有序调节参与形成生物矿物所必需的组分。微生物细胞通过细胞膜主动泵吸胞内阳离子或通过胞内囊泡富集阳离子,然后将阳离子运输至“模板”的某个区域,构成“就地”成矿点,在特定酶的催化下连续不断地进行矿化作用,导致AMD局部环境中的pH-Eh发生变化(Elghali et al.,2021;Lee et al.,2022;贾蓉芬等,2009)。铁还原菌在厌氧环境中与Fe(Ⅲ)矿物接触时,通过菌毛等特殊结构直接将自身代谢产生的带有特殊官能团(‒SH、‒OH、‒NH2、‒COO等)的生物大分子传递至矿物表面,或将由胞内外的有机基质产生的电子梭传递至矿物表面,从而还原 Fe(Ⅲ)矿物,Fe(Ⅱ)又在矿物表面与 Fe(Ⅲ)发生电子转移,催化稳定相铁矿物的合成(Burton et al.,2007;Luef et al.,2013)。
在微生物成矿过程中,一方面,生物大分子携带的特殊功能团的键能决定了矿化产物的类型,另一方面,生物大分子的结构决定了矿物成核的位置和形态(贾蓉芬等,2009),特定晶型的出现遵循能量最小化原则,即有机物调控下生长的矿物晶体消耗生物体最少的能量(Pacella et al.,2018)。微生物-矿物结构是一个高度动态的系统(Lower et al.,2001;Shi et al.,2016),在此复杂系统中,微生物细胞-有机质-矿物三者之间相互作用、相互影响,导致产生复杂的环境-生物地球化学过程异质性(Benzerara et al.,2011;Zhu et al.,2015b)。
由上可知,含铁矿物质的形成受微生物群落结构、功能和代谢作用及环境化学条件共同控制(Johannessen et al.,2017),且生物矿化中的生物质矿物形态受分子模板、矿物-微生物界面性质等因素的影响(Gilbert et al.,2005)。微生物膜与矿物界面是一个化学梯度大、反应活性分子集中、氧化还原作用活跃的微观界面,是矿物发生表面侵蚀和氧化分解的活跃界面(Mielke et al.,2003;Zhu et al.,2014)。通过挖掘矿物-微生物界面表面微观结构、组成、形态和功能的演变,可以得到相关的微观表型性状,该性状可由矿物和微生物胞外聚合物(Extracellular Polymeric Substances,EPS)的表面性质定义(Zhang et al.,2014;Hao et al.,2016)。由 EPS介导的细胞和矿物之间的接触促进了矿物的溶解,为矿物的化学行为提供了反应空间(Sand et al.,2006)。其中,表面反应控制是AMD微生物-矿物相互作用的关键机制(Su et al.,2020;Xia et al.,2020),而接触机制则是矿物发生微生物氧化的主导机制(陆现彩等,2019)。首先,细胞粘附矿物表面,形成 AMD生物膜雏形(Zhu et al.,2015a;Li et al.,2016);其次,嗜酸性微生物(如Ferroplasmaspp.)在酸性环境中分泌的大量膜脂(Macalady et al.,2004)极大地促进了生物膜的形成,微生物得以快速繁衍;最后,随着时间的推移,细菌胞体在与其接触的矿物表面覆盖了一层致密的生物膜,通过多层吸附实现其与矿物之间的表面相互作用,直至将矿物侵蚀(Su et al.,2020)。
此外,AMD矿物的微生物还原遵循电化学过程,胞外电子传递(Extracellular Electron Transfer,EET)是该作用过程的一个关键步骤(Lovley,2008;Rozendal et al.,2008;Ni et al.,2018)。这是由于 EET过程是微生物胞外呼吸作用的重要组成部分,影响着AMD环境中的物质转变和能量交换;而胞外呼吸又是微生物的主要能量代谢方式,是微生物与胞外受体间进行电子传递的主要方式(陈丹丹等,2017;张多瑞等,2018)。具体表现为内层生物膜上的微生物通过鞭毛(如Geobacter sulfurreducens的Ⅳ型鞭毛是一种纳米导线)搭建导电网格,形成多级电子跃迁机制,而外层细胞膜上丰富的 c-型细胞色素直接与矿物表面接触,进行直接电子传递(Malvankar et al.,2014)。值得注意的是,含铁矿物是AMD系统微生物胞外呼吸最重要的电子受体之一(张玉龙等,2021),微生物铁呼吸过程伴随大量 H+的消耗,改变了AMD系统碳、氮、硫元素循环,同时耦合多种重金属的迁移转化,从而改变微生物的生长与竞争关系,导致AMD系统微生物群落、功能和代谢等的演化。
5 结论与展望
预测AMD微生物群落组成和功能性状随环境变化的动态过程是AMD系统生态学研究的一个重要目标,目前仍是一个重大挑战。微生物组学研究获得的微生物群落结构、功能、代谢等信息为在系统水平上理解AMD微生物生态学的时空演变提供了丰富的科学证据。AMD微生物群落组成和功能性状在不同时空尺度和地球化学梯度上的演替特征研究将有助于阐明微生物群落及其生态功能对极端酸性环境变化的响应,有助于揭示优势物种和稀有物种在 AMD生物处理中的生态作用。AMD极端环境中的微生物多样性模式与Fe-S生物地球化学循环过程紧密联系,微生物群落功能控制AMD金属离子的生物地球化学过程,同时微生物群落与地球化学条件的相互作用驱动了其自身的生态适应性进化。未来仍可通过整合微生物组学技术探索AMD微生物组对极端环境胁迫的响应机制及其对AMD生物成矿的控制机制,为AMD生物处理系统的优化和维护提供进一步指导。
虽然目前研究人员已掌握了AMD微生物成矿的基本过程,但是其微生物-矿物相互作用的具体机制尚不明确,尤其在不同的AMD环境化学梯度下,微生物-矿物互作关系如何演化,主导其演化的基因如何编码Fe转运蛋白、细胞色素、细菌鞭毛等的机制研究匮乏。现代环境分析显微镜技术被广泛应用于生物质矿物的高分辨率结构和组成分析,可直观呈现微生物-矿物聚合体的微观晶体化学特征(Mann,1987;McLaren,1991)。光谱学分析可以表征微生物介导的生物质矿物晶型转变(Geesey et al.,2002)、界面电子转移(Williams et al.,2004)以及光谱诱导矿物极化特征(Zhang et al.,2012)等。此外,大型同步辐射科学设备和超级计算中心的发展(Xia et al.,2020),为AMD微生物-矿物聚合体的表型组学研究提供了技术支撑。未来可通过整合微生物组学方法和矿物学分析技术(XPS、FTIR、FIB-SEM、TEM、XRD等),系统地探索AMD不同环境地球化学条件下的微生物组-矿物组的表型关系,从而揭示生命和矿物在极端酸性环境中协同演化的微观机制。
