3种鹿源鹿茸多糖含量、红外谱图、抗氧化活性比较
2022-07-22王露露
何 源,王露露,张 晶.*
(1.吉林农业大学中药材学院,吉林 长春 130118;2.长春科技学院医药学院,吉林 长春 130600)
鹿茸为鹿科动物梅花鹿CervusnipportTemminck、马鹿CervuselaphusLinnaeus雄鹿头上的未骨化密生茸毛的幼角,是具有悠久历史的名贵传统中药。具有壮肾阳、益精血、强筋骨等功效,用于肾阳不足、精血亏虚、阳痿滑精、宫冷不孕等[1]。驯鹿CervusrangiferTarandus的雌雄鹿头上均有角,其主要分布于北半球的环北极地区,在中国多生长于大兴安岭地区,驯鹿鹿茸与梅花花鹿鹿茸、马鹿鹿茸一样,均具有较高且相似的药用价值[2]。鹿茸中活性成分包括脂类、多糖类、氨基酸类等,这些成分具有抗炎、抗溃疡、抗衰老等多种药理作用[3]。
傅立叶变换红外光谱法是分析中药中有效成分结构和官能团的常用方法[4],其原理是来自连续非相干光源的红外辐射穿过迈克尔逊干涉仪,同时记录干涉图随光程差的变化,并通过使用傅立叶变换过程从干涉图中解码频谱信息[5]。红外二阶导数光谱可很好的分辨出红外谱图中肉眼观察不到的重叠吸收峰,增强谱图的特征性,提高分标率,能有效的辨别出相同种类不同来源的药材[6]。
鹿茸多糖是鹿茸中主要的活性成分,近年来不断有学者对鹿茸多糖的提取工艺做出优化,崔长生等[7]利用热水提取法提取鹿茸多糖。宋佳等[8]利用超声辅助提取马鹿茸多糖。鹿茸多糖具有多种药理活性,其中鹿茸多糖的抗氧化活性一直是研究的重点,赵玉红等[9]用阴离子交换和葡聚糖凝胶层析对鹿茸多糖进行分离纯化,结果表明鹿茸多糖及其各组分对DPPH自由基、羟基自由基、超氧阴离子自由基均有清除效果,且具有一定的还原能力。尽管鹿茸多糖的体外抗氧化活性已有研究,但对3种鹿源鹿茸多糖体外抗氧化活性的比较研究较少,因此本文对3种鹿源鹿茸多糖的体外抗氧化活性进行分析比较,为筛选出效果最佳的天然抗氧化剂提供依据。
1 材料与方法
1.1 药材 梅花鹿鹿茸、马鹿鹿茸、驯鹿鹿茸于2019年采购于吉林双阳鹿场,将其进行割绒去皮处理,锯成片状,高速万能粉碎机粉碎,过80目筛,在-80 ℃下保存。
1.2 试剂与仪器 乙醚、乙醇、氯仿、苯酚、浓硫酸、无水葡萄糖、K2S2O8、FeSO4、H2O2、K3Fe(CN)6、三氯乙酸、三氯化铁等(北京化工厂);DPPH、ABTS标准品(德国Aldrich公司)。傅里叶变换红外光谱仪L1600400,扫描范围4 000~400 cm-1,分辨率4 cm-1(美国Perkin Elmer公司);T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司);FLB-250型万能高速粉碎机(上海菲力博食品机械有限公司);XB120A电子天平(普利赛斯国际贸易上海有限公司);LYOQUEST-55西班牙泰事达冻干机(北京昊诺斯科技有限公司);SPECTROstar Nano高通量紫外酶标仪(伯齐科技有限公司)。
1.3 方法
1.3.1 多糖提取 取过筛干燥后的鹿茸粉末各10 g,乙醚回流提取3 h脱脂过滤,残渣挥净乙醚后加水煎煮(料液比为1∶10)3次,1 h/次,煎煮滤液,4 500 r/min离心5 min,取上清液,加乙醇至80%以上,4 ℃静置过夜,8 000 r/min离心,沉淀加水溶解,采用Sevage法[10]除去溶液中杂质蛋白,30% H2O2脱色,透析,浓缩,真空冷冻干燥24 h。
1.3.2 多糖含量测定 采用苯酚-浓硫酸法[11]。精密称取10 mg葡萄糖粉末,加水定容至100 mL量瓶中,得到100 μg/mL溶液,分别精密吸取0、0.1、0.2、0.4、0.6、0.8、1.0 mL至试管中,加水使其终体积为1 mL,再加入5%苯酚1.0 mL,混匀,沿管壁缓慢加入浓硫酸5 mL,摇匀,沸水浴20 min后冷却静置10 min,在490 nm波长处测定吸光度,以吸光度为纵坐标(A)、多糖质量浓度为横坐标(X)进行回归,得方程为A=0.005 9X+0.000 7(R2=0.999 6),在10~100 μg范围内线性关系良好。精密称取多糖粉末10 mg,制成100 μg/mL溶液,测定含量,公式为含量=(多糖质量浓度/100)×(粗多糖产量/鹿茸粉末质量)。
1.3.3 红外光谱分析 将多糖粉末在40 ℃下烘干后过80目筛,取一定量平铺于FT-IR光谱的ATR测定窗口,调整旋钮使模具压平待测样品,待测力计数值稳定后观察红外光谱[12],设定光谱扫描范围4 000~400 cm-1,累计扫描4次,分辨率5 cm-1,得到的红外原始谱图通过Spectrum软件进行平滑及基线校正进行优化处理,再作红外二阶导数分析。
1.3.4 抗氧化活性测定 将多糖配制成1、2、4、6、8、10 mg/mL溶液,同法处理维生素C(阳性对照)。
1.3.4.1 DPPH自由基清除能力 称取DPPH粉末8.00 mg至100 mL量瓶中,无水乙醇定容至刻度,避光保存。取多糖溶液40 μL,加入160 μLDPPH溶液后置于96孔板中,混匀,避光反应1 h,在517 nm波长处测定吸光度,平行3次,取平均值,同法测定维生素C吸光度,计算DPPH自由基清除率,公式为清除率=[1-(A-C)/B]×100%,其中A为多糖溶液+DPPH吸光度,B为水+DPPH吸光度,C为多糖溶液+无水乙醇吸光度。
1.3.4.2 ABTS自由基清除能力 称取20.40 mg ABTS粉末至10 mL量瓶中,依次加入5 mL蒸馏水、5 mL 2.6 mmol/mL K2S2O8溶液,室温避光反应16 h,无水乙醇稀释,使其在734 nm处的吸光度为0.7±0.05。取多糖溶液80 μL,加入ABTS溶液140 μL后置于96孔板中,室温避光反应30 min,在734 nm波长处测吸定光度,计算ABTS自由基清除率,公式为清除率=(1-A/B)×100%,其中A为多糖溶液+ABTS吸光度,B为ABTS吸光度。
1.3.4.3 羟基自由基清除能力 准确吸取10 mmol/L水杨酸乙醇溶液10 μL、蒸馏水70 μL、多糖溶液10 μL、10 mmol/L FeSO4溶液10 μL、100 mmol/L H2O2100 μL,置于96孔板中混匀,在510 nm波长处测得吸光度A;准确吸取10 mmol/L水杨酸乙醇溶液10 μL、蒸馏水80 μL、多糖溶液10 μL、100 mmol/L H2O2100 μL,置于96孔板中混匀,在510 nm波长处测定吸光度B;准确吸取10 mmol/L水杨酸乙醇溶液10 μL、蒸馏水80 μL、10 mmol/LFeSO4溶液10 μL、100 mmol/L H2O2100 μL,置于96孔板中混匀,在510 nm波长处测定吸光度C,计算羟基自由基清除率,公式为清除率=[1-(A-B)/C]×100%。
1.3.4.4 铁离子总还原能力 取多糖溶液、1%铁氰化钾、磷酸盐缓冲液(pH=6.6)各0.25 mL,置于1.5 mL小离心管中,混合均匀后50 ℃水浴加热20 min后迅速取出,冷却至室温,加0.25 mL 10%三氯乙酸溶液,混匀,3 000 r/min离心10 min。取上清液100 μL,加入1%FeCl3溶液20 μL、蒸馏水100 μL至96孔板中,混匀静置20 min后在700 nm波长处测定吸光度A。取上清液100 μL,加入120 μL 蒸馏水后置于96孔板中,混匀静置20 min,在700 nm波长处测定吸光度B,计算铁离子总还原能力,公式为总还原能力=A-B。

2 结果
2.1 多糖含量 由表1可知,梅花鹿、马鹿鹿茸多糖含量高于驯鹿鹿茸多糖含量(P<0.05)。

表1 3种鹿源鹿茸多糖含量测定结果
2.2 红外光谱 图1、表2显示,在3 500~3 000 cm-1处是O-H、N-H伸缩振动的吸收带,驯鹿鹿茸多糖在3 287 cm-1处的吸收峰略窄与其他两种鹿茸多糖;2 930 cm-1附近的C-H的拉伸和弯曲振动吸收峰是多糖的特征吸收峰,次峰出现在2 854 cm-1处,表明存在亚甲基;3种鹿茸多糖在1 634 cm-1处的相对较强的吸收峰是由C=O伸缩振动引起的;1 547 cm-1附近是N-H的面内弯曲振动[13];1 455、1 402 cm-1处是C-H的弯曲振动;1 337 cm-1附近是C-N的伸缩振动吸收峰,表明存在酰胺基团;1 240 cm-1附近是硫酸根中的S=O吸收峰[14],表明3种鹿茸多糖均存在硫酸根基团;1 200~1 000 cm-1处吸收峰表示C-O伸缩的吡喃环振动[15]。另外,梅花鹿鹿茸多糖的强度最大,峰型较宽,其次是驯鹿鹿茸多糖,峰型较尖锐,新西兰马鹿鹿茸多糖在此处的强度较小。综上所述,3种鹿茸多糖均具有典型的多糖结构,并含有酰胺和硫酸根基团。

图1 3种鹿源鹿茸多糖红外光谱
表3显示,吸收峰强度依次为梅花鹿鹿茸多糖>马鹿鹿茸多糖>驯鹿鹿茸多糖,含量排序亦然。
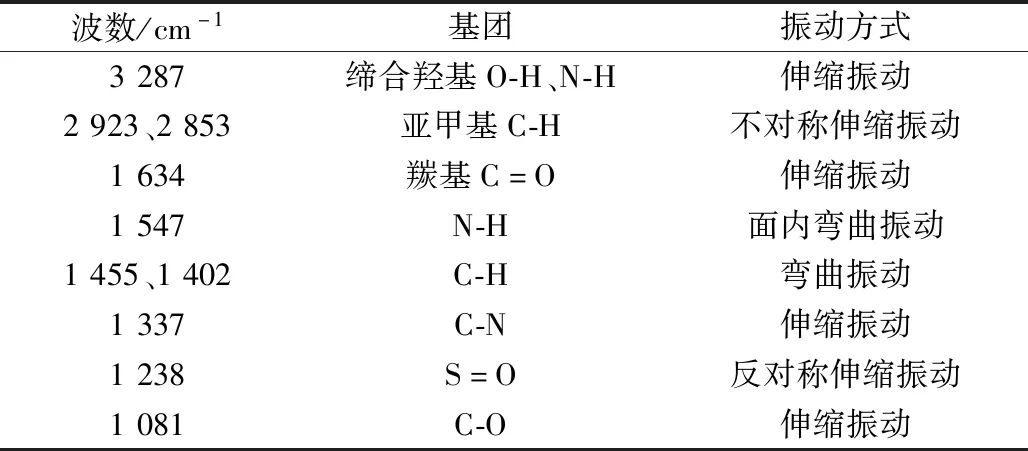
表2 共有峰官能团及振动方式
2.3 红外二阶导数分析 在鹿茸多糖红外光谱图上出现多个吸收峰,但谱峰重叠现象严重,给谱图解析带来困难,故本实验在1 800~800 cm-1的光谱区间对其红外光谱进行了二阶导数处理。图2显示,鹿茸多糖在1 694、1 683、1 667、1 652、1 575、1 564、1 557、1 498、1 463、1 455、1 336 cm-1等位置有明显的共有吸收峰,表明存在芳环骨架振动;马鹿、驯鹿鹿茸多糖在1 634 cm-1处有1个较强的吸收峰,而梅花鹿鹿茸多糖在1 618 cm-1处有1个特征吸收峰,驯鹿鹿茸多糖在1 498 cm-1处的吸收带无肩峰,峰型较宽,由此可将3种鹿茸多糖区分开来。

表3 共有峰吸收强度
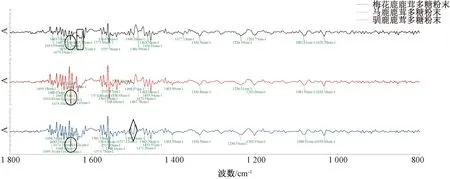
图2 鹿茸多糖红外二阶导数谱图
2.4 抗氧化活性
2.4.1 DPPH自由基清除能力 DPPH自由基是一种稳定的自由基,其单电子对可与抗氧化剂相互配对,使其吸光度减小,颜色从紫色变为淡黄色,被广泛用于评估食品、药品抗氧化能力[16]。图3显示,DPPH自由基清除能力依次为梅花鹿鹿茸多糖>驯鹿鹿茸多糖>马鹿鹿茸多糖,并呈现剂量依赖性,但弱于维生素C。
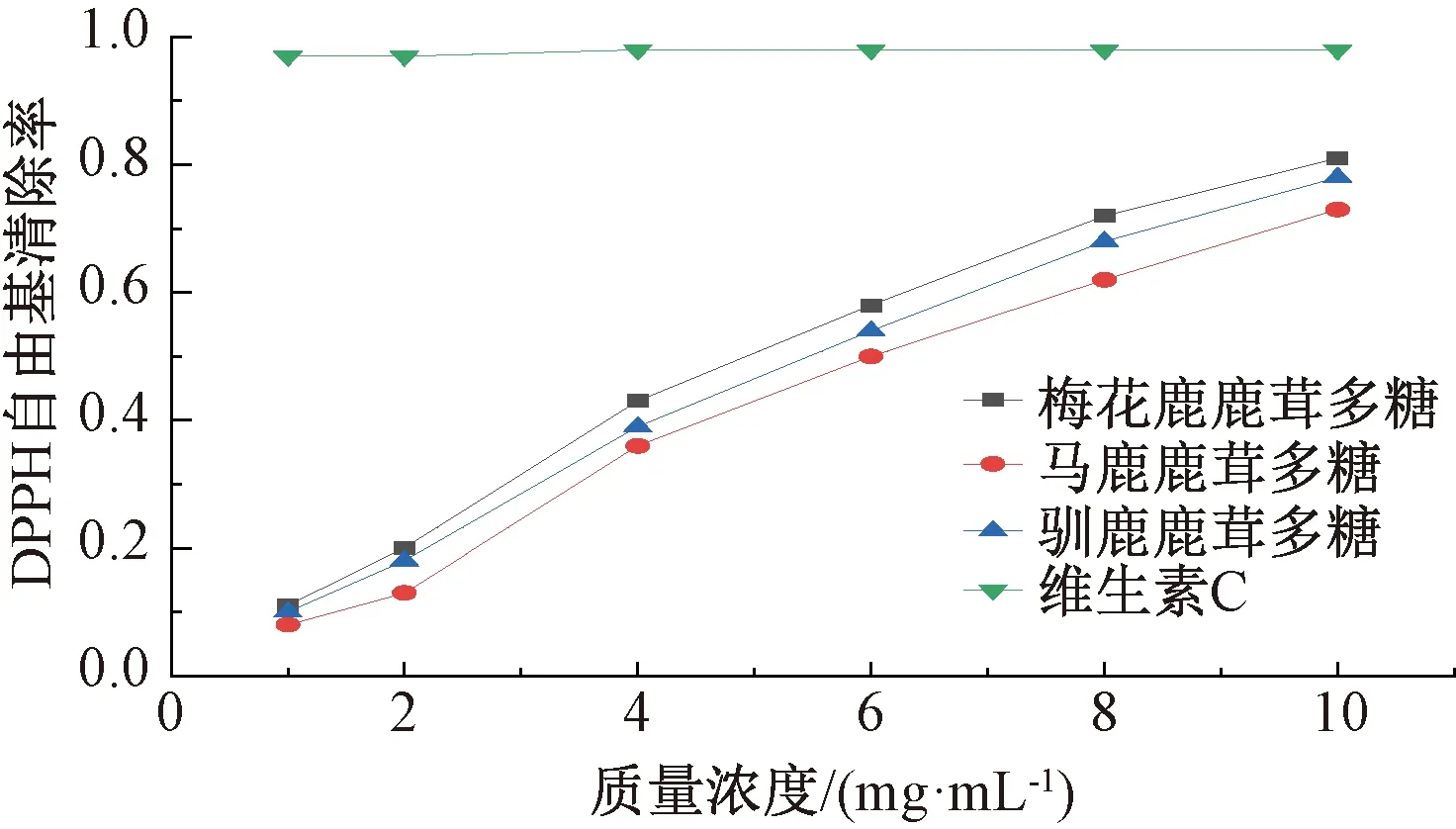
图3 鹿茸多糖对DPPH自由基的清除作用
2.4.2 ABTS自由基清除能力 ABTS可与过硫酸钾发生氧化反应,生成稳定的蓝绿色阳离子自由基,被广泛应用于亲水性物质的抗氧化能力的测定[17]。图4显示,ABTS自由基清除能力依次为梅花鹿鹿茸多糖>驯鹿鹿茸多糖>马鹿鹿茸多糖,并呈现剂量依赖性,但弱于维生素C。
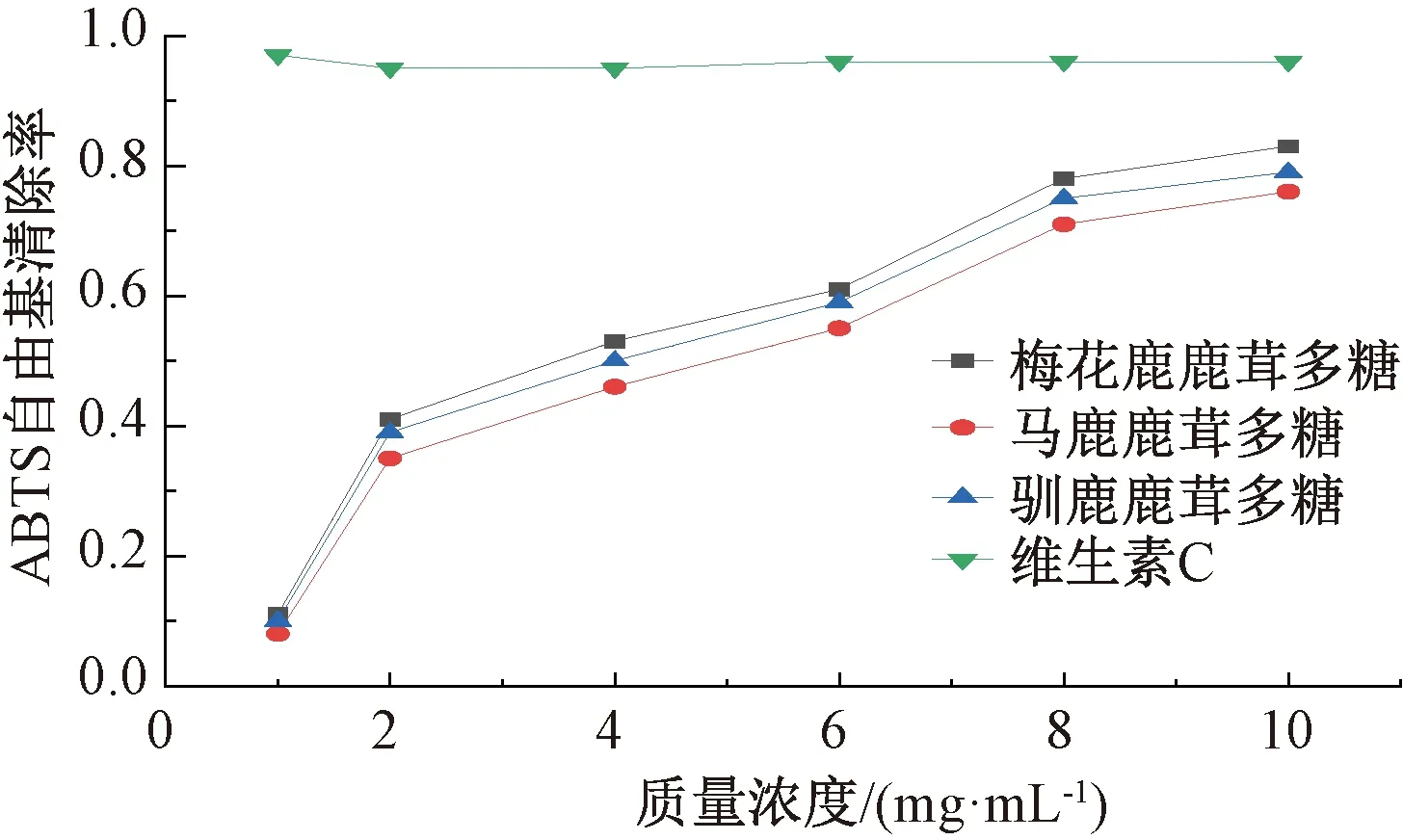
图4 鹿茸多糖对ABTS自由基的清除作用
2.4.3 羟基自由基清除能力 羟基自由基被证明是一种最活泼的氧自由基,具有很高的反应速率常数,可使DNA、蛋白质、脂质发生氧化损伤,被广泛应用于反映抗氧化能力强弱[18]。图5显示,羟基自由基清除能力依次为梅花鹿鹿茸多糖>驯鹿鹿茸多糖>马鹿鹿茸多糖,并呈现剂量依赖性,但弱于维生素C。

图5 鹿茸多糖对羟基自由基的清除作用
2.4.4 铁离子总还原能力 多糖的总还原力是测量其抗氧化活性的潜在指标,它通过给出电子发挥总还原力,进而达到清除自由基的目的,总还原力越强,抗氧化能力就越强[19]。图6显示,总还原力依次为梅花鹿鹿茸多糖>驯鹿鹿茸多糖>马鹿鹿茸多糖,并呈现剂量依赖性,但弱于维生素C。

图6 鹿茸多糖对铁离子的总还原力
2.4.5 IC50将鹿茸多糖对DPPH自由基、ABTS自由基、羟基自由基的抗氧化曲线进行拟合,得到IC50,结果见表4。由此可知,梅花鹿鹿茸多糖IC50最低,马鹿鹿茸多糖IC50最高,即梅花鹿茸多糖抗氧化活性最强,马鹿鹿茸多糖抗氧化活性最弱。

表4 鹿茸多糖IC50测定结果
3 结论
本实验从3种鹿源鹿茸中提取鹿茸多糖,其优势在于可大量提取。结果,梅花鹿鹿茸多糖的含量要高于驯鹿鹿茸多糖和马鹿鹿茸多糖;从红外光谱中看出,它们均具有典型的多糖结构,且含有酰胺和硫酸根基团,峰型与峰位置大致相似,但峰强度有所差异,说明3种鹿源中多糖类型相似但含量有所差异。红外的二阶导数谱图结果表明,3种鹿茸多糖在峰型上大致相似,但也存在差异。梅花鹿鹿茸多糖在1 618 cm-1处有1个特征吸收峰,马鹿鹿茸多糖、驯鹿鹿茸多糖在1 634 cm-1处有较强的吸收峰,而梅花鹿鹿茸多糖则无此峰,驯鹿鹿茸多糖在1 498 cm-1处的吸收带无肩峰且峰型较宽,以此可进行辨别。另外,3种鹿源鹿茸多糖均具有体外抗氧化活性,梅花鹿鹿茸多糖清除DPPH自由基、ABTS自由基、羟基自由基的效果及铁离子还原力要高于驯鹿和马鹿鹿茸多糖。
综上所述,本实验比较3种鹿源鹿茸多糖的抗氧化能力,为该成分在天然抗氧化剂筛选方面提供了较强的理论依据,并且其差异可能与多糖的含量、结构等因素有关,后续还有待进一步研究。
