阿魏酸钠通过miR-136-5p 对ox-LDL 诱导内皮细胞增殖、迁移和侵袭的影响
2022-07-22黄泓轲罗健玮冉华
黄泓轲罗健玮冉华
(1.乐山职业技术学院药学系,四川 乐山614000; 2.乐山职业技术学院医学系,四川 乐山614000;3.重庆市黔江中心医院心内科,重庆409000)
动脉粥样硬化是一种病因复杂的慢性疾病,内皮细胞损伤及功能障碍是动脉粥样硬化的始动环节,参与动脉粥样硬化的进展过程[1]。药物治疗是动脉粥样硬化及其相关心血管疾病的主要治疗手段之一,因此有必要筛选有效的预防和治疗动脉粥样硬化的药物,并探讨其作用机制,寻找敏感的靶点[2]。阿魏酸钠是传统活血化瘀类中药当归、川芎等的主要成分,具有抗细胞凋亡、抑制血小板聚集、抗血栓形成等作用[3]。阿魏酸钠通过抑制p38 丝裂原活化蛋白激酶(p38 MAPK)通路能够有效降低氧化低密度脂蛋白(ox-LDL)诱导的细胞凋亡,发挥内皮保护作用[4],阿魏酸钠还能促进内皮细胞的增殖和迁移[5]。核因子-κB(NF-κB)信号通路参与炎症反应、内皮细胞损伤、氧化应激等过程,其可促进动脉粥样硬化的进展[6],抑制NF-κB p65 信号通路激活可减弱内皮细胞的增殖和迁移[7]。阿魏酸钠可通过抑制NF-κB p65 核转位减轻缺血再灌注大鼠脑神经细胞炎症反应,发挥脑保护作用[8]。沉默miR-136-5p通过靶向标IκB 激酶β(IKKβ)调控NF-κB 信号通路改善大鼠脊髓损伤[9]。因此,用ox-LDL 损伤人脐静脉内皮细胞EA.HY926 建立体外细胞模型,研究阿魏酸钠通过miR-136-5p 调控NF-κB 信号通路对ox-LDL 诱导内皮细胞增殖、迁移和侵袭的影响。
1 材料
人脐静脉内皮细胞株EA.HY926 购自中国科学院上海细胞库。阿魏酸钠(纯度>98%)购自北京索莱宝科技有限公司。DMEM 培养基、胎牛血清购自美国HyClone 公司;氧化低密度脂蛋白(ox-LDL)购自上海泽叶生物科技有限公司;CCK-8 试剂盒购自日本同仁研究所;蛋白提取试剂盒、BCA 试剂盒购自北京凯瑞基生物科技有限公司;TRIzol 试剂、反转录试剂盒、荧光定量试剂盒购自日本TaKaRa 公司。Transwell 小室、Matrigel 购自美国BD 公司。
2 方法
2.1 细胞处理与分组 人脐静脉内皮细胞株EA.HY926 培养于含10% 胎牛血清的DMEM 培养基中,培养条件为37 ℃、5% CO2,待细胞融合至90% 左右时进行传代。用50 μg/mL ox-LDL 诱导EA.HY926 细胞模拟动脉粥样硬化模型,为ox-LDL 组;正常培养的细胞作为对照组;分别用25、50、100 μmol/L 阿魏酸钠和50 μg/mL ox-LDL 处理EA.HY926,为不同浓度阿魏酸钠组。将miR-NC、miR-136-5p、anti-miR-NC、anti-miR-136-5p 转染至EA.HY926 细胞中,再用50 μg/mL ox-LDL 处理,分别记为miR-NC+ox-LDL 组、miR-136-5p+ox-LDL 组、anti-miR-NC+ox-LDL 组、anti-miR-136-5p +ox-LDL 组;将miR-NC、miR-136-5p 转染至EA.HY926 细胞中,用50 μg/mL ox-LDL 和50 μmol/L 阿魏酸钠处理,分别记为阿魏酸钠+miR-NC+ox-LDL 组、阿魏酸钠+miR-136-5p+ox-LDL 组。
2.2 CCK-8 法检测细胞活力 各组细胞培养48 h后,每孔加入10 μL CCK-8 试剂孵育2 h,酶标仪检测各组细胞在450 nm 波长处的光密度值(OD),以OD值表示细胞活性。
2.3 Transwell 检测细胞迁移和侵袭 收集各组细胞,取200 μL 接种于Transwell 小室上层,培养24 h,PBS 洗涤,4%多聚甲醛固定30 min,用0.1%结晶紫染色10 min,显镜下拍照并计数发生迁移的细胞数量。细胞侵袭实验除用Matrigel 包被Transwell 小室上室外,其余操作同细胞迁移实验。
2.4 Western blot 法检测Ki67、MMP2、MMP9、p-p65、p-IкBα 蛋白表达 提取细胞总蛋白,BCA 法进行定量,将蛋白样品进行聚丙烯酰胺凝胶电泳,转至聚偏二氟乙烯膜上,用5%脱脂奶粉室温封闭1 h,加入一抗(1∶1 000),4 ℃孵育过夜,洗膜,加入二抗(1∶2 000)室温孵育90 min,洗膜,用ECL 发光液显影,成像,用Quantity One 软件测定蛋白条带的灰度值。
2.5 RT-qPCR 检测miR-136-5p表达 提取细胞总RNA,反转录成cDNA,进行PCR 扩增,每个样品重复3次,扩增条件为95 ℃30 s,60 ℃35 s,72 ℃30 s,共40 个循环。采用2-△△CT法计算目的基因的相对表达。以U6 为内参,miR-136-5p正向引物序列 5′-ACTCCATTTGTTTTG ATGATG-3′,反向引物序列 5′-GCTGTCAACGATACGC TACGTAAC-3′;U6 正向引物序列5′-CTCGCTTCGGCAGC ACA-3′,反向引物序列5′-AACGCTTCACGAATTTGCGT-3′。
2.6 统计学分析 通过SPSS 20.0 软件进行处理,结果以()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
3 结果
3.1 阿魏酸钠对ox-LDL 诱导内皮细胞活力的影响 与对照组比较,ox-LDL 组内皮细胞Ki67 蛋白表达降低,细胞活性降低(P<0.05);与ox-LDL 组比较,不同浓度阿魏酸钠处理组Ki67 蛋白表达升高,细胞活性升高(P<0.05),见图1、表1。
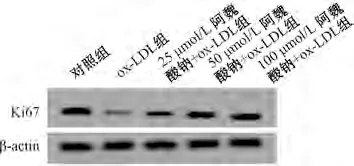
图1 各组内皮细胞Ki67 蛋白表达
表1 不同浓度阿魏酸钠对ox-LDL 诱导内皮细胞活力的影响(, n=9)

表1 不同浓度阿魏酸钠对ox-LDL 诱导内皮细胞活力的影响(, n=9)
注:与对照组比较,*P<0.05;与ox-LDL 组比较,#P<0.05。
3.2 阿魏酸钠对ox-LDL 诱导内皮细胞迁移和侵袭的影响 与对照组比较,ox-LDL 组内皮细胞MMP2、MMP9 蛋白表达降低,迁移和侵袭细胞数降低(P<0.05);与ox-LDL 组比较,50 μmol/L 阿魏酸钠+ox-LDL 组内皮细胞MMP2、MMP9 蛋白表达升高,迁移和侵袭细胞数升高(P<0.05),见图2、表2。

图2 阿魏酸钠对ox-LDL 诱导内皮细胞迁移和侵袭的影响
表2 阿魏酸钠对ox-LDL 诱导内皮细胞迁移和侵袭的影响(, n=9)

表2 阿魏酸钠对ox-LDL 诱导内皮细胞迁移和侵袭的影响(, n=9)
注:与对照组比较,*P<0.05;与ox-LDL 组比较,#P<0.05。
3.3 阿魏酸钠对ox-LDL 诱导内皮细胞miR-136-5p表达的影响 与对照组比较,ox-LDL 组ox-LDL 诱导内皮细胞miR-136-5p表达升高(P<0.05);与ox-LDL 组比较,50 μmol/L阿魏酸钠+ox-LDL 组ox-LDL 诱导内皮细胞miR-136-5p表达降低(P<0.05),见表3。
表3 阿魏酸钠对ox-LDL 诱导内皮细胞miR-136-5p 表达的影响(, n=9)

表3 阿魏酸钠对ox-LDL 诱导内皮细胞miR-136-5p 表达的影响(, n=9)
注:与对照组比较,*P<0.05;与ox-LDL 组比较,#P<0.05。
3.4 miR-136-5p 对ox-LDL 诱导内皮细胞活性、迁移和侵袭的影响 与miR-NC+ox-LDL 组比较,miR-136-5p+ox-LDL组内皮细胞miR-136-5p表达升高,Ki67、MMP2、MMP9 蛋白表达降低,细胞活性降低,迁移、侵袭细胞数降低(P<0.05);与anti-miR-NC +ox-LDL 组比较,anti-miR-136-5p +ox-LDL 组内皮细胞miR-136-5p表达降低,Ki67、MMP2、MMP9 蛋白表达升高,细胞活性升高,迁移、侵袭细胞数升高(P<0.05),见图3、表4。
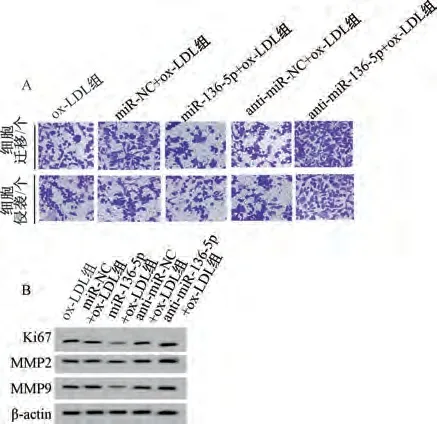
图3 miR-136-5p 对ox-LDL 诱导内皮细胞迁移、侵袭和蛋白表达的影响
表4 miR-136-5p 对ox-LDL 诱导内皮细胞活性、迁移和侵袭的影响(, n=9)
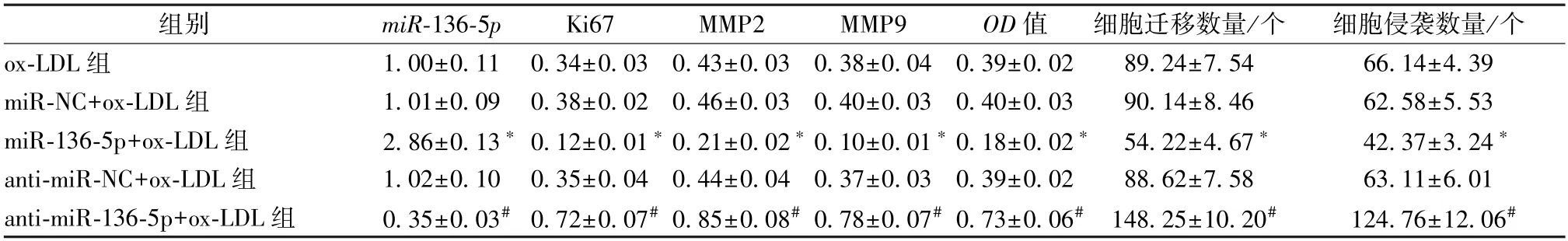
表4 miR-136-5p 对ox-LDL 诱导内皮细胞活性、迁移和侵袭的影响(, n=9)
注:与miR-NC+ox-LDL 组比较,*P<0.05;与anti-miR-NC+ox-LDL 组比较,#P<0.05。
3.5 miR-136-5p 逆转阿魏酸钠对ox-LDL 诱导内皮细胞活性、迁移和侵袭的作用 与miR-NC+50 μmol/L 阿魏酸钠+ox-LDL 组比较,miR-136-5p+50 μmol/L 阿魏酸钠+ox-LDL组内皮细胞miR-136-5p表达升高,Ki67、MMP2、MMP9 蛋白表达降低,细胞活性降低,迁移、侵袭细胞数降低(P<0.05),见图4、表5。
表5 miR-136-5p 逆转阿魏酸钠对ox-LDL 诱导内皮细胞活性、迁移和侵袭的影响(, n=9)
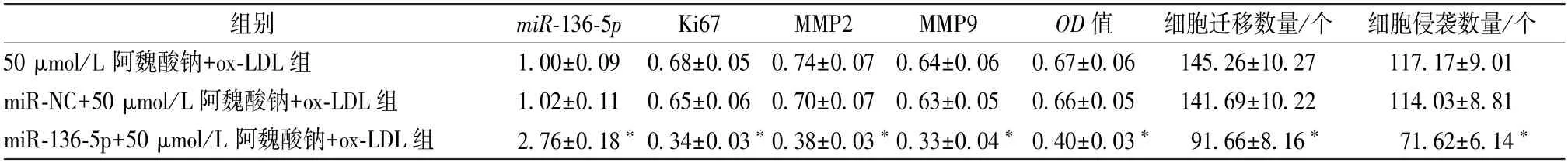
表5 miR-136-5p 逆转阿魏酸钠对ox-LDL 诱导内皮细胞活性、迁移和侵袭的影响(, n=9)
注:与miR-NC+50 μmol/L 阿魏酸钠+ox-LDL 组比较,*P<0.05。

图4 miR-136-5p 逆转阿魏酸钠对ox-LDL 诱导内皮细胞迁移、侵袭和蛋白表达的影响
3.6 阿魏酸钠对ox-LDL 诱导内皮细胞NF-κB 信号通路蛋白表达的影响 与对照组比较,ox-LDL 组内皮细胞p-p65、p-IкBα 蛋白表达升高(P<0.05);与ox-LDL组比较,50 μmol/L阿魏酸钠+ox-LDL 组内皮细胞p-p65、p-IкBα 蛋白表达降低(P<0.05);与miR-NC+ox-LDL 组比较,miR-136-5p+ox-LDL 组内皮细胞p-p65、p-IкBα 蛋白表达升高(P<0.05);与miR-NC+50 μmol/L 阿魏酸钠+ox-LDL 组比较,miR-136-5p+50 μmol/L 阿魏酸钠+ox-LDL 组内皮细胞p-p65、p-IкBα 蛋白表达升高(P<0.05),见图5、表6。

图5 各组内皮细胞p-p65、p-IкBα 蛋白表达
表6 阿魏酸钠对ox-LDL 诱导内皮细胞NF-κB 信号通路蛋白表达的影响(, n=9)

表6 阿魏酸钠对ox-LDL 诱导内皮细胞NF-κB 信号通路蛋白表达的影响(, n=9)
注:与对照组比较,*P<0.05;与ox-LDL 组比较,#P<0.05;与miR-NC+ox-LDL 组比较,△P<0.05;与miR-NC+50 μmol/L 阿魏酸钠+ox-LDL组比较,&P<0.05。
4 讨论
动脉粥样硬化是引起多种心脑血管疾病的主要原因,内皮细胞的损伤和功能性障碍是动脉粥样硬化形成第一步,减轻内皮细胞损伤是防治动脉粥样硬化的途径之一[10]。阿魏酸钠能够缓解同型半胱氨酸导致的人脐静脉内皮细胞功能障碍[11],也可通过下调趋化因子配体1(CXCL1)基因表达对ox-LDL 损伤的人脐静脉内皮细胞起保护作用[12]。阿魏酸钠治疗冠心病患者有较好的效果,可以有效保护血管内皮功能[13]。本研究显示,阿魏酸钠处理后,内皮细胞Ki67 蛋白表达升高,细胞活性升高,MMP2、MMP9 蛋白表达升高,迁移和侵袭细胞数增加,表明阿魏酸钠可促进内皮细胞增殖、迁移和侵袭,对ox-LDL 诱导的内皮细胞损伤有保护作用。
miRNA 参与调控动脉粥样硬化形成、发展的病理生理过程,参与调节血管内皮细胞的生物学功能[14]。利帕舒地尔可通过上调miR-136-5p 减轻RPE 细胞的炎症损伤[15]。miR-136-5p 对内皮细胞生物学功能的影响尚未明确。本研究显示,抑制miR-136-5p 表达后,ox-LDL 诱导的内皮细胞中Ki67 蛋白表达升高,细胞活性升高,MMP2、MMP9 蛋白表达升高,迁移和侵袭细胞数升高,表明抑制miR-136-5p 表达可促进ox-LDL 诱导的内皮细胞增殖、迁移和侵袭。阿魏酸钠可下调miR-136-5p 表达;而过表达miR-136-5p 逆转了阿魏酸钠对ox-LDL 诱导的内皮细胞增殖、迁移和侵袭的作用。提示,阿魏酸钠可能通过下调miR-136-5p 表达影响内皮细胞增殖、迁移和侵袭。
NF-κB 信号通路在动脉粥样硬化的发生发展过程中发挥重要的作用[16]。miR-98 可能通过负性调控NF-κB 信号通路抑制ox-LDL 诱导的动脉粥样硬化早期血管内皮损伤[17]。甲基莲心碱通过抑制NF-κB 信号通路,减轻脂多糖诱导的血管内皮细胞损伤,从而抗动脉粥样硬化[18]。吐根碱通过抑制NF-κB 信号通路能抑制人脐静脉内皮细胞的增殖、侵袭、迁移能力[19]。本研究显示,阿魏酸钠处理后,内皮细胞p-p65、p-IкBα 蛋白表达降低,表明阿魏酸钠可抑制NFκB 信号通路。而过表达miR-136-5p后,内皮细胞p-p65、p-IкBα 蛋白表达升高,表明过表达可激活NF-κB 信号通路;且过表达miR-136-5p 逆转了阿魏酸钠对p-p65、p-IкBα蛋白表达的抑制作用。
综上所述,阿魏酸钠可能通过下调miR-136-5p 表达抑制NF-κB 信号通路,进而抑制内皮细胞的增殖、迁移和侵袭。