鞍叶羊蹄甲对三叉神经痛模型大鼠的镇痛作用
2022-07-22陈亚男刘汉福肖朝江姜北沈磊
陈亚男刘汉福肖朝江姜北沈磊
(1.大理大学药物研究所,云南 大理671000; 2.大理大学药学院,云南 大理671000)
神经病理性疼痛属于慢性疼痛的一种,其全球发病率约为5%[1],神经病理性疼痛患者多伴有睡眠障碍、焦虑、抑郁等症状,从而导致生活质量严重下降[2]。目前治疗神经病理性疼痛的药物临床疗效不明确,副作用较多,且缺乏针对性,因此有必要寻找有效治疗神经病理性疼痛,且副作用小的药物。治疗神经病理性疼痛的中药不良反应低且多为抗炎镇痛类药物。鞍叶羊蹄甲Bauhinia brachycarpaBenth 属于豆科羊蹄甲属植物,分布于四川、云南、甘肃、湖北等地,其民间用药大都与炎症有关,如彝族用药记载其根、叶治疗风湿疼痛,跌打损伤;白族用药记载其根用于安神、止痛、散结、筋骨疼痛[3]。本课题组前期对鞍叶羊蹄甲的抗炎镇痛活性进行了研究,发现鞍叶羊蹄甲总提物可抑制醋酸诱导的外周炎性疼痛,并减少热板引起的中枢性疼痛[4]。因此本实验拟建立三叉神经痛模型,探讨鞍叶羊蹄甲对大鼠的镇痛作用和可能机制,为开发鞍叶羊蹄甲的药用价值提供理论依据。
1 材料
1.1 动物 SD 大鼠,SPF级,雄性,体质量180~220 g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号SCKY(湘)2019-0004。动物实验完全依照大理大学医学伦理委员会及大理大学药学与化学学院实验动物管理委员会的相关规定进行。
1.2 试剂与药物 鞍叶羊蹄甲于2019 年8 月采自云南大理漾濞县,由大理大学药学院张德全教授鉴定为豆科羊蹄甲属植物鞍叶羊蹄甲Bauhinia brachycarpaBenth。卡马西平(江苏鹏鹞药业有限公司,批号2005241)。TNF-α、PGE2、SP ELISA 试剂盒(南京建成生物工程研究所有限公司,批号20201128、20201128、2020122)。水合氯醛(天津市科密欧化学试剂有限公司,批号Q/12HB 4218-2017)。
1.3 仪器 4-0 铬制羊肠线(上海浦东金环医疗用品股份有限公司);RE-5205 型旋转蒸发仪(上海亚荣生化仪器厂);Von Frey 疼痛测试棒(美国DanMic Global 公司);Varioskan LUX 功能酶标仪(美国赛默飞世尔科技公司);BX53 型生物显微镜(日本奥林巴斯公司);0408-2 型台式低速离心机[上海医疗器械(集团)有限公司]。
2 方法
2.1 鞍叶羊蹄甲提取物制备 取鞍叶羊蹄甲干燥地上部分19.5 kg,粉碎后用95%乙醇冷浸提取5次,每次24 h,过滤后合并滤液,用旋转蒸发仪减压回收乙醇后得总浸膏1 878.5 g,用水分散、溶解,经过冻干,最后得到冻干粉1 519.5 g。使用时用0.5% CMC-Na 溶液将冻干粉稀释至相应剂量。实验用剂量根据预实验结果确定。
2.2 动物分组、造模及给药 实验前适应性训练大鼠,用Von Frey 疼痛测试棒连续刺激大鼠两侧须垫部3次,每次间隔时间30 s,直至大鼠对刺激反应转为平静状态,连续3 d。选取3 d 痛阈值均大于15 g 的大鼠共48只,随机分为假手术组和手术组。手术组大鼠建立三叉神经痛模型[5],具体为腹腔注射10%水合氯醛(4 mL/kg)麻醉大鼠,仰卧位固定后,于口腔内左侧软腭第1 个皱褶水平,做1 个长约1 cm 切口暴露眶下神经,依次用2 根4-0 铬制羊肠线结扎眶下神经(2 根线相距约2 mm),结扎松紧度要求仅改变神经直径而不影响神经血液循环,缝合伤口完成模型;假手术组只暴露眶下神经不结扎。将造模成功的大鼠随机分为5组,分别为模型组、卡马西平组(阳性对照,150 mg/kg)和鞍叶羊蹄甲高、中、低剂量组(500、250、125 mg/kg)。手术第14 天开始灌胃给予相应药物,假手术组、模型组灌胃给予0.5% CMC-Na,给药容量均为1.5 mL/kg,每天给药1次,连续14 d,整个实验周期共28 d。
2.3 指标检测
2.3.1 机械痛阈值 各组大鼠均于手术前、手术当天、手术后测定痛阈值。在疼痛行为学测试前,将大鼠放置于网状金属笼子里,适应周围环境10 min。用Von Frey 疼痛测试棒对大鼠的手术同侧须垫部进行刺激,刺激从0.008 g开始逐渐增加,3 次/侧,每次刺激连续2下,每次刺激至少间隔30 s,直到出现阳性反应,记录所采用的刺激强度。大鼠在最大刺激强度26 g 时仍未出现阳性反应,则将痛阈值记为26 g,上述刺激连续测定3次,每次间隔10 min,取3 次测定的平均值为大鼠三叉神经痛阈值。大鼠阳性反应包括退缩反应,表现为刺激时头部退缩,有时伴有刺激同侧面部的洗脸行为;逃跑或攻击行为,表现为避免继续接触刺激物,身体移动远离刺激物或主动咬抓刺激物;非对称性的洗脸,表现为对侧面部至少大于3 次的不间断性洗脸行为。
2.3.2 血清中TNF-α、PGE2、SP 水平 末次给药后禁食24 h,10%水合氯醛麻醉大鼠,腹主动脉取血,室温放置20 min,2 000 r/min 离心20 min 取血清。ELISA 试剂盒检测血清TNF-α、PGE2和SP 水平。
2.3.3 眶下神经组织病理学观察 取血后暴露心脏,注射生理盐水进行心脏灌流,直至右心耳流出清亮生理盐水,再从心脏注入4%多聚甲醛固定组织,然后暴露眶下神经,切取包含缩窄环在内约长0.5 cm 的眶下神经组织,放入4%多聚甲醛中固定。常规脱水、包埋、进行HE 染色,观察组织病理学变化。根据施万细胞的数量对眶下神经组织病理变化进行分析,每张病理切片选择施万细胞数量较多的6 条神经纤维,计数每条纤维中3 cm×3 cm 正方形区域内的施万细胞核数量,统计6 条纤维总的细胞核数目记为该切片所含细胞数。
2.4 统计学分析 通过SPSS 20.0 软件进行处理,计量资料以()表示,多组间比较采用单因素方差分析(Oneway ANOVA),组间差异采用LSD 检验。以P<0.05 为差异有统计学意义。
3 结果
3.1 鞍叶羊蹄甲对三叉神经痛大鼠机械痛阈值的影响 如表1 所示,与假手术组比较,模型组大鼠的机械痛阈值先升高,并于术后第8 天开始下降,术后第14 天手术各组大鼠的机械痛阈值下降至最低值(P<0.01)。术后第14 天开始给药,给药14 d后,与模型组比较,卡马西平和鞍叶羊蹄甲高剂量组均能增加三叉神经痛大鼠的机械痛阈值(P<0.05,P<0.01)。
表1 鞍叶羊蹄甲对三叉神经痛大鼠机械痛阈值的影响(, n=8)
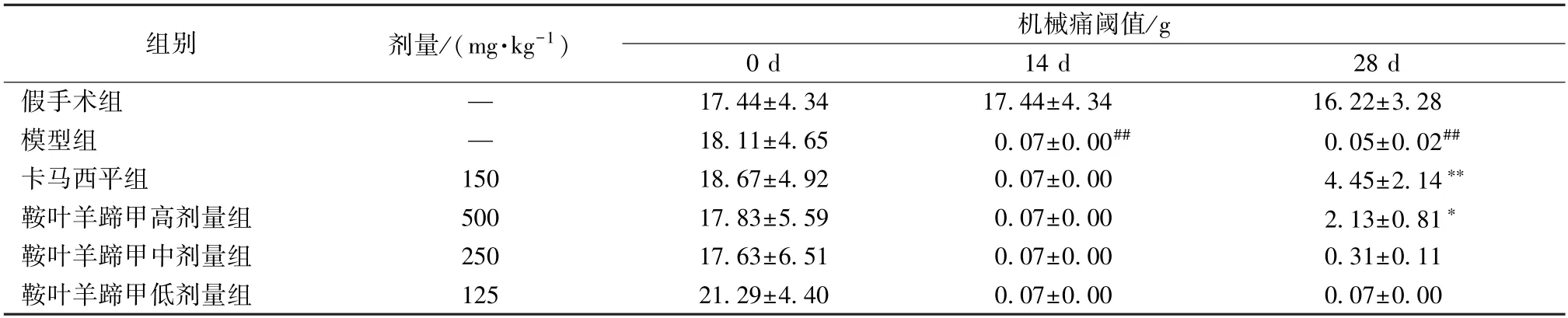
表1 鞍叶羊蹄甲对三叉神经痛大鼠机械痛阈值的影响(, n=8)
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.2 鞍叶羊蹄甲对三叉神经痛大鼠血清中TNF-α、PGE2、SP 水平的影响 如表2 所示,与假手术组比较,模型组大鼠血清中TNF-α、PGE2、SP 水平均升高(P<0.01);与模型组比较,卡马西平和鞍叶羊蹄甲高、中剂量均能降低血清中TNF-α、PGE2水平(P<0.05,P<0.01),鞍叶羊蹄甲中剂量降低血清中SP 水平(P<0.01)。
表2 鞍叶羊蹄甲对三叉神经痛大鼠血清中TNF-α、PGE2、SP 水平的影响(, n=8)

表2 鞍叶羊蹄甲对三叉神经痛大鼠血清中TNF-α、PGE2、SP 水平的影响(, n=8)
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.3 鞍叶羊蹄甲对三叉神经痛大鼠眶下神经组织病理学改变的影响 如图1 所示,假手术组大鼠眶下神经纤维分布均匀,施万细胞核呈紫色,未见病理变化;模型组大鼠眶下,神经纤维排列紊乱,施万细胞增生,神经变性;各剂量鞍叶羊蹄甲与卡马西平均能不同程度的改善神经纤维变性,减轻炎症反应。如表3 所示,与假手术组比较,模型组大鼠眶下神经组织中施万细胞数量增加(P<0.01);与模型组比较,各给药组施万细胞数量均减少(P<0.01),说明鞍叶羊蹄甲可抑制施万细胞增生。

图1 鞍叶羊蹄甲对三叉神经痛大鼠眶下神经病理组织学的影响(×400)
表3 鞍叶羊蹄甲对三叉神经痛大鼠眶下神经组织施万细胞数目的影响(, n=8)

表3 鞍叶羊蹄甲对三叉神经痛大鼠眶下神经组织施万细胞数目的影响(, n=8)
注:与假手术组比较,##P<0.01;与模型组比较,**P<0.01。
4 讨论
神经病理性疼痛为神经系统损伤或功能障碍引起的疼痛,其发生机制分为中枢敏化、外周敏化以及中枢下行抑制性调控改变。对于神经病理性疼痛的治疗是非特异性的,目前治疗的一线药物有抗惊厥药[6]、三环类抗抑郁药、选择性NA 和5-HT 再摄取抑制药,但是这些药物普遍具有疗效不明确,缺乏针对性或长期使用伴有严重副作用和成瘾性等问题。
治疗神经病理性疼痛的中药不良反应低,且大多为抗炎镇痛类药物。本实验数据表明鞍叶羊蹄甲可提高三叉神经痛大鼠的机械痛阈值,其机制可能与抑制神经病理性疼痛中产生的过多炎症因子有关。有研究表明,人类神经组织中炎症细胞聚集和炎症因子过度表达的严重程度与神经病理性疼痛的程度有关。大量炎症介质的释放不仅会诱导和维持中枢敏化,还会进一步的促进外周敏化[7]。TNF-α广泛存在于包括神经组织在内的各种组织中,在神经病理性疼痛模型中,TNF-α 在激活其他信号通路方面起着主导作用[8]。SP 是一种兴奋性神经递质,属速激肽族,由感觉神经元产生,当伤害性刺激激活感觉神经元时,SP 会在外周神经组织以及脊髓中释放,会促进痛觉过敏的产生,从而介导疼痛信号传递[9-11]。PGE2对周围组织和脊髓中的疼痛信号有很大的影响,并且参与了神经病理性疼痛的诱导与维持[12]。本实验结果显示,鞍叶羊蹄甲高、中剂量均能降低三叉神经痛模型大鼠血清中TNF-α、PGE2、SP 水平,尤其是中剂量效果最好,并优于阳性药卡马西平,表明鞍叶羊蹄甲可通过抑制过度表达的炎症因子,对三叉神经痛大鼠产生镇痛作用。
施万细胞是周围神经系统中的神经胶质细胞。激活的施万细胞和巨噬细胞被认为是神经损伤早期产生TNF 的关键。施万细胞的TRPA1 激活后诱导并维持巨噬细胞对受损神经的浸润,从而维持机械痛觉的超敏状态[13]。在神经损伤的条件下,激活的施万细胞能产生生长因子、细胞因子和趋化因子等大分子,又能产生活性小分子(如ATP),这些炎症因子在神经病理性疼痛中均起到了关键作用[14]。本实验结果显示,鞍叶羊蹄甲能降低眶下神经组织中的施万细胞数量,表明鞍叶羊蹄甲可抑制施万细胞增生来降低神经病理性疼痛中产生的炎症因子。
综上所述,鞍叶羊蹄甲对于神经病理性疼痛具有镇痛作用,其机制可能与抑制炎症因子的产生有关。下一步本课题组将针对相关的炎症级联反应,继续探讨鞍叶羊蹄甲对神经病理性疼痛的镇痛作用机制。