Th22及其分泌的细胞因子在变应性鼻炎患者外周血中的表达①
2022-07-21张慧云何韶衡
黎 爽 陈 慧 张慧云 何韶衡 陈 冬
(锦州医科大学附属第一医院耳鼻咽喉头颈外科,锦州 121000)
变应性鼻炎(allergic rhinitis,AR)也称过敏性鼻炎,是易感个体接触变应原后,主要由一种与免疫球蛋白E(IgE)介导的以发作性喷嚏、流涕和鼻塞为主要症状的鼻黏膜变态反应性疾病[1]。目前,AR 已成为全球性健康问题,可直接影响患者的工作生活及身心健康[2-3]。AR 是上呼吸道常见非特异性炎症,在发达国家及发展中国家的发病率有所提高[4]。研究显示,Th1/Th2、Th17/Treg 免疫失衡可引发AR,但其具体发病机制尚不明确,可能还有其他细胞及细胞因子参与其发病[5-6]。Th22 是一种新型辅助性T 细胞(helper T cells,Th)亚群,主要由朗格汉斯细胞和树突状细胞(dendritic cells,DC)诱导分化而来[7]。Th22 的功能主要通过IL-22 实现[7]。IL-22 属于α-螺旋蛋白的一种类型[8]。IL-22 是IL-10 细胞因子家族成员[9]。近年有研究表明,哮喘患者外周血中Th22 比例及IL-22 表达升高[10]。但目前在AR 中关于Th22 和IL-22 作用的研究甚少。TNF-α 是一种炎症刺激因子,有文献显示其可促进Th22 生成[7]。但其在AR 中的作用尚不清楚。本研究采用ELISA法检测IL-22 的表达,荧光免疫流式细胞术检测Th22 比例及AR 患者外周血TNF-α 对Th22 比例的影响及意义,为AR的发病机制提供参考依据。
1 资料与方法
1.1 资料
1.1.1 主要试剂及仪器 高速离心机购自美国Thermo 公司;微量移液器购自德国Brand 公司;流式细胞分析仪购自美国BD公司;PE anti-human IL-22、Percp-Cy5.5 anti-human CD3、FITC anti-human CD8、佛波酯(PMA)、Human IL-22 ELISA Kit 均购自美国Biolegend 公司;Human TNF-α 购自美国PeproTech公司。
1.1.2 研究对象 选择的实验对象为招募的健康志愿者和在锦医大附一院变态反应科门诊就诊的患者。选取的时间为2020 年1 月至2021 年1 月。本试验经锦州医科大学附属第一医院伦理委员会批准(KYLL 202060)。将2015 年“变应性鼻炎诊断和治疗指南”[11]作为分组标准,将实验研究对象分为变应性鼻炎组(AR 组)和健康对照组(HCs 组)。AR 组和HCs 组各30 例。排除标准:排除近期服用过影响免疫系统药物的患者,排除除AR 外的其他过敏性疾病、免疫性、炎症性疾病等的患者。所有受试者均签署知情同意书。
1.2 方法
1.2.1 ELISA 检测IL-22 表达水平 将2 ml静脉血分离提取血清,按照IL-22试剂盒说明书操作。
1.2.2 流式细胞术检测外周血中Th22比例 分离3 ml外周血提取PBMC,1 500 r/min离心10 min,PBS洗涤细胞2 次,重悬于RPMI1640 培养液中,将PBMCs 悬液染色,加入24 孔培养板内培养,3 ml PMA 孵育4 h,流式管中加入1 ml 细胞悬液进行离心处理(2 000 r/min 离心8 min),弃上清,PBS 洗涤2 次。在收集的细胞内依次加入CD8-FITC 单抗和CD3-PERCP 单抗,混匀后避光孵育20 min。将洗涤后的细胞悬液用试剂进行固定和破膜。将经过2次PBS 洗涤的细胞悬液平均分为2 管,即实验组和同型对照组。将IL-22-PE 加入实验管,同型对照抗体加入同型对照管:PE-Mouse IgG2a,k 各10 μl,避光孵育30 min 后应用PBS 洗涤2 次,然后加入PBS(500 μl)重悬,流式上机检测。
1.2.3 流式细胞术检测TNF-α 刺激对AR 患者外周血Th22比例的影响 分别吸取100 μl AR 患者外周血的PBMC悬液至空白对照组、TNF-α处理组(以下称为实验刺激组)和同型对照组,并编号。每管加入3 μl PMA,实验组再加入TNF-α(终浓度为100 ng/ml),37 ℃避光孵育5 h,PBS 清洗后以1 200 r/min 离心6 min,弃上清。在收集的细胞内依次加入CD8-FITC单抗和CD3-PERCP 单抗,混匀后避光孵育20 min。将洗涤后的细胞悬液用试剂进行固定和破膜。将破膜后的悬液经PBS洗涤2次后平均分成3管:空白对照组、实验刺激组、同型对照组。实验刺激管和空白管加入IL-22-PE,同型对照管加入同型对照抗体:PE-Mouse IgG2a,k 各10 μl,避光孵育30 min 后BS 洗涤2 次,然后加入PBS(500 μl)重悬。流式上机检测。
1.3 统计学分析 采用SPSS22.0软件进行统计学分析。运用±s表示实验数据,以χ2检验、两个独立样本t检验、Pearson相关系数检验分析实验数据;P<0.05 表示差异有统计学意义。运用GraphPad Prism(version 6.0)分析箱式统计图;运用Flowjo(version 7.6)软件分析流式数据及代表图。
2 结果
2.1 AR 组与HCs 组的临床资料比较 AR 组(n=30)与HCs 组(n=30)在年龄和性别方面差异无统计学意义(P>0.05),见表1。

表1 研究对象的临床资料(n=30)Tab.1 Clinical data of study subjects(n=30)
2.2 HCs 组与AR 患者组IL-22 表达水平比较ELISA 实验结果显示,与HCs 外周血中IL-22 水平[(57.31±31.34)pg/ml]相比,AR 患者外周血中IL-22 水平[(201.12±57.44)pg/ml]显著升高,差异有统计学意义(P<0.05)。
2.3 AR 组HCs 组外周血中Th22 比例变化 运用BD FACS Verse 流式细胞仪检测AR 组患者和HCs组外周血Th22 比例(Th22 设门方法见图1)。结果显示,与HCs 组外周血CD4+T 细胞中Th22 的比例[(0.81±0.09)%,图1D]相比,AR 组患者外周血CD4+T 细胞中Th22 比例[(3.62±0.74)%,图1E]显著升高(P<0.05)。
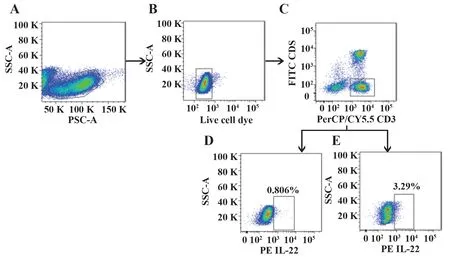
图1 Th22的设门方法Fig.1 Th22 gate method
2.4 AR 患者组与HCs 组外周血中Th22、IL-22 的相关性分析 AR 组中IL-22 表达水平与Th22 比例呈正相关;HCs 组中IL-22 表达水平与Th22 比例呈正相关,见图2。

图2 AR患者组、HCs对照组中Th22、IL-22的相关性分析Fig.2 Correlation analysis of Th22 and IL-22 in AR patients group and HCs control group
2.5 AR 患者外周血与TNF-α 刺激后Th22 比例比较 AR 患者外周血实验刺激组Th22 比例[(4.63±0.59)%]与空白对照组[(3.62±0.74)%]相比明显升高,差异有统计学意义(P<0.05,图3)。本实验采用BD FACS Verse 流式细胞仪标记AR 患者外周血Th22的表达,PE IL-22设门方法见图4。

图3 AR 患者外周血中TNF-α 刺激剂对Th22 表达影响的流式代表图Fig.3 Representative flow chart of effect of TNF-α stimu⁃lators on Th22 expression in peripheral blood of AR patients

图4 AR患者外周血Th22的标记方法Fig.4 Marking method of Th22 in peripheral blood of AR patients
3 讨论
目前普遍认为AR 属于Ⅰ型超敏反应,其发生机制可分为致敏和效应激发两个阶段。当鼻腔黏膜与变应原接触后,变应原可被鼻黏膜中的抗原呈递细胞(antiqen presenting cell,APC)捕获加工,使得T 细胞分化向Th2 偏移,即Th2 数量增多。Th2 分泌的IL-4可作用于B细胞并使其转换变成浆细胞进而产生IgE。IgE 在肥大细胞或嗜碱性粒细胞表面的受体FcɛRⅠ和FcɛRⅡ结合并释放炎症介质,此为致敏阶段。当变应原再次进入鼻腔时,引起AR的临床症状以及鼻腔黏膜的炎症反应,这一阶段为激发阶段[12]。
人体的免疫调节细胞之一是Th。Th 在受到不同刺激诱导下可分化成不同的细胞亚群。每个Th亚群都会释放不同的细胞因子,参与其对应的免疫调节作用,使机体保持动态平衡。由DUHEN 等[13]和TRIFARL 等[14]的报道中得知,他们发现了一种与皮肤免疫功能相关的新的Th,其发挥生物学作用主要通过IL-22 实现。因此科学家将其命名为Th22。Th22 主要通过分泌特征性细胞因子IL-22 在自身免疫性疾病、肝脏疾病、炎症反应、组织修复等的发病、发展过程发挥免疫调节的作用[7]。IL-22 是一种α-螺旋蛋白,其依靠细胞因子受体发挥生物学效应[8]。
实验结果显示Th22 比例及IL-22 表达水平在AR 患者外周血中含量高于HCs,且两者呈正相关。有文献报道,与健康人群相比,IL-22 在哮喘患者血清和痰液中表达明显增高[15]。还有研究显示哮喘患者病情程度与血清和痰标本中IL-22 的表达水平呈正相关[16]。过敏性皮炎患者皮肤中Th22 比例高于HCs[17-18]。在小儿哮喘患者中IL-22 mRNA 水平和血清中总IgE水平呈正相关,且IL-22 mRNA 水平会随着病情加重而升高[19]。还有动物实验显示,IL-22 在被卵白蛋白(ovalbumin,OVA)致敏的小鼠肺组织和血清中的表达显著增加[15]。这些都反映出IL-22 和过敏性疾病之间的关系,与本实验结果相符。根据“哮喘和AR 具有相似性”在研究者间的普遍认识[11,20],课题组推测可能是过敏原刺激后促进CD4+细胞分化成Th22 并释放特征性细胞因子IL-22 进而参与过敏性疾病的发生和发展。Th22 细及其分泌的特征性细胞因子IL-22 在AR 和哮喘中发挥促炎作用。
Th22 的表面特征性识别因子为CC 趋化因子受体10、CC 趋化因子受体6 和CC 趋化因子受体4,主要转录因子为AhR[7]。Th22 和IL-22 在多种疾病的发生发展中发挥免疫应答作用[9]。有文献显示,IL-22在炎症反应中可发挥抗炎及促炎双重作用[21]。课题组分析Th22 与疾病间的作用主要是通过对IL-22的研究[22]。结合卵清蛋白致敏AR鼠单细胞悬液中Th22及其分泌的特征性细胞因子IL-22的表达水平升高的报道[23]。有研究者认为IL-22 通过与非免疫细胞上特异性受体(如气道上皮细胞和气道平滑肌细胞等)结合,激活信号转导子和转录激活子3(STAT3)、STAT1、STAT5 等信号转导通路,在哮喘的发病过程中发挥至关重要的作用[24-26]。ALKHOURI等[27]认为趋化因子配体10[chemokine(CXC motif)ligand 10,CXCL10]可促进人肺部肥大细胞产生。也有研究者认为IL-22 参与AR 的发生是因为其提高了IFN-γ 诱导的CXCL10 的表达[28]。在动物实验中,将小鼠制备成被OVA 致敏的IL-22 缺失的动物模型,发现嗜酸性粒细胞在其支气管肺泡灌洗液及肺组织中的数量减少,且白细胞浸润及IL-13、IL-5及IL-33 在其呼吸道组织中的表达也均出现降低现象。提示IL-22 是人和动物的诱导炎症分子之一。IL-22 的缺乏可引起呼吸道过敏反应的抑制作用。此外,OVA 抗原刺激后敲除IL-22 基因的小鼠中,Th2 分泌细胞因子及中性粒细胞、嗜酸性粒细胞的水平降低,表明这些都可能是诱导促炎介质促进呼吸道炎症发生发展的原因[15,29]。
本研究结果显示,在AR 患者外周血中,与空白对照组相比,实验刺激组中Th22比例明显增加。文献显示Th22 及IL-22 水平在活动性RA 患者外周血中明显高于健康对照人群,其广泛存在于组织细胞中[30]。NF-κB可负责调控多种炎症介质和细胞因子等的基因表达,并参与免疫炎症反应。有资料显示,激活单核巨噬细胞可产生TNF-α[31-32]。TNF-α作为一种炎症介质,可导致一系列病理生理反应,包括呼吸道的气道痉挛、水肿,提高血管的通透性和小血栓的产生等,并可诱发、加重哮喘的发作[33]。有文献报道,TNF-α可促进Th22的生成[7,34-35]。结合资料,TNF-α 可能是变应性炎症发生发展的启动和加速因子之一。研究显示,在免疫失衡疾病中,TNF-α、NF-κB、Th22 均增多[36-37]。课题组猜测在AR患者中,TNF-α 可能通过NF-κB 信号转导经典通路与非经典通路刺激产生Th22,此猜测有待进一步的研究证实。