基于肽组学的瑞士乳杆菌酪蛋白水解差异分析
2022-07-19张心怡刘小鸣赵建新
张心怡,姜 杨,刘小鸣,赵建新,陈 卫
(江南大学食品学院 江苏无锡 214122)
瑞士乳杆菌是奶酪的传统发酵剂之一,与其它商业上重要的乳酸菌相比,瑞士乳杆菌具有较强的蛋白水解能力[1]。以酪蛋白水解为例,通常乳酸菌的胞壁蛋白酶(CEP)先将其降解为寡肽(2~20 个氨基酸),然后通过肽转运系统将其运输到细胞内,在细胞内各种肽酶的协同作用下进一步降解为氨基酸。已知在乳酸菌中,瑞士乳杆菌的蛋白质水解基因最为多样化。首先,瑞士乳杆菌的胞壁蛋白酶基因的数量从1 个到4 个不等[2],酪蛋白的水解能力也存在差异[3-4]。另外,瑞士乳杆菌中肽转运系统的类型也存在差异,如瑞士乳杆菌DPC4571 具有3 种转运系统,而瑞士乳杆菌H10只有寡肽转运系统Opp 和二、三肽转运系统DtpT[5-6]。
另外,研究也表明不同瑞士乳杆菌菌株的蛋白水解活性和酪水解模式存在差异。Mekmene 等[3]发现瑞士乳杆菌水解酪蛋白时,对于β-酪蛋白的水解速度快于αs1-酪蛋白,而菌株间对于αs1-酪蛋白的水解速度则具菌株特异性。Jensen 等[7]的研究结果表明:瑞士乳杆菌对牛奶中各酪蛋白组分的水解偏好因菌株而异,且在水解度上有较大差异。同时,研究表明乳酸菌水解乳蛋白后可产生多种生物活性肽,目前已在发酵乳[8]和奶酪[9]中鉴定出多种血管紧张素转换酶(ACE)抑制肽,其中三肽VPP 和IPP 经临床证明具有抗高血压特性[10-11]。研究还表明不同的市售发酵乳的ACE 抑制活性有差异[12],这可能与发酵菌株对底物水解的差异有关。
虽然目前对部分瑞士乳杆菌菌株的水解特性有所了解,但是多数研究对于瑞士乳杆菌蛋白水解能力的评价局限于切割位点的差异性,少有研究通过肽组学来表征菌株切割区域的偏好差异。本研究选取两株蛋白水解能力较强的瑞士乳杆菌,研究其在牛脱脂乳中发酵对酪蛋白的水解差异,并通过肽组学来评估酶裂解模式差异及产物特异性,评价其ACE 肽的生成情况,解析其蛋白水解基因的差异性。
1 材料与方法
1.1 材料与试剂
1.1.1 试验试剂 脱脂乳粉,上海光明乳业有限公司;荧光标记酪蛋白,美国Thermo Fisher Scientific 公司;BCA 蛋白浓度测定试剂盒P0010,上海碧云天有限公司;Pierce 肽定量试剂盒,美国Thermo Fisher Scientific 公司;Bis-Tris-Propane,BBI 生命科学有限公司;二硫苏糖醇,阿拉丁试剂有限公司;胰蛋白胨、牛肉膏、葡萄糖、乙酸钠、酵母浸粉、MgSO4·7H2O、MnSO4·H2O、柠檬酸氢二铵、K2HPO4·3H2O、吐温-80、琼脂粉、氯化钠、尿素、柠檬酸钠二水合物、三氯乙酸、盐酸,分析纯,国药集团化学试剂有限公司;乙腈、三氟乙酸,色谱纯。
1.1.2 试验菌株 本文所使用的两株瑞士乳杆菌保藏于江南大学食品生物技术中心CCFM 菌库,其基因组信息已经上传至NCBI,样品编号为PRJNA555465。菌株具体信息如表1所示。

表1 试验菌株信息Table 1 Information of strains used in this study
1.2 仪器与设备
Waters 2695 高效液相色谱仪,美国Waters公司;多功能酶标仪Varioskan LUX,美国Thermo Fisher Scientific 公司;ST3100 型pH 计,常州奥豪斯仪器有限公司;液相色谱-质谱联用仪(液相型号为 nLC 1200,质谱型号为 Q Exactive),美国Thermo Fisher Scientific 公司;HWS-150 型恒温恒湿培养箱,上海森信实验仪器有限公司;SWCJ-1FD 型超净工作台,苏州安泰空气技术有限公司;AW500SG 型厌氧工作站,英国依莱泰科公司;5424 R 型冷冻离心机,Eppendorf 仪器有限公司;台式高速冷冻离心机TGL-16M、台式高速离心机TG16A,上海卢湘仪离心机仪器有限公司。
1.3 方法
1.3.1 培养条件 菌株在MRS 培养基37 ℃连续活化3 代后,接种于质量分数为11%的脱脂乳中再进行2 轮活化,培养条件为37 ℃。随后用50 mmol/L Tris-HCl(pH 6.5)洗涤细胞2 次,并调整活菌数至1×108~5×108CFU/mL,以2%的接种量接种于11%的脱脂乳粉,37 ℃培养24 h 后进行试验培养。MRS 培养基需要115 ℃高压灭菌20 min,脱脂乳配制完毕后在4 ℃放置12 h 进行水合,随后进行105 ℃灭菌10 min 待用。
1.3.2 酪蛋白利用情况测定 参考Xu 等[13]的方法并进行修改。用反向高效液相色谱(RP-HPLC)对瑞士乳杆菌发酵过程中酪蛋白主要成分的利用情况进行测定。取发酵至0,12 和24 h 的样品,参照以上方法进行预处理后过0.45 μm 的尼龙膜。色谱条件:色谱柱为Xbridge Peptide BEH C18为(300 A,3.5 μm),流动相A 中乙腈∶水∶三氟乙酸的比例为100∶900∶1(V/V/V),流动相B 中乙腈∶水∶三氟乙酸的比例为900∶100∶0.7(V/V/V),采用梯度洗脱方式。洗脱梯度为30%~40%B,0~35 min;40%~30%B;35~40 min;30%B,保持5 min。检测器为紫外(UV)检测器,检测波长为220 nm,上样量为20 μL,流速为0.8 mL/min,柱温30 ℃,每个样品平行测定3 次。
1.3.3 多肽分子质量的测定 参照陈嘉琪[14]的方法并进行修改。采用尺寸排阻(SEC)色谱的方法测定肽分子质量分布情况。样品预处理:取不同发酵时间的脱脂乳,用10%的TCA 将其pH 值调至4.6,12 000×g,4 ℃离心10 min,取上清液,用0.45 μm 的尼龙膜过滤。色谱条件参照以上方法。用肽定量试剂盒测定总肽含量,根据前处理浓度变化计算不同样品的肽浓度。每个样品平行测定3 次。
1.3.4 肽谱的测定 将1.3.3 节收集的肽用截留分子质量为10 ku 的超滤膜以4 000×g,4 ℃离心15 min,收集滤过液。测定肽浓度后根据Raveschot等[15]的方法,用Hypersep C18 微柱对样品进行脱盐处理,纯化后的肽通过蒸发离心在40 ℃下干燥2 h,然后在流动相A(0.1%甲酸和2%乙腈)中重新溶解。色谱条件:流动相B 为0.1%甲酸和90%乙腈;色谱柱为Acclaim PepMapTM RSLC(50 μm×15 cm,C18,2 μm,100 Å),洗脱梯度为6%~20%B,0~40 min;20%~32%B,40~52 min;32%~80%B,52~56 min,流速为0.2 μL/min。洗脱后的多肽直接电离进行全连续MS 扫描,然后进行3 次MS/MS 扫描。MS 分析采用正离子和数据依赖分析(DDA) 模式,MS 光谱采集范围为m/z 150~2 000,MS/MS 数据采集范围为m/z 180~2 000,扫描时间为0.1 s。通过Maxquant 1.5.2.8 进行数据库检索,使用Uniprot 中来源于Bos taurus 的数据库。使用非特定的酶裂解模式,设置了以下参数:质量容许度,0.02 u;从头合成容许度为0.01‰;MS/MS 的脱同位素容许度为0.007‰。蛋白质、肽谱匹配的假发现率(FDR)阈值设置为1%。根据Solieri 等[16]的方法来量化P1 和P1' 位点上某个氨基酸的裂解概率以及对裂解的正负效应。
1.3.5 菌株蛋白水解基因的确定 使用Illumina HiSeq×10 平台对瑞士乳杆菌的基因组进行草图测序,并使用SOAPdenovo 软件进行基因组组装。之后,利用Glimmer 和GeneMarkS 软件对序列进行编码,利用tRNAscan-SE v2.0 和Barrnap 软件进行tRNA 和核糖体RNA 序列预测。利用blastn工具对瑞士乳杆菌菌株的氨基酸序列与全基因组菌株CNRZ32 的胞壁蛋白酶基因、转运系统基因和肽酶基因进行BLAST 同一性百分比分析,同一性截点为98%。
1.3.6 发酵过程中菌株生长及产酸的测定 在0,3,9,12,15,24 h 取样测定pH 值,并对样品10倍梯度稀释至合适数量级,采用平板点样计数法测定菌株的活菌数。每个菌株相同时间点测定3次。
1.3.7 发酵过程中蛋白酶酶活测定 细胞悬浮液的制备:参考Miyamoto 等[17]的方法并进行修改。取0,6,12,24 h 的发酵脱脂乳30 mL,按1∶10 的比例加入质量分数为2%的柠檬酸钠溶液洗涤,10 000×g,4 ℃离心15 min,用10 倍体积含有5 mmol/L CaCl2的NaCl 溶液洗涤3 次,完成后,用100 mmol/L 磷酸钠缓冲液(pH 7.0)重悬至OD560=10 备用。胞壁蛋白酶酶活的测定:参照Stefanovic等[18]的方法并进行修改。用荧光酪蛋白进行胞壁蛋白酶活力的测定。在荧光专用96 孔板中加入100 μL 样品以及100 μL 工作液,37 ℃放置1 h,测定激发/吸收波长为485/538 nm 处的荧光强度。同时用BCA 试剂盒测定蛋白含量。菌株的胞壁蛋白酶酶活用每毫克蛋白增加的荧光强度表示,每个样品重复3 次。
1.3.8 统计分析及数据处理 本文中所有图形均采用Origin Pro 8.5 软件绘制;采用 SPSS 22.0通过单因素方差分析(ANOVA)和95%置信区间的Duncan 检验对数据进行分析,显著性水平为P<0.05。Upset 图采用TBtools 绘制。
2 结果与讨论
2.1 发酵过程中瑞士乳杆菌菌株对αs1-酪蛋白和β-酪蛋白的利用情况
两株瑞士乳杆菌菌株发酵脱脂乳12,24 h 样品中αs1-酪蛋白和β-酪蛋白的利用情况如图1所示。随着发酵时间从12 h 延长到24 h,αs1-酪蛋白和β-酪蛋白的利用量逐渐增加。两株菌株对αs1-酪蛋白和β-酪蛋白的利用上并未出现显著的偏好性差异。唯一的显著性差别在于M108 对β-酪蛋白的利用度略高于7M3,在24 h 内利用了6.33 mg/mL 的β-酪蛋白(约为7M3 利用量的3 倍);在发酵过程中,这两株菌株对αs1-酪蛋白的水解情况无明显差异。

图1 7M3 和M108 发酵过程中对αs1-酪蛋白和β-酪蛋白的利用率Fig.1 The αs1-CN and β-CN utilization of Lactobacillus helveticus 7M3 and M108 during fermentation
2.2 发酵过程中肽分子质量分布情况
试验菌株发酵12 h 和24 h 后的肽分子质量分布及其含量如图2所示,两株瑞士乳杆菌无论是在肽含量还是不同分子质量肽的分布上都有明显差异。脱脂乳中的肽质量浓度为(4.75±0.10)mg/mL,发酵过程中两株瑞士乳杆菌的总肽浓度都呈现先增加后降低的趋势,M108 在12 h 的总肽含量为(5.99±0.60)mg/mL,随后在24 h 内下降到(5.04±0.40)mg/mL,而在24 h 时7M3 的样品中肽含量低于脱脂乳。
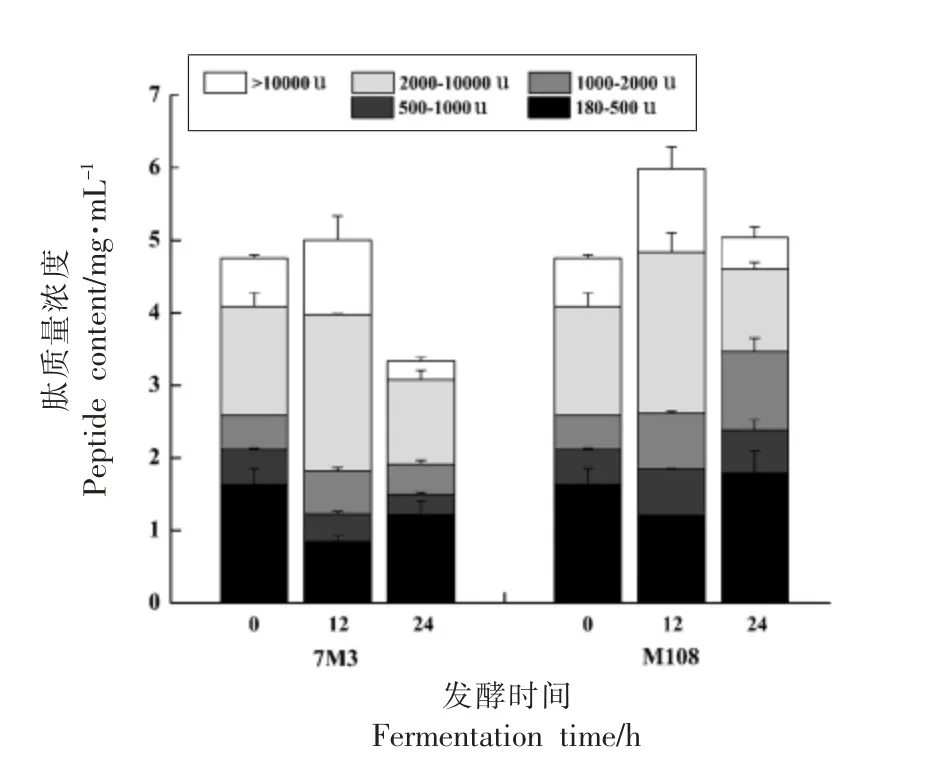
图2 菌株7M3 和M108 发酵过程中不同分子质量肽的分布和浓度Fig.2 Distribution and concentration of varying molecular weight peptides with strains 7M3 and M108
除了含量变化外,发酵还导致了样品中不同分子质量肽的比例发生了动态变化。脱脂乳中的肽分子质量在2 000 u 以上和2 000 u 以下的多肽含量大致相等,主要以180~500 u 和2 000~10 000 u 的肽片段为主。但在发酵过程中,不同发酵时间下7M3 和M108 样品中多肽分布存在差异性。发酵12 h 的样品中以2 000~10 000 u 的肽片段为主,而发酵24 h 后,样品中180~500 u 的多肽含量逐渐增大。
2.3 发酵样品的肽异质性
选取发酵24 h 后的样品进行肽组分析,肽种类及特异性肽在相应蛋白序列上的分布情况如图3、图4所示。在7M3 和M108 发酵24 h 的样品中,分别共鉴定出432 个和353 个多肽,大部分肽来源于酪蛋白中最丰富的组分:αs1-酪蛋白(34%)和β-酪蛋白(45%),其中7M3 积累的多肽组成更多样化。在鉴定到的多肽中,33%的多肽为特异性肽,包括45 种来自7M3、16 种来自M108的源于β-酪蛋白的特异性肽;21 种来自7M3、25种来自M108 的源于αs1-酪蛋白的特异性肽;而来源于κ-酪蛋白和αs2-酪蛋白的肽较少(图3)。

图3 24 h 菌株7M3 和M108 发酵乳中鉴定到的肽段数量Fig.3 Number of peptides identified from strains 7M3 and M108 in 24 h fermented milk
两株瑞士乳杆菌的源于αs1-酪蛋白和β-酪蛋白的多肽异质性解析如图4所示,其偏好水解区域(热图上的深灰色区域)呈现显著性差异。两株瑞士乳杆菌对αs1-酪蛋白的裂解产物具有一定的重叠度,但7M3 主要水解αs1-酪蛋白C 端的f176~193 区域(呈现无规卷曲结构),而M108 的水解区域集中于f2-22 和f85-106 等疏水性区域。7M3 和M108 对于β-酪蛋白的水解位点偏好差异更大,7M3 的样品中含有丰富的来自f40-55、f78-99、f131-142 和f144-163 区域的多肽,与以往研究中产ACE 抑制活性肽的区域重合(f58-90、130-140)[19]。

图4 24 h 发酵乳中来源于αs1-酪蛋白(上)和β-酪蛋白(下)的特异性肽及其在蛋白序列上的分布Fig.4 Distribution of specific peptides derived from alphas1-CN and beta-CN in the 24 h fermentation milk of two strains
与已有报道比对发现,7M3 和M108 样品中分别含有13 和11 种ACE 抑制肽,其中有9 种二者共有(表2)。7M3 的特异性ACE 抑制肽中TPVVVPPFLQP 和VPP 来源于7M3 偏好切割的区域f78-99,其中VPP 已被证实具有体内降血压功能。于洋等[12]对4 种市售发酵乳中的ACE 抑制肽进行鉴定,发现ACE 抑制活性最高的发酵乳含有4 种ACE 抑制肽,其中TPVVVPPFLQP 在我们的发酵物中也被鉴定到。

表2 24 h 发酵乳中的ACE 抑制肽Table 2 ACE-inhibitory peptides generated from bovine casein in the 24 h fermentation milk of two strains
2.4 酪蛋白裂解位点特异性分析
P1 和P1'位点氨基酸残基对试验菌株裂解概率的影响如图5所示。7M3 和M108 对两种酪蛋白组分表现出不同的切割偏好性。在αs1-酪蛋白中,当P1 位点为D、R、F、P、I、Q、L 等氨基酸时,菌株对裂解概率的影响为正,其中M108 主要对带负电荷的D、R、F 和疏水性的P 表现出更多的裂解偏好(图5a)。C 端含有疏水氨基酸F、P、L 被认为是有效的ACE 抑制肽的特征[20],同时带正电氨基酸R 的存在可以增加ACE 抑制活性[20]。P1' 位点的氨基酸R 对裂解具有最强的正向作用,氨基酸G、D、K、H 和F 也表现出正向作用,但作用裂解影响较低(图5b)。
β-酪蛋白的裂解模式与αs1-酪蛋白有显著差异。多肽在P1 位点含有氨基酸W 时被裂解的概率最高,而对αs1-酪蛋白裂解有负效应的氨基酸M、N、T 对β-酪蛋白有轻微的正效应(图5c)。在P1' 位点,氨基酸T、D、H 和W 均对裂解有积极作用,不同的是D 对M108 的裂解表现出更积极的作用,而7M3 更倾向于裂解P1'位点含T 的肽(图5d)。

图5 瑞士乳杆菌7M3 和M108 对P1 和P1' 位点氨基酸的裂解偏好Fig.5 Cleavage preferences of two strains for amino acids at the P1 and P1' subsites
综合上述分析得知,7M3 和M108 对αs1-酪蛋白和β-酪蛋白表现出不同的偏好切割模式,这可能与由其蛋白酶、肽转运系统、肽酶等特性有关。
2.5 菌株的蛋白水解相关基因鉴定
两株瑞士乳杆菌的蛋白水解相关基因如表3所示。结果显示瑞士乳杆菌7M3 和M108 在蛋白酶、肽转运系统、肽酶等相关基因分布上存在差异性。7M3 和M108 都拥有单一的胞壁蛋白酶基因,但其分别为prtH2 和prtH3。另外,在两株瑞士乳杆菌中都鉴定到了寡肽转运系统Opp;但是转运长度为2~9 个氨基酸残基的肽的Dpp 仅存在于M108 中,而二、三肽离子转运系统DtpT 只存在于7M3 中。对于肽酶而言,除了pepL 外,其余14 种肽酶都存在于这两株瑞士乳杆菌中,这证实了肽酶相对保守的说法[2]。

表3 试验菌株中蛋白酶、肽转运系统和肽酶的分布情况Table 3 Distribution of proteinase,peptide transporters and peptidases of the proteolytic system in experimental strains
有研究提出CEP 差异会带来菌株蛋白质水解能力的不同,当菌株含有prtH 和prtH2 两个胞壁蛋白酶时,其蛋白水解活性显著高于仅含有prtH 的菌株[3]。CEP 差异带来的分解模式的多样性也已被证实,含有prtH2 和prtH3 基因的菌株与含有prtH1 菌株发酵后的产物有明显差异[15]。转运系统的差异也代表着菌株的吸收多样性,二、三肽和寡肽转运系统的特异性在乳酸乳球菌中已被证实[21],而目前对于瑞士乳杆菌中转运系统的特异性还少有研究。因此推测上述肽的异质性是由于7M3 和M108 胞壁蛋白酶及转运系统差异。而特定胞壁蛋白酶对酪蛋白的切割效率和位点及不同转运系统的转运特异性还需要更多的试验去验证,这可能帮助我们筛选出高蛋白水解效率的基因组合,并从产物角度评估其对产品的潜在价值。
2.6 发酵过程中瑞士乳杆菌菌株的蛋白酶活性和生长特性
在发酵过程中两株瑞士乳杆菌菌株的生长特性和胞壁蛋白酶酶活如图6所示。发酵过程中两株瑞士乳杆菌胞壁蛋白酶酶活特性显著不同,而生长呈现相似趋势。在12 h 内,7M3 和M08 呈现相似的生长速率,但是在12~24 h 内M108 的生长速率大于7M3。M108 在对数前期(6 h)达到酶活最高点(2 120 荧光/mg 蛋白),随后酶活显著下降。相反,7M3 在整个发酵过程中保持相对较低但稳定的酶活。胞壁蛋白酶作为蛋白水解的第一步,M108 的高酶活可能促进了菌株对β-酪蛋白的水解。但是胞壁蛋白酶的切割特异性是否会对菌株生长代谢产生影响并表现出酶活差异还需要进一步去验证。

图6 发酵过程中菌株生长和胞壁蛋白酶活性的变化Fig.6 Growth and cell-envelope protease activity during fermentation of the strains 7M3 and M108
3 结论
研究表明瑞士乳杆菌对αs1-酪蛋白和β-酪蛋白的水解无显著偏好,但M108 对β-酪蛋白具有更强的蛋白水解和产肽能力。不同肽分子质量的肽浓度在发酵过程中呈动态变化,分子质量在180~500 u 的小肽先消耗后积累,而分子质量为2 000~10 000 u 的肽段变化趋势则完全相反。对24 h 的发酵乳的肽谱表明7M3 和M108 表现出肽的异质性,前者产生更多特异性肽,其中大部分来自β-酪蛋白的f78-99 区域,如ACE 抑制肽VPP。二者来源于αs1-酪蛋白的特异性肽也分布于序列的不同区域,7M3 偏好切割C 端,而M108 产生的肽主要来源于N 端和中间区域。对鉴定到的肽进行P1 和P1' 位点的氨基酸切割偏好分析,7M3 和M108 对不同酪蛋白表现出差异切割模式,其中M108 对αs1-酪蛋白的切割特点暗示其可能产生一些潜在ACE 抑制肽。两株菌株的蛋白水解相关基因分布也存在差异,两者含有不同的胞壁蛋白酶及差异转运系统,但其肽酶基因相对保守。发酵前期M108 呈现了较高胞壁蛋白酶酶活。
