非小细胞肺癌肿瘤微环境中NK细胞和TAMs的分布特点
2022-07-19张兰兰毛志远李向敏于海燕夏秀玲樊再雯
张兰兰,毛志远,李向敏,李 燕,于海燕,晋 颖,夏秀玲,樊再雯
肺癌是最为常见的恶性肿瘤之一,其发病率、病死率呈逐年升高的趋势,其中非小细胞肺癌(nonsmall cell lung cancer,NSCLC)约占肺癌的85%[1]。近年来有研究报道,肿瘤细胞和肿瘤微环境(tumor microenvironment,TME)共同影响肿瘤的侵袭和转移[2]。TME由内皮细胞、成纤维细胞和浸润性免疫细胞等组成,TME中的免疫细胞包括T细胞、B细胞、树突细胞、自然杀伤(natural killer,NK)细胞、肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)、中性粒细胞和骨髓来源的抑制细胞等[2]。与CD8+T细胞、B细胞等适应性免疫细胞不同,NK细胞和巨噬细胞是2种主要杀伤肿瘤细胞的固有免疫细胞,为了探讨NSCLC患者TME中NK细胞和TAMs的分布特点,本研究检测了87例NSCLC患者组织标本中CD56、CD68和CD163蛋白的表达,进一步探讨肿瘤微环境与患者临床特征及预后的关系,为肺癌术后患者的治疗方案提供参考依据。
1 材料与方法
1.1 材料 选取2016年1月—2018年12月在空军特色医学中心(原空军总医院)手术切除,经病理学证实为NSCLC且临床资料完整的患者87例。根据Chen等[3]研究定义肿瘤微环境免疫分型(tumor micro-enviroment type,TMIT),TMIT Ⅰ型:CD8+PD-L1+;TMIT Ⅱ型:CD8-PD-L1-;TMIT Ⅲ型:CD8-PD-L1+;TMIT Ⅳ型:CD8+PD-L1-。本研究TMIT分型在前期实验的基础上进行了补充及完善[4]。所有患者术前均未接受过治疗,并且无其他恶性肿瘤、自身免疫性疾病及严重感染性疾病,样本收集及研究方案得到医院伦理委员会审核,所有参与患者或家属均告知并签署知情同意书,随访方式主要以电话、门诊、住院等对患者进行随访,随访时间截止2020年10月。
1.2 主要试剂 CD56抗体试剂(ZM-0057)、CD68抗体试剂(ZM-0060)、CD163抗体试剂(ZM-0428)、通用二步法试剂盒(PV-9000)、DAB显色试剂盒(ZLI-9018)均购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学链霉菌抗生物蛋白-过氧化物酶连接(streptavidin-perosidase,SP)方法 石蜡组织4 μm连续切片,捞于防脱片上,于65 ℃烤箱烘烤1~2 h脱蜡,切片置于pH 6.0柠檬酸缓冲液进行抗原修复,置入3% H2O2室温孵育15 min封闭抗原,滴加一抗(CD56抗体1:200,CD68抗体1:200,CD163抗体1:400),置于试剂盒中37 ℃ 30 min;PBS冲洗5次,滴加辣根过氧化物酶标记的二抗,室温孵育30 min;PBS冲洗后二氨基联苯胺(3,3-diaminobezidin,DAB)显色,洗涤,苏木精复染,脱水,透明,自动封片机下封片,镜下观察。阴性对照:用PBS代替一抗。
1.4 结果判读标准 染色后所有切片由2位病理科医师按双盲法进行读片,选取5个具有代表性的视野。判断结果:CD56 阳性染色位于细胞膜和/或细胞质,按照染色强度计分,未染色计为0分、淡黄色计为1分、棕黄色计为2分、棕褐色计为3分;按阳性细胞染色比例计分,未染色计为0分、阳性细胞<25%计为1分、25%~50%计为2分、>50%计为3分。两项积分相乘,0分为阴性、≥1分为阳性[5]。CD68标记的TAMs以细胞质呈现棕黄色为阳性表达,CD163标记的M2型TAMs以细胞的胞质或胞膜呈现棕黄色为阳性表达,判定标准:根据TAMs浸润密度进行评分,即每视野内阳性细胞数占所有细胞数的50%;≥50%的阳性细胞为高浸润,<50%的阳性细胞数为低浸润。TAMs浸润肿瘤微环境间质区域定义为边缘型巨噬细胞,TAMs浸润至癌巢中心部位定义为中心型巨噬细胞。
1.5 统计学处理 应用SPSS 25.0 软件对数据进行分析,率的比较应用χ2检验,应用Kaplan-Meier绘制生存曲线,单因素分析用Log-rank检验,以COX回归进行多因素生存分析。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 87例中男53例(60.92%),女34例(39.0 8%)。年龄39~84岁。有吸烟史者39 例(44.83%),无吸烟史者48例(55.17%)。TNM分期:Ⅰ期45例(51.72%),Ⅱ期19例(21.84%),Ⅲ期23例(26.44%)。腺癌58例(66.67%),鳞癌29例(33.33%)。EGFR突变者35例(40.23%),EGFR野生型52例(59.17%)。TMIT分型结果:TMIT Ⅰ型29例(33.33%),TMIT Ⅱ型12例(13.79%),TMIT Ⅲ型 11例(12.64%),TMIT Ⅳ型35例(40.23%)。
2.2 CD56、CD68和CD163蛋白在NSCLC中的表达特点及其与临床病理学因素分析 CD56+NK细胞阳性表达27例(31.03%),阴性表达60例(68.97%)。CD56+NK细胞主要表达在肿瘤间质,癌巢几乎没有CD56+NK细胞(图1)。CD56+NK细胞在Ⅲ期、EGFR野生型的NSCLC组织中高表达(P<0.05)。CD68+TAMs与CD163+TAMs在肿瘤间质与癌巢中心中均有浸润(图2、3),边缘型和中心型CD68+TAMs在Ⅲ期的NSCLC组织中高浸润(P<0.05)。边缘型CD163+TAMs在Ⅲ期、腺癌的NSCLC患者组织中高浸润(P<0.05);中心型CD163+TAMs在吸烟、腺癌、Ⅲ期、EGFR野生型的NSCLC患者组织中高浸润(P<0.05),在性别、年龄和TMIT分型的NSCLC组织中表达差异无统计学意义(P>0.05)(表1)。

表1 CD56+NK 细胞、CD68+TAMs和CD163+TAMs表达与NSCLC患者临床病理学因素分析(例)

图1 CD56+NK细胞在NSCLC患者组织中免疫组化的检测结果(SP,×400)
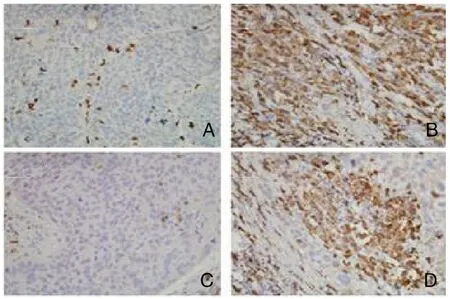
图2 CD68+TAMs在NSCLC患者组织中免疫组化的检测结果(SP,×400)
2.3 CD56、CD68和CD163蛋白表达与NSCLC患者DFS相关性分析 截至2020年10月随访结束,87例中44例术后复发,中位无病生存期(disease free survival,DFS)为43.0个月。经Log-rank单因素分析显示,边缘型CD68+TAMs高浸润、边缘型CD163+TAMs高浸润的NSCLC患者的DFS较短(P<0.05)(图4、5)。将所有指标纳入COX模型进行多因素回归分析,边缘型CD163+TAMs高浸润是影响DFS的独立危险因素(P<0.05)。
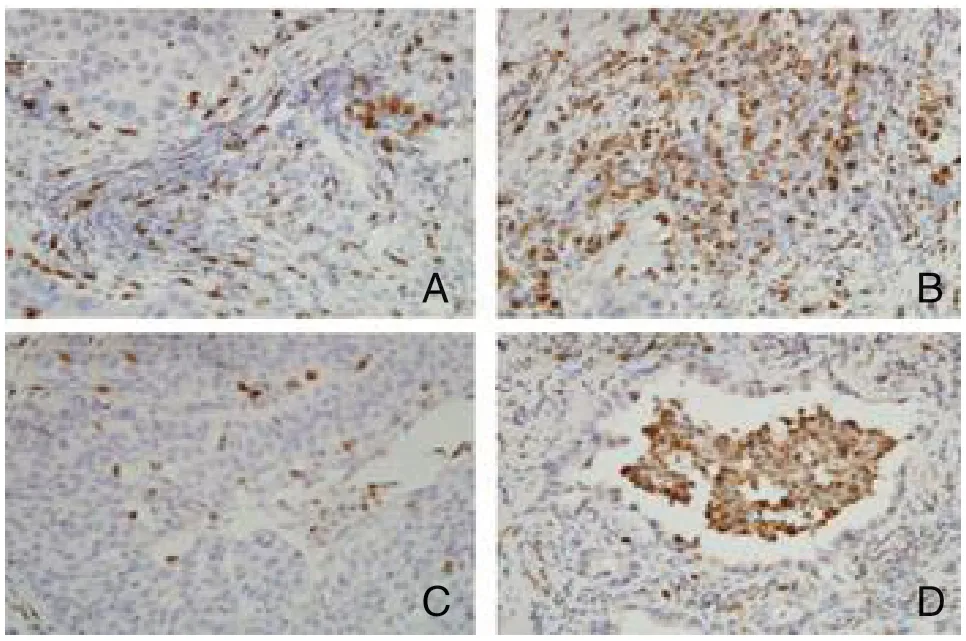
图3 CD163+TAMs在NSCLC患者组织中免疫组化的检测结果(SP,×400)

图4 边缘型CD68+TAMs不同浸润程度与NSCLC患者生存曲线

图5 边缘型CD163+TAMs不同浸润程度与NSCLC患者生存曲线
3 讨论
TME是一个复杂的环境,在肿瘤细胞的周围有免疫细胞、间质细胞、成纤维细胞等各种细胞和丰富的细胞因子,这些物质形成一个具有缺氧、慢性炎症和免疫抑制性的TME[2]。多数免疫细胞的功能在TME中发生改变,如NK细胞不能发挥直接杀伤肿瘤细胞的功能[6],TAMs也不能发挥有效的吞噬异己的能力,甚至发生极化,其中发生极化的M2型TAMs有促进肿瘤转移的能力,有研究发现M2型TAMs与新生血管和微淋巴管密度相关[7-8],可能是TAMs分泌的物质刺激肿瘤细胞的增殖和转移[9]。多种癌症均有报道,TAMs的高浸润影响患者预后,如非小细胞肺癌、胃癌和乳腺癌等[10-12]。NK细胞的亚群在细胞毒性、细胞因子产生和归巢能力方面表现出功能差异,根据NK细胞表面CD56的表达水平,NK细胞分为CD56bright和CD56dim 2种不同的表型:CD56bright NK细胞具有产生丰富细胞因子的能力,而CD56dim NK细胞具有较强的细胞毒性[13]。有研究发现,肺内约10%~20%的淋巴细胞为NK细胞,绝大多数NK细胞为CD56dim表型[14-15],故本研究选取CD56做为NK细胞的标记物。以往研究仅对CD68进行免疫染色,CD68是最常见的泛巨噬细胞标志物[16-17]。TAMs可分化成不同的表型,如抑制肿瘤的M1型巨噬细胞和促进肿瘤的M2型巨噬细胞[7]。M2型TAMs主要表达CD163蛋白、CD204蛋白和CD206蛋白[18-19],故本研究选择CD68抗体和CD163抗体作为研究TAMs的指标。有研究报道,巨噬细胞分布在肺癌组织的不同区域中,如在癌组织与间质组织中的TAMs可能表现出不同的生物学特性[20-21]。本研究主要观察CD56+NK细胞、CD68+TAMs和CD163+TAMs在NSCLC肿瘤组织的分布。
本研究结果显示,NSCLC组织中CD56+NK细胞多数呈阴性表达,EGFR野生型NSCLC肿瘤间质高浸润,与既往研究结果相似[22-23]。首先,可能是NK细胞数量少,NK细胞在NSCLC癌组织和肿瘤间质之间分布呈显著的异质性,癌组织中心区几乎没有NK细胞,而在肿瘤间质中NK细胞也呈选择性地分布[23];其次,NK细胞在TME中受到免疫抑制作用,肿瘤细胞分泌的细胞因子能抑制NK细胞的功能,如IL-6、IL-10、转化生长因子(transforming growth factor-β,TGF-β)、前列腺素E2(prostaglandin E2,PGE2)、吲哚胺-2,3-双加氧酶(idoleamine 2,3-dioxygenase,IDO)等[24]。本研究未发现NK细胞对DFS的影响,但有研究发现在胃癌组织中NK细胞高浸润的患者化疗预后较好[25],考虑肺癌与胃癌存在生物学差异以及样本量的关系,有待于进一步扩大样本量和纳入不同肿瘤进一步研究;也有研究认为影响患者生存的是NK细胞的表型和功能,而不是NK细胞的浸润密度[23]。
本研究Ⅲ期的NSCLC患者,其边缘型和中心型CD68+TAMs呈高浸润,可能是肿瘤细胞与CD68+TAMs能够通过旁分泌细胞因子形成旁分泌环,为NSCLC的侵袭和疾病进展提供了适宜的微环境[26-27]。边缘型CD163+TAMs在Ⅲ期、腺癌的NSCLC组织中以高浸润多见,可能是腺癌和鳞癌的TME之间存在差异性造成的。中心型CD163+TAMs在Ⅲ期、吸烟、EGFR野生型的NSCLC患者中高浸润。吸烟患者CD163+TAMs高浸润,可能是烟草能刺激多种免疫细胞浸润,包括中性粒细胞、巨噬细胞、T细胞和B细胞等[28]。一项研究报道,EGFR野生型NSCLC患者肿瘤间质的TAMs计数更高[29],而另一项研究中心型CD204+(M2型)TAMs在EGFR野生型的NSCLC患者中低浸润[30],可能是EGFR野生型与肿瘤中的巨噬细胞迁移有关,但其机制尚需进一步研究明确。
边缘型CD68+TAMs、CD163+TAMs高浸润的NSCLC患者DFS较短,在COX回归模型的多因素分析中,发现边缘型CD163+TAMs是影响DFS的独立危险因素。可能是早期肺癌患者的TME中M2型TAMs数量较少,CD68+TAMs在NSCLC进展期间可分化为CD163+TAMs促进肿瘤的侵袭性,且M2型TAMs主要分布于肿瘤间质,随着病情的进展可移入癌巢,故CD163是一个较CD68预测NSCLC患者预后更佳的指标。
在本研究纳入了免疫分型四分型法,未发现NK细胞、TAMs与免疫分型的相关性,可能是TME中存在多种免疫细胞,需要纳入更多的免疫细胞共同定义TME的性质。
综上所述,NSCLC患者TME中的NK细胞数量少,可能是肺癌微环境对NK细胞有抑制作用,导致其数量和比例明显下降。CD163+TAMs较CD68+TAMs更能反映TME具有免疫抑制性。对于边缘型和中心型CD163+TAMs高浸润的肿瘤患者,即使是早期患者,可能也需要术后辅助化疗或靶向治疗。本研究样本量较小,故下一步将进行大样本量的统计,并且完善国内外文献中涉及而本研究未完成的统计,以此为了解NSCLC肿瘤微环境中免疫细胞的分布特点,并进一步探索其临床意义。
