水稻叶舌紫色性状基因的定位分析
2022-07-19黎键湧欧克纬阎卫清梁云涛王丽萍蔡中全
黎键湧,刘 鹏,欧克纬,阎卫清,凌 莹,黄 威,金 刚,梁云涛,王丽萍,蔡中全*
(1.广西农业工程职业技术学院,广西 崇左 530028; 2.广西大学,广西 南宁530004; 3.广西壮族自治区亚热带作物研究所,广西 南宁 530001; 4.广西壮族自治区农业科学院 水稻研究所/广西水稻遗传育种重点实验室,广西 南宁530006)
0 引言
【研究意义】水稻是重要的粮食作物,也是生物研究的模式植物,水稻器官的紫色是花色素苷积累显色的结果,是重要的标记性状,水稻紫色部位的花色苷等生物活性物质含量高于其他部位[1-3]。由于叶舌紫色性状是一种不受环境及其他生物指标影响的表现型性状,可作为标记性状应用于辅助育种、品种鉴定、制种除杂和植物新品种权保护等方面。因此,探索水稻紫色性状的遗传模式、控制基因等,可为相关种质资源以及基因的利用提供参考。【前人研究进展】花色苷是花色素类物质与糖类物质结合而成,二者以糖苷键结合,而以花青素类物质结合的花色苷,是水稻叶片等部位呈现紫红色的主要物质。NAGAO等[4]对水稻花色苷遗传研究进行总结,提出色素原基因C、酶激活及调节基因A与部位特异性基因P共同作用的遗传模式。目前关于水稻花青素CAP遗传系统的研究中,对于相关控制基因的位置已有多个成果。HU等[5]利用玉米花色苷调节基因的cDNA为探针,在水稻cDNA文库中筛选出与玉米花色苷调节基因同源的水稻花色苷调节控制基因Pb(Prp-b)以及Pa(Prp-a),并将2个基因分别定位在第1与第4染色体上;CAUSSE等[6]通过研究水稻种皮颜色遗传,再次成功将Pb与Pa基因成功定位于第1与第4染色体上,并确定2个基因的互补遗传模式。【研究切入点】水稻叶舌颜色是常用的重要标记性状,但其颜色决定机制尚未明确。鲜见前人对水稻紫色叶舌性状决定基因的研究,开展其遗传分析和相关基因的定位研究,对揭示叶舌颜色决定机制具有重要意义。【拟解决的关键问题】以叶舌表现为绿色的日本晴与叶舌表现为紫色的WPB-1作为亲本,通过系列杂交、自交与回交构建BC1F4代群体,包含18个遗传群体共计1 500株单株,通过表型统计与遗传分析进行遗传模型的预测,并根据叶舌表型进行分区采样,采用GSR40K基因芯片技术,利用SNP标记进行基因检测,筛选出存在差异的分子标记位点以寻找目标基因可能存在的区段。通过表型的统计以及对遗传模型的预测,对水稻紫色叶舌性状基因进行初步的定位分析,为水稻紫色叶舌性状的利用提供理论参考。
1 材料与方法
1.1 材料
选用日本晴和WPB-1为亲本进行杂交,通过系列杂交构建BC1F4群体。WPB-1为热带粳亚种水稻,该品种植株内富含花色素,叶片边缘、叶耳、叶舌、茎基部以及颖壳等部位呈紫黑色或紫红色。
1.2 方法
1.2.1 遗传群体构建 2017年4月,在广西大学农学院水稻育种试验田种植亲本日本晴和WPB-1(紫色叶舌),6月对亲本进行杂交,同年晚稻种植F1代。2018年早稻种植F2代,选取紫色叶舌单株与日本晴进行回交,同年晚稻种植回交种子获得BC1F1。2019年早稻种植BC1F2代群体,晚稻种植BC1F3。2020年早稻种植BC1F4株系34个,每个株系种植50~150株。BC1F4遗传群体构建详见图1。

图1 BC1F4遗传群体的构建过程
1.2.2 性状观察及遗传模型推测 观察成株数大于50株且存在叶舌颜色分离的株系群体,统计各单株叶舌颜色。计算表型分离比例,根据分离比例进行遗传模型预测。
1.2.3 GSR40K水稻高密度全基因组SNP芯片测序与分析 成熟的水稻种子单株编号收种。选取不同叶舌颜色的单株各30~40株,取其种子进行发芽,待叶片长度达3 cm左右进行取样,分类取样构建混池。每混池包含30~40株水稻单株,样品采用水稻GSR40K高密度SNP芯片(武汉双绿源创芯科技研究院有限公司)进行检测分型。检测获得芯片数据后,利用Genome Studio分析2个表型混样池间的碱基差异,然后根据其在染色体位置绘图展示,差异区段为目标基因可能所在区间。
1.3 数据统计与分析
芯片检测的数据在染色体框架图中展示,根据日本晴第6版基因组序列信息构建水稻12条染色体的框架(条状图),使用genome studio分析软件对检测原始数据进行展示,横坐标为染色体号数,纵坐标为染色体长度(单位为Mb)。杂合位点的展示,根据检测结果将杂合碱基位点标识在染色体框架图上,绘图展示杂合区域的位置和大小等情况。样品间差异位点展示,分析2个样品间的SNP标记差异,然后根据其在染色体位置,绘图直观展示差异位点位置和区间大小,差异区段为目标基因所在区间。纯合的差异碱基,标记为AA或BB,杂合的标记为AB。利用The Rice Annotation Project Datebase网站(https://rapdb.dna. affrc.go.jp/viewer/gbrowse/irgsp1/)公布的日本晴基因组序列及基因信息,分析目标区段内与花色苷合成相关的基因,进行目标基因预测分析。
2 结果与分析
2.1 BC1F4代叶舌表型
观察BC1F4代遗传株系群体发现,叶舌颜色和颖尖色有3种分离情况,分别为叶舌紫色且颖尖片状紫色的植株,样品编号A-1;叶舌颜色为绿色但颖壳尖端点状紫色的植株,样品编号A-2;叶舌绿色且颖尖也绿色的植株,样品编号A-3。
统计发现,不同株系表型分离情况不同,有不分离的株系,有分离紫色叶舌︰绿色叶舌近似3︰1的株系,还有近似9︰7的株系。紫色叶舌︰绿色叶舌=3︰1或者紫色叶舌︰绿色叶舌=9︰7的均通过卡方检验,均达显著水平(表1)。部分株系群体叶舌颜色分离呈9︰7,表明有2个基因分离,即水稻叶舌的颜色分离至少由2个基因控制,且表现为互补效应。

表1 BC1F4代群体叶舌性状的分离情况
2.2 GSR40K基因芯片检测结果
2.2.1 等位位点纯合度 从各个样品的各条染色体的纯合(染色体条形图空白区)和杂合(染色体条形图阴影区)情况(图2)看,整体上,各条染色体纯合程度中等,反映混样群体的纯合进程,与遗传群体处于中高遗传世代的情况吻合;染色体间存在明显的差异,如第7染色体绝大部分已经纯合,而第4染色体纯合程度较低,大部分区域仍处于杂合状态。

注:1,2,3…12为染色体号;A-1为紫色叶舌,紫色稃尖;A-2为绿色叶舌,紫色稃尖; A-3为绿色叶舌,绿色稃尖,下同。条形图中的阴影部分表示杂合碱基位点,空白表示纯合位点。
2.2.2 芯片检测的差异SNP位点 通过对A-1与A-2、A-1与A-3、A-2与A-3的SNP标记两两比较,得出样品间具有多态性SNP的情况(图3)。A-1与A-2在第4染色体上有1段差异区间,在A-1中为杂合,在A-2中为纯合,为概率较高的候选区间;A-1与A-3在第2、3、6、8、10染色体上存在差异位点;A-2与A-3在第2、3、4、6、8、11、12染色体上存在差异位点。A-1与A-2和A-3存在的差异区间为目标区间。
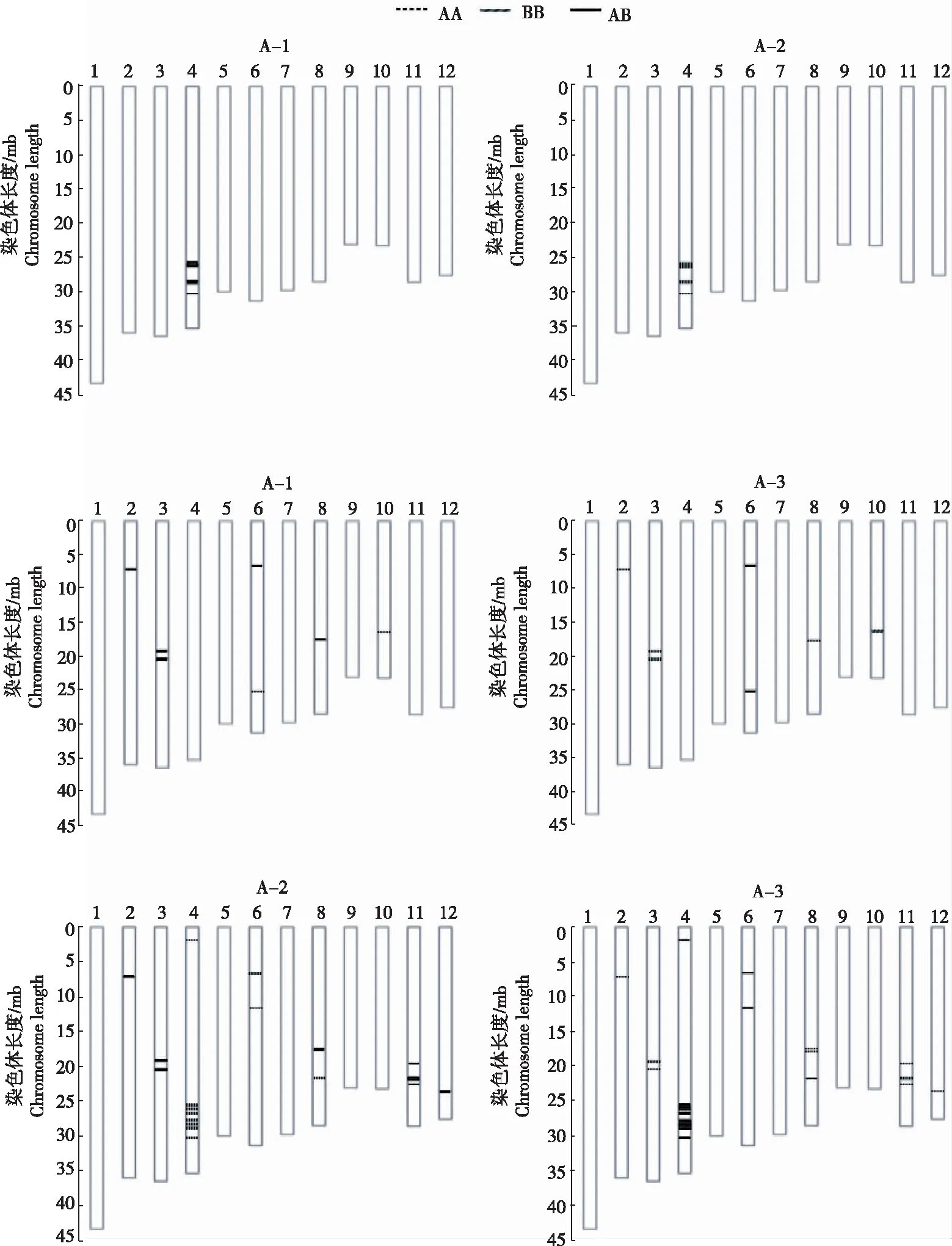
图3 样本间的SNP差异位点
2.2.3 叶舌紫色性状的基因初步定位 依据A-1与A-2和A-3存在的SNP差异,再结合3个样品的表型(A-1双显性基因,A-2和A-3为单显性或者无显性基因),筛选出27个候选SNP标记,3个标记位于第2染色体,6个位于第3染色体,2个标记位于第8染色体,16个标记位于第4染色体;分别对应4个区间,为目标基因所在的候选区间,其中第4和第3染色体的差异区间差异标记数量较多,是候选区间的可能性更大(表2)。

表2 紫色叶舌性状分子标记信息
2.2.4 区间内候选基因 分析候选区间发现,花青素积淀调控基因Os04g0557500位于第4染色体第27 915 598~27 939 357 bp区间[7](表3),在本研究所定位的候选区间内(第4染色体25 000 001~29 000 000 bp)。说明本研究的目标基因之一可能是已被发现的Os04g0557500基因。另1个目标基因,推测位于第3染色体19 140 450~20 443 511 bp、第2染色体7 000 001~8 000 000 bp,或者第8染色体17 000 001~18 000 000 bp区间。

表3 花色苷生物合成控制基因
3 讨论
花色素类物质与糖类物质结合而成的花色苷是水稻叶片等部位呈现紫红色的主要物质。花色苷对于氧离子、氢氧根离子、过氧化氢、自由基等强氧化物质的有效还原剂或螯合剂,能降低植物以及动物体内的过氧化作用。意大利的CIGNARELLA[2]、日本的DEGUCHI等[3]科学家先后利用大麦、蓝莓等植物提取花色苷,研究花色苷对大鼠糖尿病等疾病的影响,发现花色苷有降血糖、抗肿瘤等动物保健性作用。由于花色苷的保健价值,其生物合成在植物中已被广泛研究[8-10]。该研究群体材料的表型统计与遗传分析表明,在发生性状分离的区号内,出现紫色叶舌︰绿色叶舌=9︰7的性状分离比,卡方检验达显著水平,说明在研究群体中叶舌的颜色性状是由2个基因控制,并且当2个基因均为显性时叶舌表现为紫色,否则表现为绿色。这2个基因的互作表现为互补作用。
BSA作为一种快速高效的基因定位方法,在遗传分析与基因定位等领域应用广泛。借助BSA法,TAKESHIMA等[11]筛选出了与荞麦发芽抗性相关的基因,张久坤等[12]在大豆基因组内定位到10个与株高相关联的染色体区间;SEO等[13]定位到洋葱块茎颜色性状的控制基因;GAO等[14]定位到1个调控水稻紫色叶片性状的隐形基因Plr4。本研究所使用的BSA定位工具GSR40K基因芯片,其采用SNP标记,针对水稻筛选出32 887个高质量位点,在水稻目标性状关联基因的寻找与分析上有广泛应用[15]。利用GSR40K基因芯片进行基因检测,筛选出研究群体内与叶舌颜色性状相关的存在差异的27个分子标记位点,分别位于第2、3、4和8染色体上。
前人对水稻花青素遗传模型已作出CAP基因系统的预测,在日本晴的基因组中共筛选出Os01g0633500、Os04g0557500与Os06g0205100等3个控制基因[7]。经过对比发现,研究群体中位于第4染色体目标区段上的目标基因可能是Os04g0557500,该基因控制花色苷的积淀;该基因编码bHLH转录因子,其启动子会由于反转座子的插入而重排,最终导致异位表达[16]。另1个决定紫色叶舌的目标基因可能位于第3染色体19 140 450~20 443 511 bp、第2染色体7 000 001~8 000 000 bp,或者第8染色体17 000 001~18 000 000 bp,而非目前已定位的Os01g0633500或Os06g0205100基因。由于未能在第2、3和8染色体上的目标区段检索到已定位或克隆的花色素合成相关的基因,故该基因可能是一个尚未被发现的新基因,需要进行后续更精细的基因定位与功能验证加以证实。
4 结论
水稻叶舌颜色性状至少受2个基因控制,当2个基因均为显性时叶舌表现为紫色,2个控制基因为显性互补效应。2个控制基因中位于第4染色体目标区段上的1个基因有可能是Os04g0557500,该基因控制花色苷的积淀;另1个基因初步定位于第2、3或8染色体上,可能是一个未被探知的与花色苷代谢相关的新基因,需要进行后续更精细的定位与功能研究。
