绵羊ovPAG7间接竞争酶联适配体检测方法的建立与应用
2022-07-16卢春霞刘长彬万鹏程郭延华陈霞李红敏卢守亮
卢春霞 刘长彬 万鹏程 郭延华 陈霞 李红敏 卢守亮









摘要: 為建立一种简便、经济、无创的应用于绵羊早期妊娠诊断的快速检测技术,以绵羊妊娠相关糖蛋白7(Ovine pregnancy-associated glycoproteins-7, ovPAG7)核酸适配体为分子识别探针,建立一种间接竞争酶联适配体(Indirect competitive enzyme-linked aptamer assay, ic-ELAA)检测ovPAG7的新方法,并对ovPAG7包被质量浓度、包被缓冲液、封闭条件、适配体浓度、链霉亲和素-辣根过氧化物酶(SA- HRP )稀释比例等检测条件进行优化,将建立的方法应用于人工授精后28 d的中国美利奴羊血清检测,检测结果与妊娠相关糖蛋白-酶联免疫吸附测定(PAG-ELISA)商业化试剂盒和B超检测法进行比较。结果显示,在ovPAG7包被质量浓度为2.0 μg/ml 、包被缓冲液为50 mmol/L 碳酸盐缓冲液(pH 9.6)、1.0%牛血清蛋白质封闭2 h、适配体浓度为40 nmol/L 、SA- HRP 稀释比例为1∶ 40 000 (体积比)、室温下竞争反应时间为40 min等优化条件下,ovPAG7在缓冲液体系和血清体系中质量浓度的线性范围均为0.1~ 50.0 ng/ml ( R2 > 0.994) ,半数抑制质量浓度( IC 50 )分别为1.40 ng/ml 和2.11 ng/ml ,检测限分别为0.11 ng/ml 和0.19 ng/ml 。ovPAG7在空白样品中加标回收率为96.4%~ 106.8%,相对标准偏差小于6.0%。妊娠诊断结果显示,ic-ELAA法的诊断敏感性、特异性和准确率分别为96.0%、83.3%和91.2%,与B超检测结果一致性较高(Kappa值= 0.810)。
关键词: 妊娠相关糖蛋白; 适配体; 早期妊娠诊断; 绵羊
中图分类号: S826.3+5 文献标识码: A 文章编号: 1000-4440(2022)03-0730-09
Establishment and application of indirect competitive enzyme-linked aptamer assay for ovPAG7 in sheeps
LU Chun-xia 1, 2 , LIU Chang-bin 2 , WAN Peng-cheng 2 , GUO Yan-hua 2 , CHEN Xia 3 , LI Hong-min 3 , LU Shou-liang 2
(1.School of Advanced Agriculture and Bioengineering, Yangtze Normal University, Chongqing 408100, China; 2.State Key Laboratory of Sheep Genetic Improvement and Healthy Breeding, Xinjiang Academy of Agriculture and Reclamation Science, Shihezi 832000, China; 3.Analysis and Testing Center of Xinjiang Academy of Agriculture and Reclamation Science, Shihezi 832000, China)
Abstract: The aim of the experiment was to establish a rapid and new detection technique that can be applied simply, economically and noninvasively in diagnosis of sheeps in early period of pregnancy. An indirect competitive enzyme-linked aptamer assay (ic-ELAA) was developed using ovine pregnancy-associated glycoproteins-7 (ovPAG7) nucleic acid aptamer as molecular probe for the detection of ovPAG7. Several detecting conditions including mass concentration of coated ovPAG7, coating buffer, blocking conditions, concentration of aptamer and dilution ratio of streptavidin-horseradish peroxidase (SA- HRP ) were optimized. Subsequently, the serum samples from Chinese Merino ewes 28 days after insemination were analyzed by applying the ic-ELAA method proposed. The test results were compared with ultrasound B detection method and PAG-ELISA (pregnancy associated glycoproteins-enzyme linked immunosorbent assay) kit. The results demonstrated that, the optimized conditions were 2.0 μg/ml mass concentration of coated ovPAG7, 50 mmol/L carbonate with pH 9.6 as coating buffer, blocking the wells with 1.0% bovine serum albumin for 2 h, the aptamer concentration was 40 nmol/L, the dilution ratio (in volume) of SA- HRP was 1∶ 40 000 , the competitive reaction time at room temperature was 40 min. Under the optimal conditions, the linear range of mass concentration of ovPAG7 in both buffer system and serum system was 0.1- 50.0 ng/ml ( R2 >0.994), with median inhibition concentration ( IC 50 ) of 1.40 ng/ml and 2.11 ng/ml respectively, and the limit of detection were 0.11 ng/ml and 0.19 ng/ml respectively. The recovery rate of ovPAG7 in blank samples was between 96.4% and 106.8%, and the relative standard deviations were all less than 6.0%. Results of pregnancy diagnosis showed that, the diagnostic sensitivity, specificity and accuracy of ic-ELAA method were 96.0%, 83.3% and 91.2% respectively, which showed high consistency with detection results by ultrasound B method ( Kappa =0.810).
Key words: pregnancy associated glycoprotein; aptamer; early pregnancy diagnosis; sheep
近些年,中国养羊业发展迅速,截至2017年,中國绵羊存栏量1.640 79× 108只,山羊存栏量1.382 38× 108只,羊肉总产量4.711× 106 t [1] ,养殖模式也由传统的农户分散饲养向规模化和产业化转型。众所周知,在规模化养殖中,提高繁殖效率是提高养殖经济效益的关键环节。若能在配种后对母羊准确及时地进行早期妊娠诊断,尽早区分已孕和未孕母羊,及时地对未孕母羊采取复配措施,不仅有利于减少空胎率和空胎时间、提高母羊的繁殖效率,也有助于进行分群饲养管理,降低饲养成本。
目前,B超检测法是母羊妊娠诊断最常用的方法 [2-3] 。但此法有一定缺陷:(1)一般配种后45~ 60 d才能探测出比较准确的结果,无法实现早期妊娠诊断;(2)需要专业的仪器操作人员,无法在基层推广应用;(3)效率低,孕检时需要组织3~ 4个劳动力固定羊,耗时费力。由于B超妊娠诊断法不易在基层推广应用,造成基层羊场在配种后基本不实施孕检,致使母羊空怀时间延长,繁殖率降低,增加了非繁殖期饲养管理时间及饲养成本。因此,急需开发一种与规模化、产业化养殖技术相匹配的早孕快速检测技术,以满足母羊早期孕检需要,促进人工输精、胚胎移植等繁殖技术的协同发展,提高母羊繁殖效率。
妊娠相关糖蛋白(Pregnancy-associated glycoproteins, PAGs)是偶蹄动物胎盘滋养层细胞合成和分泌的一类糖蛋白,属于天冬氨酸蛋白酶家族 [4] 。迄今,研究者们已用RT-PCR技术从绵羊胎盘组织中筛选出11个绵羊 PAG(ovPAG)cDNA转录本 [5-7] 。ovPAG在绵羊整个妊娠期的表达和分泌呈现时空特异性,例如ovPAG1、ovPAG5、ovPAG7、ovPAG10、ovPAG11在妊娠16~ 17 d开始表达,而ovPAG3、ovPAG6、ovPAG8、ovPAG9则在妊娠中后期表达 [7-8] 。PAG对维持妊娠发挥了一定作用,绵羊从妊娠后第3周直到产羔时在母体外周血中均可检测到ovPAG,其浓度在妊娠第60 d达到第1个高峰,随后持续下降,在妊娠90 d再次升高直到分娩 [9] 。所以ovPAG可作为生物标志物用于母羊早期妊娠诊断 [10-11] 。但国内关于ovPAG的研究报道较少,也无针对ovPAG的商业化检测试剂盒,虽然有使用牛PAG-酶联免疫吸附剂测定(ELISA)检测ovPAG的报道 [10,12-13] ,但检测结果存在分歧,且牛PAG-ELISA试剂盒售价过高,限制了其在国内大规模推广应用。
基于此,本研究以前期筛选的ovPAG7核酸适配体作为分子识别探针,代替抗体建立一种间接竞争酶联适配体(Indirect competitive enzyme-linked aptamer assay, ic-ELAA)检测血清中ovPAG7的分析方法,旨在实现绵羊配种后约4周即可进行早期妊娠诊断,降低检测成本,满足基层牧场养殖生产需要。
1 材料与方法
1.1 材料与试剂
ovPAG7、bPAG9、bPAG4重组蛋白质由本团队前期通过真核表达系统制备 [13-14] 。牛血清白蛋白(Bovine serum albumin, BSA)、TMB(3,3′,5,5′-四甲基联苯胺)显色试剂盒、链霉亲和素-辣根过氧化物酶(SA- HRP , 500 U/ml )、Tween-20、胎牛血清、96-well酶标板等购自生工生物工程(上海)股份有限公司,孕酮(P4)购自北京世纪奥科生物技术有限公司,NaCl、KCl、Na2HPO4、KH2PO4、CaCl2、MgCl2·6H2O 等常规分析纯试剂购自国药集团化学试剂有限公司(上海),PAG-ELISA试剂盒购自北京爱德士元亨生物科技有限公司。
ovbPAG7适配体由本团队前期筛选获得 [15] ,由生工生物工程(上海)股份有限公司合成和纯化。生物素化适配体 (bio-apt)序列为5′-T ̄T ̄G ̄A ̄A ̄G ̄T ̄G ̄A ̄C ̄A ̄T ̄C ̄A ̄T ̄C ̄A ̄T ̄T ̄C ̄A ̄G ̄C ̄G ̄T ̄A ̄G ̄G ̄G ̄T ̄T ̄T ̄G ̄G ̄C ̄A ̄C ̄T ̄G ̄G ̄G ̄C ̄C ̄T ̄G ̄G ̄C ̄A ̄T ̄A ̄G ̄C ̄AGGT-biotin-3′。
1.2 仪器与设备
Thermo Scientific TM Varioskan Flash全波长扫描式多功能读数仪(美国赛默飞世尔科技公司),Tringa Linear Vet便携式兽用B超仪(意大利百胜集团荷兰公司 ),5MX 96孔板混匀仪(美国赛洛捷克公司),SK-1快速混匀器(江苏正基仪器有限公司),424R台式冷冻离心机(德国艾本德股份公司),Milli-Q Reference超纯水系统。
1.3 方法
1.3.1 间接竞争酶联适配体检测 ovPAG7 间接竞争酶联适配体检测ovPAG7的原理如图1所示,包被于酶标板上的固相ovPAG7与样品中ovPAG7竞争结合生物素化适配体,通过生物素-链霉亲和素作用,与加入的SA- HRP 特异性结合。 HRP 催化TMB显色,样品中ovPAG7浓度与反应溶液颜色深度、吸光度成反比,通过显色反应和测定450 nm处的吸光度实现对靶标的定性或定量检测。
具体操作参考本团队前期研究结果 [16] 和相关文献中的方法 [17] 并稍作修改:将ovPAG7用合适的包被液稀释至一定浓度,每孔加入200 μl ovPAG7溶液,4 ℃包被过夜,用200 μl PBST缓冲液(10 mmol/L PBS, pH 7.4, 0.05% Tween-20)洗涤3~ 5次,拍干。加入200 μl一定浓度的BSA封闭液,室温封闭若干小时,用PBST洗涤、拍干。加入100 μl ovPAG7或待测样品以及100 μl 生物素化适配体,室温孵育,用PBST洗涤、拍干。加入200 μl SA- HRP 溶液,室温孵育10 min,用PBST洗涤、拍干。加入100 μl TMB底物显色液,反应10 min。加入100 μl 终止液终止反应,采用全波长扫描式多功能读数仪测定 450 nm 处的吸光度。
1.3.2 检测条件优化 采用方阵滴定法确定ovPAG7包被浓度(0.5~ 8.0 μg/ml )和生物素适配体浓度(5~60 nmol/L )。采用单因素试验优化包被溶液[10 mmol/L PBS, pH 7.4;50 mmol/L 碳酸盐缓冲液(CB),pH 9.6;10 mmol/L Tris-HCl, pH 8.0]、BSA封闭液含量(0.1%~ 2.0%)和封闭时间(1~ 8 h)、SA- HRP 稀释比例(1∶ 10 000~ 1∶ 100 000 , v/v )、竞争结合时间(10~ 120 min)。反应体系选用ovPAG7适配体筛选缓冲液(BB): 8 g NaCl, 0.2 g KCl, 1.15 g Na2 HPO4 , 0.2 g KH2 PO4 , 0.1 g CaCl2 , 0.1 g MgCl2 ·6H2 O , pH 7.4。每个试验重复3次。除包被温度条件为-4 ℃ 外,其余试验均在室温下操作。
1.3.3 检测性能评价 竞争抑制曲线:在优化条件下,分别用BB缓冲液和阴性血清将ovPAG7稀释成0 ng/ml 、0.01 ng/ml 、0.05 ng/ml 、0.10 ng/ml 、0.50 ng/ml 、1.00 ng/ml 、5.00 ng/ml 、10.00 ng/ml 、50.00 ng/ml 、100.00 ng/ml 、500.00 ng/ml 、1 000.00 ng/ml 的工作标准溶液,同时设置空白对照,采用方法1.3.1进行检测,每个试验重复5次。以ovPAG7各质量浓度的对数值为横坐标,各质量浓度对应的 Ai (各质量浓度ovPAG7对应的450 nm下的吸光度)/ A0 ; (ovPAG7质量浓度为0时450 nm处的吸光度)为纵坐标,绘制竞争抑制曲线,求线性方程、相关系数和线性范围,根据公式(1)计算抑制率和半数抑制质量浓度( IC 50 ,即 Ai / A 0 =50%时所对应的ovPAG7质量浓度)。
AiA0=a+b lg ρ ovPAG7 (1)
其中, Ai 为不同质量浓度ovPAG7对应的450 nm处的吸光度, A0 为ovPAG7质量浓度为0时测定的450 nm处的吸光度, b 为斜率 ,a 为截距, ρ ovPAG7 为ovPAG7的质量浓度。
检测限:参考国家标准(GB/T 33411-2016)中的方法 [18] ,取10份空白样品(无ovPAG7的BB缓冲液和阴性血清体系),按照方法1.3.1步骤进行测定,求出吸光度的平均值( x 0)和标准偏差( s ),计算 x 0-2s(竞争抑制法),以此数值在标准曲线上算出对应的ovPAG7质量浓度,即为检测限(Limit of detection, LOD)。
特异性:参照方法1.3.1分别测定ovPAG7、bPAG9、bPAG4、BSA、孕酮(P4)的抑制曲线,计算 IC 50 和交叉反应率( CR ), CR = IC 50 (ovPAG7)/ IC 50 (各抑制物)×100% [19] ,以评估该方法的特异性。
加标回收率:采用空白加标回收试验考察ic-ELAA的准确性与精密度。取阴性血清,在线性范围内分别添加低、中、高3种质量浓度水平的ovPAG7,使ovPAG7终质量浓度分别为1 ng/ml 、5 ng/ml 、20 ng/ml 。按照方法1.3.1检测,通过标准抑制曲线计算样品中ovPAG7浓度,并计算加标回收率和相对标准偏差( RSD )。每个添加水平设5个重复。
1.3.4 ic-ELAA在绵羊早孕诊断中的应用 样品采集及检测:选择人工授精(Artificial insemination, AI)后28 d的中国美利奴母羊80只,颈静脉无菌采集血液3~ 5 ml,室温下放置约1~ 2 h,血清自动析出后收集血清。以ovPAG7(5 ng/ml )溶液为阳性对照,用BB缓冲液作为空白对照,以胎羊血清作为阴性对照,采用方法1.3.1的步骤进行检测。血清样品同时采用牛PAG-ELISA商业化试剂盒进行检测。
超声波检测:在AI后 60 d以超声波检测作为金标方法确诊羊的怀孕状态。
结果判断:檢测结果采用临界值(Cut-off, CO)判定为阳性或阴性。有研究者发现 [20-21] ,未孕母羊的PAG质量浓度常小于1 ng/ml ,所以PAG的临界值常定为1 ng/ml , cut-off ≥1 ng/ml 为阳性, cut-off < 1 ng/ml 为阴性。检测结果若与超声波检测结果不一致,则以超声波检测结果为准。最后统计阳性、假阳性、阴性和假阴性结果,根据行业标准(SN/T 2435-2010《出入境动物检疫诊断试剂盒质量评价规程》)评价诊断敏感性、诊断特异性 [22] 。
1.3.5 数据处理与统计分析 试验数据用平均值±标准偏差方式表示,采用单因素方差分析(One-Way ANOVA)方法分析试验数据,显著性水准为 α = 0.05。用 Kappa值分析本方法及PAG-ELISA试剂盒与B超检测结果的一致性。Kappa值为0.4~ 0.5,表明一致性一般;Kappa值为0.5~ 0.6,表明一致性较好;Kappa值大于0.6,表明一致性很高;Kappa值为1,表示完全一致 [23] 。
2 结果与分析
2.1 间接竞争酶联适配体检测条件的优化
2.1.1 包被条件优化 采用方阵滴定法确定最佳ovPAG7包被质量浓度及适配体工作浓度,在包被缓冲液为50 mmol/L CB(pH 9.6)、用1% BSA封闭4 h、SA- HRP 稀释比例为1∶ 20 000 (体积比)、ovPAG7与适配体反应时间为60 min等试验条件下测定 OD 450 ,以 OD 450 为1.0左右时对应的ovPAG7包被质量浓度和适配体浓度为最佳工作条件 [24] 。结果如图2A所示,当ovPAG7质量浓度为2.0 μg/ml 、适配体浓度为40 nmol/L 时,吸光度接近1.0。为获得较高的抑制率和灵敏度,选择ovPAG7包被质量浓度为2.0 μg/ml ,适配体浓度为40 nmol/L 。
在固定试验条件下(ovPAG7包被质量浓度为2.0 μg/ml ,适配体浓度为40 nmol/L 、1% BSA封闭4 h、SA- HRP 稀释体积比为1∶ 20 000 、室温结合时间为60 min),考察不同包被溶液对ovPAG7的包被效果,选择吸光度较大的包被缓冲液。结果如图2B所示,CB包被缓冲液试验组吸光度显著高于Tris-HCl和PBS试验组( P < 0.05),故选择50 mmol/L CB作为包被缓冲液。
2.1.2 封闭条件优化 以最佳包被条件包被ovPAG7,采用BSA封闭后直接加入SA- HRP (1∶ 20 000 ,体积比),观察BSA封闭液含量和封闭时间对SA- HRP 非特异性吸附的影响。吸光度越小,表明SA- HRP 非特异性吸附越少,封闭效果越好。结果(图3)显示,当BSA封闭液含量低于0.5%时,封闭不完全,随着BSA液含量的增加,吸光度逐渐下降,说明SA- HRP 非特异性吸附效果降低。另外,非特异性吸附效果随着封闭时间的延长而降低,当封闭时间超过2 h后,吸光度无明显变化。综合以上分析,选择1.0% BSA封闭2 h。
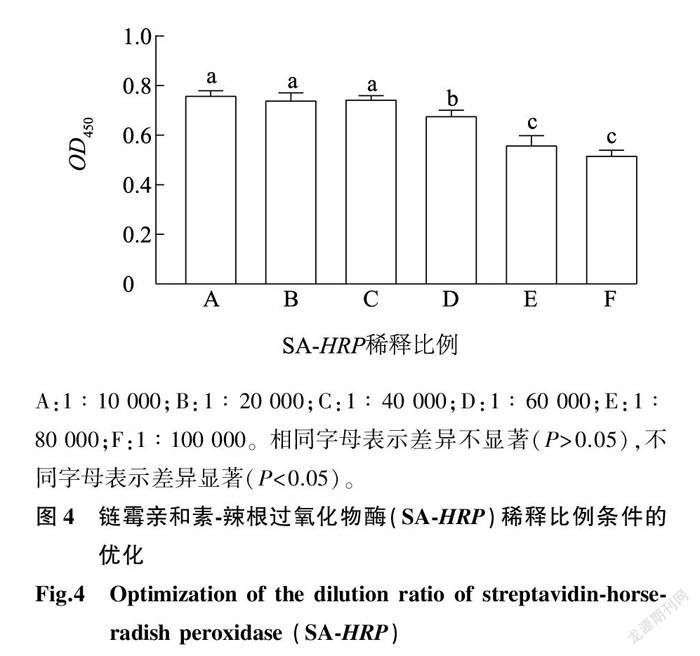
2.1.3 SA- HRP 稀释比例 固定以上优化的试验条件,将SA- HPR 用BB缓冲液以1∶ 10 000 、1∶ 20 000 、1∶ 40 000 、1∶ 60 000 、1∶ 80 000 和1∶ 100 000 体积比稀释,测定 OD 450 。结果如图4所示,SA-HRP稀释比例为1∶ 10 000~ 1∶ 40 000 时,吸光度变化不显著( P >0.05),随着稀释比例的进一步增大,吸光度显著降低( P < 0.05)。故后续试验选择SA- HRP 稀释比例为1∶ 40 000 。
2.1.4 竞争反应时间 固定以上试验条件,采用ic-ELAA测定固相-ovPAG7和样品中ovPAG7(50 ng/ml )与适配体竞争反应时间对抑制率的影响。结果(图5)显示,抑制率随着竞争结合时间的延长而增大,超过40 min后抑制率无明显变化( P > 0.05)。故选择竞争结合时间为40 min。
综上所述,ic-ELAA的最佳工作条件为:ovOAG7包被质量浓度2.0 μg/ml ,适配体浓度为40 nmol/L ,包被缓冲液为50 mmol/L CB缓冲液(pH 9.6),1.0% BSA封闭2 h,SA- HRP 稀释比例为1∶ 40 000 (体积比),竞争反应时间为40 min 。
2.2 ELAA方法学评估
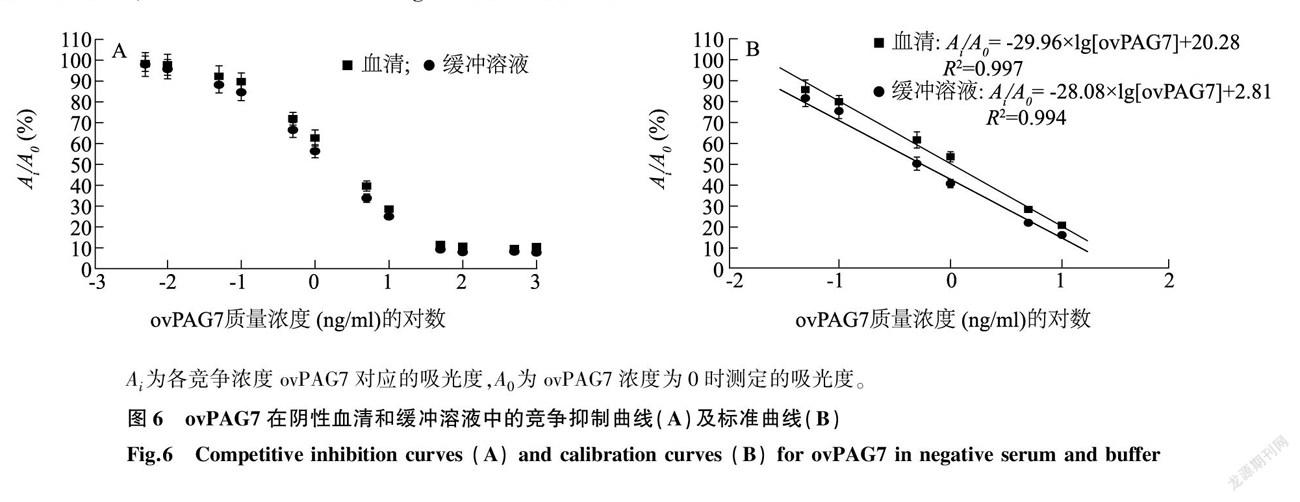
2.2.1 竞争抑制曲线 在优化条件下,将系列浓度的ovPAG7分别在BB缓冲液和阴性血清样品体系中进行竞争反应。图6为ovPAG7在2种反应体系中的竞争抑制曲线,通过回归方程计算可知,在缓冲体系和血清体系中,ovPAG7在0.1~ 50.0 ng/ml 质量浓度范围内具有良好线性( R2 > 0.994), IC 50 分别为1.40 ng/ml 和2.11 ng/ml ,检测限分别为0.11 ng/ml 和0.19 ng/ml 。结果表明,本方法检测限低、线性范围宽。血清基质中的 IC 50 和检测限稍高于缓冲液体系,原因可能是血清基质对ic-ELAA检测有一定影响。
2.2.2 ic-ELAA的特异性 为评估ic-ELAA的特异性,选择血清中的相关激素、蛋白质及结构类似物为抑制物,采用方法1.3.1中的步骤测定各抑制物的抑制曲线,计算 IC 50 和交叉反应率。结果见图7,可见适配体与BSA和P4基本无交叉反应,与牛妊娠相关糖蛋白(bPAG9和bPAG4)具有一定交叉反应,交叉反应率分别为22.0%和19.4%,这可能与牛羊PAG氨基酸序列同源性较高、蛋白质含有一些相似的抗原表位有关 [4] 。
2.2.3 ic-ELAA的加标回收率 采用建立的ic-ELAA对阴性血清进行添加回收试验,进一步评价该方法的准确性和精密度。如表1所示,ovPAG7添加回收率為96.4%~ 106.8%,相对标准偏差( RSD )为4.02%~ 5.28%,说明本方法具有高的准确性和精密度。
2.3 ic-ELAA的在绵羊早孕检测中的应用
为验证ic-ELAA的实际应用效果,采集80份母羊血清,按照方法1.3.1进行检测后按照方法1.3.4进行结果判定,并与B超检测结果比较,结果如表2和图8所示。从表2中可以看出,本方法共检测出53只妊娠绵羊(阳性),27只空怀绵羊(阴性),出现5个假阳性,2个假阴性,诊断敏感性为96.0%,诊断特异性为83.3%,诊断准确率为91.2%,与商品化试剂盒的诊断准确率结果相比差异不显著( P > 0.05)。实际应用结果表明,本方法与B超诊断结果符合率较高,Kappa值为0.810,大于0.6,表明具有较高的一致性。
3 讨 论
在ic-ELAA分析方法的建立中,优化反应条件对提高其检测性能至关重要。如果ovPAG7包被浓度过小,可能会导致高非特异性吸附;如果包被浓度过大,则导致蛋白质与基板材料的结合较弱,在洗板过程中易被洗掉,浓度过高还有可能影响检测灵敏度 [17,24] 。另外,酶标板上多余位点的封闭也较为关键,若封闭不完全,SA- HRP 和生物素化的适配体均会与聚苯乙烯板发生非特异性结合,造成较高的背景值,降低检测灵敏度 [25] 。除此以外,选择合适的包被缓冲液可提高包被原的包被效果 [16-17,24] ,一般来说,缓冲液pH大于包被蛋白质的等位点(pI),以保持其活性。在ic-ELAA分析中,SA-HRP是ic-ELAA显色反应的关键因素,如果SA- HRP 浓度过低,显色反应不充分;SA- HRP 浓度过高易引起非特异性吸附。因此,本试验对多种检测条件进行优化,在优化条件下,建立的ic-ELAA获得了低的检测限和高的准确性。
目前,ovPAG測定方法包括放射免疫分析法( Radioimmunoassay, RIA)和酶联免疫吸附测定法(Enzyme linked immunosorbent assay, ELISA) [10-11,26-29] 。在早期,人们大都采用异源RIA测定母羊血液中ovPAGs浓度 [11,20,30] 。如Karen等 [20] 采用异源RIA检测母羊配种后22 d外周血中ovPAG浓度,妊娠诊断敏感性和特异性分别达到93.5%和100.0%。但ovPAG浓度与品种、妊娠天数、胎次、样品来源等有一定关系 [9,11,30] ,因此诊断准确性受多种因素影响。Barbato等 [30] 采用异源RIA检测母羊配种后18 d、24 d、26 d、28 d、30 d和50 d的血液样品,发现怀双胎的妊娠母羊PAG水平高于怀单胎的妊娠母羊,个体差异较大。除了血液样品,RIA也用于乳样检测,但是乳样的妊娠确诊天数(28 d)多于血浆样品(20 d);另外,与血浆样品不同,乳样中PAG浓度与多胎或单胎无明确相关性 [11] 。
RIA虽然具有较高的诊断灵敏度和特异性,但由于受到辐射因素的限制,RIA没有得到大规模推广应用。鉴于PAG蛋白含有一些相似的抗原表位,可用于跨种免疫检测 [31] 。人们尝试使用牛PAG-ELISA试剂盒检测ovPAG,以对绵羊进行早期妊娠诊断 [12-13] 。如Rovanil等 [32] 使用商业化牛PAG-ELISA试剂盒(IDEXX)检测绵羊血清中PAG,与超声波检测法相比较,PAG-ELISA诊断敏感性和特异性分别为93.5%和98.9%,不同于RIA方法,该试剂盒则需在妊娠33 d后才能获得高的诊断准确率(96.1%),结果的差异可能与两种检测方法所测PAG不同亚型有关。Chaves等 [12] 同样采用PAG-ELISA商业化试剂盒(IDEXX)检测妊娠和空怀绵羊血清,获得高敏感性(100%)、高特异性(93.75%~ 97.56%)和高准确率(98.46%)。但Shahin等 [10] 却获得不一致的研究结果,他们分别采用山羊PAG-ELISA、绵羊PAG-ELISA和牛PA-ELISA检测妊娠山羊血清中PAG,结果显示,山羊和绵羊PAG-ELISA的检测结果相似,而牛PAG-ELISA的检测敏感性却显著降低。
本研究用建立的ic-ELAA方法检测配种后28 d的绵羊血清,获得的检测结果与PAG-ELISA方法基本一致。本方法的妊娠诊断结果出现假阴性现象,可能与个体差异有关。有人研究发现,在母羊妊娠早期,PAG平均质量浓度为(4.3± 1.4) ng/ml ,个别妊娠母羊的PAG质量浓度低于临界值(1 ng/ml ),导致了假阴性结果 [20] 。也可能由于部分样品发生了溶血,释放的血红蛋白具有过氧化物酶活性,导致非特异性显色,造成假阴性现象 [33] 。诊断结果中出现假阳性现象,推测与适配体特异性有关,由于血清基质较为复杂,适配体可能结合了血清中某种类似靶标的未知物,产生了抑制效应,造成假阳性结果。在本研究中,PAG-ELISA诊断特异性和准确率低于部分研究结果 [12-13] ,也可能与部分样品溶血有关,导致了假阳性现象,具体原因有待进一步研究。
4 结 论
本研究以ovPAG7适配体为识别分子,代替抗体建立了一种间接竞争ELAA分析方法,在优化条件下,该方法具有低的检测限(0.11 ng/ml )、高的准确性(加标回收率96.4%~ 106.8%)和精密度( RSD < 6.0%)。将建立的ovPAG7-ELAA检测方法应用于血清学检测,绵羊妊娠诊断准确率达到91.2%,与PAG-ELISA试剂盒和超声波检测技术比较,具有简便、经济等优点,为绵羊早期妊娠诊断提供了一种无创快速检测新技术,具有一定应用前景。
参考文献:
[1] 中国畜牧兽医年鉴编辑委员会.中国畜牧兽医年鉴[M]. 北京: 中国农业出版社, 2018.
[2] JONES A K, GATELY R E, MCFADDEN K K, et al. Transabdominalultrasound for detection of pregnancy, fetal and placental landmarks, and fetal age before day 45 of gestation in the sheep[J]. Theriogenology, 2016, 85: 939-945.
[3] 陈 童,罗永明,董 红,等. B超在母羊早期妊娠和繁殖疾病诊断中的应用[J]. 黑龙江动物繁殖, 2021, 29(1): 43-46.
[4] XIE S, LOW R C, NAGEL R J, et al. Identification of the major pregnancy-specific antigens of cattleand sheep asinactive members of the aspartic proteinase family[J]. Proc Natl Acad Sci USA, 1991, 88: 10247-10251.
[5] XIE S, GREEN J, BIXBY J B, et al. The diversity and evolutionary relationships of the pregnancy-associated glycoproteins, an aspartic proteinase subfamily consisting of many trophoblast-expressed genes[J]. Proc Nati Acad Sci USA, 1997, 94:12809-12816.
[6] EL AMIRI B, REMY B, DE SOUSA N M, et al. Isolation and characterization of eight pregnancy-associated glycoproteins present at high levels in the ovine placenta between day 60 and day 100 of gestation[J]. Reprod Nutr Dev, 2004, 44: 169-181.
[7] GARBAYO J M, SERRANO B, LOPEZ-GATIUS F. Identification of novel pregnancy associated glycoproteins (PAG) expressed by the peri-implantation conceptus of domestic ruminants[J]. Anim Reprod Sci, 2008,103: 120-134.
[8] GREEN J A, XIE S, QUAN X, et al. Pregnancy-associated bovine and ovine glycoproteins exhibit spatially and temporally distinct expression patterns during pregnancy[J]. Biolo Reprod, 2000, 62: 1624-1631.
[9] RANILLA M J, SULON J, CARRO M D, et al. Plasmatic profiles of pregnancy-associated glycoprotein and progesterone levels during gestation in Churra and Merino sheep[J]. Theriogenology, 1994, 42: 537-545.
[10] SHAHIN M, FRIEDRICH M, GAULY M, et al. Pregnancy-associated glycoprotein (PAG) pattern and pregnancy detection in Boer goats using an ELISA with different antisera[J]. Small Ruminant Res, 2013, 113: 141-144.
[11] EL AMIRI B, COGNI Y, SULON J, et al. Pregnancy-associated glycoprotein concentrations inplasma and milk samples for early pregnancy diagnosis in Lacaune dairy sheep[J]. Res Vet Sci, 2015, 99: 30-36.
[12] CHAVES C M S, COSTA R L D, DUARTE K M R, et al. Visual ELISA for detection of pregnancy-associated glycoproteins(PAGs) in ewe serum[J]. Theriogenology, 2017, 97: 78-82.
[13] 刘长彬,石国庆,卢春霞. 牛妊娠相关糖蛋白9(bPAG9)的真核表达及纯化[J]. 新疆农业科学, 2019,56(8): 1552-1559.
[14] LIU C B, LU C X, SHI G Q. Selection, identification andapplication of DNA aptamers againstbovine pregnancy-associated glycoproteins 4[J]. Anal Bioanal Chem, 2020, 412: 4235-4243.
[15] LU C X, LIU C B, ZHOU Q, et al. Selecting specific aptamers that bind to ovine pregnancy-associated glycoprotein 7 using real serum sample assisted FluMag-SELEX to develop magnetic microparticle-based colorimetric aptasensor[J]. Analytica Chimica Acta, 2022, 1191: 339291.
[16] 唐宗贵,刘长彬,罗小玲,等. 间接竞争酶联适配体检测食品中土霉素[J]. 分析测试学报, 2015, 34(5): 458-462.
[17] 王 赛,魏 潇,刘佳蕙,等. 降低酶联核酸适配体分析方法中非特异性吸附的分析研究[J]. 北京化工大学学报, 2017, 44(2): 36-41.
[18] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 酶联免疫分析试剂盒通则: GB/T 33411-2016 [S]. 北京:中國标准出版社, 2016.
[19] JEON M, PAENG I R. Quantitative detection of tetracycline residues in honey by a simple sensitive immunoassay[J]. Anal Chimica Acta, 2008, 626: 180-185.
[20] KAREN A, BECKERS J F, SULON J, et al. Early pregnancy diagnosis in sheep by progesterone and pregnancy-associated glycoprotein tests[J]. Theriogenology, 2003, 59: 1941-1948.
[21] GONZALEZ F, SULON J, GARBAYO J M, et al. Early pregnancy diagnosis in goats by determination of pregnancy-associated glycoprotein concentrations in plasma samples[J]. Theriogenology, 1999, 52:717-725.
[22] 中华人民共和国国家质量监督检验检疫总局.出入境动物检疫诊断试剂盒质量评价规程: SN/T 2435-2010 [S]. 北京:中国标准出版社, 2010.
[23] MARTIN S W, MEEK A, WILLEBERG P. Measurement of disease frequency and production[M]. 1st ed. Ames: Iowa State Univ Press, 1987.
[24] WANG S, YONG W, LIU J H, et al. Development of an indirect competitive assay-based aptasensor for highly sensitive detection of tetracycline residue in honey[J]. Biosens Bioelectron, 2014, 57: 192-198.
[25] ZHANG D W, SUN C J, ZHANG F T, et al.An electrochemical aptasensor based on enzyme linked aptamer assay[J]. Biosens Bioelectron, 2012, 31: 363-368.
[26] 吕丽兰,张 娅,邹承武,等. 基于特异性对硫磷单克隆抗体的间接竞争酶联免疫吸附分析方法建立[J].南方农业学报,2020,51(5):1193-1200.
[27] 崔 银,李 明,杜道林. 邻苯二甲酸酯类化合物免疫检测技术研究进展[J].江苏农业科学,2020,48(4):33-40.
[28] 黃 陈,于生兰,徐加兵,等. 黄芪甲苷免疫亲和色谱介质的制备及应用[J].江苏农业科学,2020,48(3):218-221.
[29] 江地科,尹清清,项明源,等. 检测猪瘟病毒胶体金和量子点试纸条的初步研制[J].江苏农业学报,2020,36(1):116-121.
[30] BARBATO O, SOUSA N M, DEBENEDETTI A, et al. Validation of a new pregnancy-associated glycoprotein radioimmunoassay method for the detection of early pregnancy in ewes[J]. Theriogenology, 2009, 72(7): 993-1000.
[31] SZAFRANSKA B, PANASIEWICZ G, MAJEWSKA M. Biodiversity of multiple pregnancy-associated glycoprotein (PAG) family: gene cloning and chorionic protein purification in domestic and wild eutherians (Placentalia)-a review[J]. Reprod Nutr Dev, 2006, 46: 481-502.
[32] ROVANIL M T, CEZAR A S, RIGO M L, et al. Evaluation of a bovine pregnancy-associated glycoprotein enzyme-linked immunosorbent assay kit for serological diagnosis of pregnancy in sheep[J]. Ciencia Rural, 2016, 46: 362-367.
[33] 王菲菲. 溶血对ELISA 与化学发光免疫检测HIV 抗体的影响[J]. 医药论坛杂志, 2019, 40 (9): 98-100.
(责任编辑:张震林)
收稿日期:2021-07-25
基金项目:新疆生产建设兵团科技创新人才计划项目(2020CB022);重庆市自然科学基金面上项目(cstc2020jcyj-msxmX0080);国家重点实验室优秀中青年人才培养引导计划专项(SKLSGIH2017A02)
作者简介:卢春霞(1978-),女,河南商丘人,博士,教授,主要从事快速检测技术研究。(E-mail)shzlcx2002@163.com
通讯作者:刘长彬,(E-mail)xlchangbin@163.com
