湖羊SREBP1基因编码区序列克隆及表达分析
2022-07-16李樊舒嘉傲李隐侠孟春花张晨俭张俊钱勇曹少先
李樊 舒嘉傲 李隐侠 孟春花 张晨俭 张俊 钱勇 曹少先





摘要: SREBP1是一个重要的核转录因子,参与调控胆固醇和脂肪酸等合成和代谢,本研究旨在基于获得湖羊SREBP1基因序列并分析其组织表达谱和卵巢中的表达定位,了解其在湖羊中可能的生物学功能。本研究利用RT-PCR技术对周岁湖羊卵巢组织中SREBP1基因编码区序列进行克隆和测序,用生物信息学软件对序列进行拼接、同源比对和功能预测分析,荧光定量PCR检测其在湖羊组织中的表达模式,免疫组织化学染色法鉴定其在卵巢组织中的定位。结果显示:SREBP1基因在湖羊卵巢组织中有2种剪接体,对应编码区长度分别为3 369 bp和3 441 bp,分别编码1 122 个和1 146 个氨基酸残基;SREBP1在哺乳动物中相对保守,含有经典的bHLH-Zip结构域,通过识别E-boxes或者固醇调节元件调控靶基因的表达;组织表达谱分析结果显示,SREBP1在湖羊组织中广泛表达,提示SREBP1基因可能参与调控湖羊多种生物学过程。免疫组织化学染色法分析结果显示,SREBP1基因在湖羊卵巢腔前卵泡和有腔卵泡中均有表達,主要定位于颗粒细胞、卵泡膜细胞和黄体细胞中,推测SREBP1可能在湖羊繁殖调控中发挥重要的作用。这些结果为进一步研究湖羊SREBP1基因的功能提供了基础。
关键词: SREBP1; 克隆; 序列特征; 湖羊
中图分类号: S858.26 文献标识码: A 文章编号: 1000-4440(2022)03-0721-09
Sequence cloning and expression analysis of SREBP1 gene in Hu sheep
LI Fan 1,2 , SHU Jia-ao 2 , LI Yin-xia 2 , MENG Chun-hua 2 , ZHANG Chen-jian 2 , ZHANG Jun 2 , QIAN Yong 2 , CAO Shao-xian 1,2
(1.College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2.Institute of Animal Science, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: SREBP1 is an important nuclear transcription factor, which is involved in regulating the synthesis and metabolism of cholesterol and fatty acids and other biological functions. The purpose of this study is to understand the possible biological functions of SREBP1 gene in Hu sheep based on its coding sequence, tissue expression profile and location in ovary. In this study, the coding region of SREBP1 gene in Hu sheep ovarian tissue was cloned and sequenced by RT-PCR. Bioinformatics software was used for splicing, homologous alignment and functional prediction analysis. The expression pattern in Hu sheep tissue was detected by real-time PCR, and its localization in ovarian tissue was identified by immunohistochemistry. The results showed that SREBP1 gene had two kinds of spliceosomes in Hu sheep ovary, and the length of corresponding coding regions was 3 369 bp and 3 441 bp, and encoding 1 122 and 1 146 amino acid residues, respectively. SREBP1 was relatively conserved in mammals and contained the classical bHLH-Zip domain. In addition it could regulate the expression of target genes by identifying E-boxes or sterol regulatory elements. The results of tissue expression profile analysis showed that SREBP1 was widely expressed in Hu sheep, suggesting that SREBP1 gene may be involved in regulating a variety of biological processes in Hu sheep. The results of immunohistochemical staining showed that SREBP1 gene was expressed in both antral follicles and preantral follicles of Hu sheep ovary, mainly located in granulosa cells, theca cells and luteal cells, suggesting that SREBP1 may play an important role in the reproductive regulation of Hu sheep. These results provide a basis for further study on the function of SREBP1 gene in Hu sheep.
Key words: SREBP1; clone; sequence characteristics; Hu sheep
固醇调节元件结合蛋白(Sterol regulatory element binding protein, SREBP)是机体内重要的核转录因子家族,参与调控胆固醇和脂肪酸的合成,对维持动物体内脂质代谢稳态至关重要 [1-3] 。SREBP属于螺旋-茎环-螺旋亮氨酸拉链(Basic-loop-helix-leucine zipper,bHLH-Zip)家族,由3个结构域组成,分别包含由1个反式激活区域、1个富含脯氨酸的区域和bHLH-Zip结构域组成的NH2 端,2个疏水跨膜片段和1个COOH末端结构域 [4] 。SREBP一般在内质网合成之后被运输到高尔基体,在高尔基体中依次经过蛋白酶 S1 P 和 S2 P 水解,从膜中释放出NH2 末端结构域然后异位到细胞核,在细胞核内作为转录因子与靶基因的启动子结合从而激活相关基因的转录 [5] 。
SREBP 主要包括SREBP1和SREBP2 2个基因,其中SREBP1在哺乳动物中有2种亚型:SREBP1A和SREBP1C [6] 。研究结果显示,SREBP1A主要参与调控胆固醇、脂肪酸和甘油三酯合成,而SREBP1C更能促进与脂肪酸相关基因的转录 [7] 。截至目前,人、小鼠、山羊和鸡中的SREBP1A和SREBP1C 2个基因亚型的序列及功能差异已有报道 [8-11] ,但在绵羊中鲜见研究。本研究以江苏省特色绵羊品种——湖羊为研究对象,扩增湖羊卵巢组织中SREBP1基因编码区序列并进行序列特征分析,鉴定其在湖羊各个组织中的表达模式和在卵巢组织中的定位,为进一步研究该基因在绵羊中的功能及调控机制提供理论依据。
1 材料与方法
1.1 试验动物
试验羊为3只健康状况良好的周岁湖羊母羊,来自江苏西来原生态农业有限公司,体质量(33.0± 1.6) kg,屠宰后立即采集心、肝、脾、肾、大肠、小肠、卵巢、子宫和肌肉等,样品分成2份,1份置液氮中带回实验室,存放于-80 ℃ 备用,1份放入4%多聚甲醛中固定备用。
1.2 RNA提取和逆转录
参照动物组织总RNA提取试剂盒(百泰克生物技术有限公司产品,北京)说明书提取湖羊各组织样品RNA,Nandrop分光光度计测定RNA质量和浓度,逆转录试剂盒(诺唯赞生物科技有限公司产品,南京)将mRNA逆转录为cDNA,反应体系:1 000 ng RNA,4 μl 4× g DNA wiper Mix,加RNase Free ddH2 O至16 μl,混合均匀,置于PCR仪上进行基因组DNA去除,程序为42 ℃ 2 min,随后加入5× HiScript II qRT SuperMix II 4 μl吹打混匀,50 ℃ 15 min,85 ℃ 5 s,将RNA逆转录为cDNA,置-20 ℃ 保存备用。
1.3 引物合成与PCR扩增
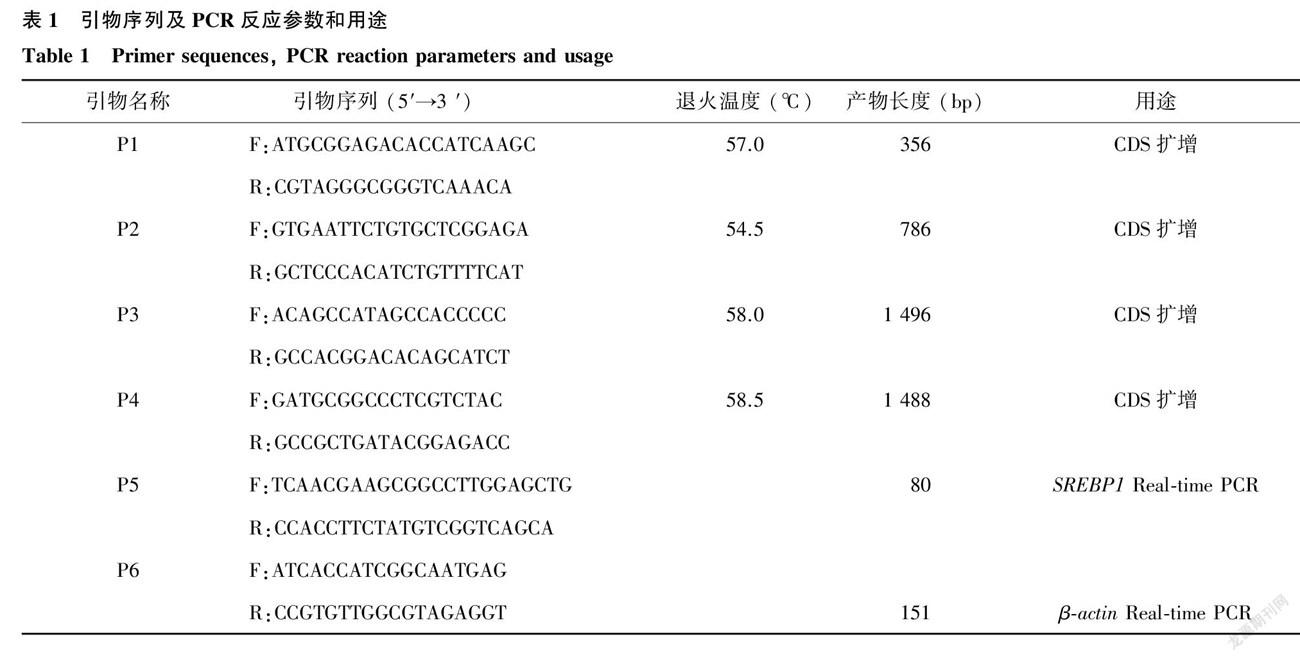
根据NCBI上绵羊SREBP1预测序列 (XM_027974784.2和XM_027974786.2),采用Primer Premier5.0软件设计4对特异性引物P1~ P4,用于分段扩增湖羊SREBP1基因编码区序列;设计SREBP1 Real-time PCR引物,以 β-actin 为内参基因进行湖羊各组织SREBP1基因表达谱的鉴定。引物由南京擎科公司合成,引物序列见表1。
RT-PCR反应体系为25.0 μl,其中含12.5 μl 2× Taq master Mix,1.0 μl cDNA,上游和下游引物各1.0 μl,9.5 μl ddH2 O。反应条件为:预变性95 ℃ 3 min;95 ℃ 15 s变性,退火15 s (具体退火温度见表1),72 ℃ 90 s,共35个循环;72 ℃ 5 min。
1.4 克隆测序
RT-PCR扩增获得的片段经过胶回收试剂盒获得纯化的目的片段,将目的片段与pMD-19T载体充分混合,16 ℃连接30 min,连接液转化DH5 α 感受态,涂布在LB板上,37 ℃过夜。挑取单克隆培养菌, PCR鉴定阳性的菌液送南京擎科公司测序。
1.5 湖羊SREBP1基因生物信息学分析
分段扩增、克隆测序得到的SREBP1序列用Lasergene和DNAMAN6.0软件比对、拼接和翻译。SREBP1基因开放阅读框的预测采用NCBI的ORF Finder (http://www.ncbi.nlm.nih.gov/projects/gorf)在線软件进行。使用ExPASy数据库在线工具(http://web.expasy.org/cgi-bin/protparam/protparam)进行SREBP1氨基酸序列特征及蛋白质理化性质分析,采用SMART网站在线工具(http://smart.embl-heidelberg.de)进行蛋白质功能域预测分析。
1.6 湖羊各组织中SREBP1基因的实时荧光定量PCR
以 β-actin 为内参基因,Real-time PCR检测湖羊心、肝、脾、肾、大肠、小肠、卵巢、子宫和肌肉组织中SREBP1基因的表达水平。每20.0 μl反应体系中含2.0 μl cDNA,10.0 μl 2×ChamQ SYBR qPCR Master Mix,上游引物和下游引物各0.4 μl,7.2 μl ddH2 O。反应条件为:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,共40个循环;最后95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。每个样本重复3次。
1.7 湖羊卵巢组织的免疫组织化学染色
采用免疫组织化学检测SREBP1在湖羊卵巢组织中的表达情况,具体操作如下:取4%多聚甲醛中固定36 h的湖羊卵巢组织,依次置于70%、80%、90%、95%、100%(体积比)颐乙醇中脱水,置于二甲苯中进行透明后,用石蜡包埋并切片(厚4 μm)。石蜡切片用二甲苯脱蜡,依次在逐步降低浓度的乙醇中水化处理,然后在柠檬酸三钠溶液中高火热修复10 min,自然冷却,随后3%的双氧水敷育30 min,阻断内源性过氧化氢酶,PBS充分漂洗3次,1次5 min,用10% BSA封闭1 h后,兔源抗SREBP1抗体(稀释浓度:1∶ 100,体积比)4 ℃孵育过夜。PBS充分漂洗3次,1次 5 min,二抗(Abcam;稀释浓度:1∶ 500)室温孵育60 min,PBS充分漂洗3次,1次 5 min,DAB(Sigma-Aldrich)显色剂显色5 min,自来水冲洗终止染色,用苏木精复染,用乙醇脱水并置于二甲苯中透明,中性树胶封片。将切片置于显微镜下观察,采集图像,用imageJ软件进行光密度值分析。
2 结果与分析
2.1 湖羊SREBP1基因克隆
根据NCBI上绵羊SREBP1预测序列,分段设计4对引物(图1A),以湖羊卵巢组织cDNA为模板,扩增湖羊SREBP1基因编码区全序列(图1B),目的条带清晰,片段大小与预测结果一致。回收扩增的目的条带测序,发现与预测序列高度同源,说明获得的序列为湖羊SREBP1编码区序列。
2.2 湖羊SREBP1基因序列特征分析
将PCR扩增获得的SREBP1分段序列进行拼接,得到SREBP1在湖羊卵巢组织中的2个剪接体,拼接好的2个序列用ORF Finder在线软件分析SREBP1基因的开放阅读框,预测对应编码区长度分别为3 441 bp和3 369 bp,命名为SREBP1L和SREBP1S。DNAMAN比对结果显示,扩增获得的湖羊SREBP1L核苷酸序列与NCBI上绵羊预测SREBP1的剪接体X1 (XM_027974784.2)、X2 (XM_042255744.1)、X3 (XM_042255745.1)和X4 (XM_027974786.2) 编码区的同源性分别为99.91%、96.89%、96.48%和96.81%,其中与X1编码区的同源性最高,仅在c.1855T> C、c.2365A> C和c.2799A> C有3个突变,没有插入和缺失;SREBP1S核苷酸序列与NCBI绵羊预测剪接体X1、X2、X3和X4编码区的同源性分别为96.89%、100.00%、99.29%和94.05%,与X2编码区序列完全一致。
以扩增获得的湖羊SREBP1L序列为对象,与其他物种序列的同源性比对后发现,与人类(XM_024450894.1)、猪 (NM_214157.1)、小鼠 (NM_011480.4)、牛 (NM_001113302.1)、山羊 (NM_001285755.1) 和鸡 (NM_204126.2)编码区的同源性分别为83.79%、87.79%、78.88%、96.48%、98.88%和67.94%,与反刍动物牛和山羊的同源性较高,与禽类的同源性较低。
2.3 湖羊SREBP1蛋白氨基酸序列和结构分析
扩增获得的湖羊SREBP1 2个剪接体序列分别编码1 146 和1 122 个氨基酸残基(SREBP1L和SREBP1S)(图2)。氨基酸序列比对结果显示,SREBP1L、SREBP1S氨基酸序列分别与小鼠SREBP1A(NP_035610 )、SREBP1C(NP_001345243)的氨基酸序列同源性为79.40%、79.76%;与人的SREBP1A(NP_001375318)、SREBP1C(NP_001308025)的氨基酸序列同源性为85.03%、85.24%;SREBP1S氨基酸序列与SREBP1L氨基酸序列相比,仅在 N 端缺失了24个氨基酸残基,这与小鼠、人SREBP1C相对于SREBP1A的 N 末端缺失24个氨基酸残基类似,且在 N 端24个氨基酸残基中,湖羊与小鼠的同源性为70.8%,与人类的同源性为83.3%(图3)。
湖羊SREBP1L和SREBP1S编码的蛋白质氨基酸序列中亮氨酸(Leu,L)的比例最高,分别为14.0%和13.8%,其次为丙氨酸(Ala,A),比例分别为12.6%和12.3%,二者均不含吡咯赖氨酸(Pyl,O)和硒半胱氨酸(Sec,U)(图4)。
2.4 湖羊SREBP1蛋白理化性质
湖羊SREBP1基因编码的2个蛋白质(SREBP1L和SREBP1S)预测相对分子质量分别为121 050.78 和118 550.99 ,理论等电点分别为8.81和9.16。预测正电荷氨基酸残基数均为104个,负电荷氨基酸残基数分别为93个和86个,体外半衰期均为30 h。SREBP1蛋白是一个疏水性蛋白,湖羊SREBP1基因编码的2个蛋白质亲/疏水性总和( GRAVY )分别为-0.099 和-0.106 。此蛋白质不存在信号肽,与其他物种的SREBP1蛋白一样,湖羊SREBP1编码的2个不同蛋白质均在 N 端有一段脯氨酸富集区域及典型的bHLH结构域(图2)。
2.6 SREBP1基因在湖羊卵巢组织中的表达
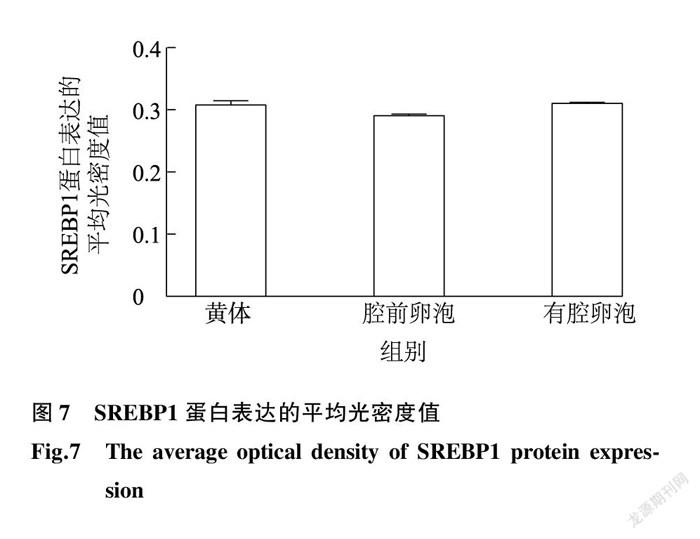
湖羊卵巢组织经免疫组织化学染色后,其不同发育阶段卵泡中均存在棕黄色阳性产物,结果显示SREBP1在湖羊卵巢腔前卵泡和有腔卵泡中均有表达,主要定位于颗粒细胞、卵泡膜细胞和黄体细胞中(图6),且SREBP1蛋白表达量无显著差异(图7)。
3 讨 论
固醇调节元件蛋白SREBP1,1995年从人hela细胞核抽提物中分离并鉴定 [8] ,随后,小鼠 [9] 、鸡 [10] 和山羊 [11] 的 SREBP 序列被成功克隆,为后续SREBP1相关功能的研究提供了重要的基础。SREBP1主要由2个亚型组成,SREBP1A和SREBP1C,序列差异主要在NH2 末端的24个氨基酸残基,其他序列完全一致 [11] ,其核酸序列差异主要在启动子区和第一外显子区。本试验通过PCR分段扩增和序列拼接获得湖羊SREBP1基因编码区全序列,分析发现扩增后获得的2个SREBP1不同剪接體SREBP1L和SREBP1S。相对于SREBP1L,SREBP1S的氨基酸序列在NH2端有24个氨基酸缺失,其余的氨基酸序列完全一致,推测本研究中得到的SREBP1L和SREBP1S可能是湖羊SREBP1的2个亚型,SREBP1A和SREBP1C。
研究結果表明,SREBP1A主要参与胆固醇合成,而SREBP1C参与脂肪酸代谢。当细胞里的胆固醇供应充足时,SCAP(SREBP裂解活化蛋白)-SREBP复合物通过固醇原件结合蛋白裂解激活蛋白SCAP与胰岛素调节蛋白INSIG结合形成SCAP-SREBPs-INSIG复合物嵌入内质网中 [3,12] 。当胆固醇水平变低或者胆固醇的需求变高时,SCAP与INSIG分离,SCAP-SREBP复合物易位到高尔基体,被高尔基体中的蛋白水解酶S1P加工,使SREBP与SCAP裂解,裂解后有活性的SREBP转运到细胞核,激活胆固醇合成通路中关键酶羟甲基戊二酰辅酶A还原酶( HMGCR )基因或者脂肪合成关键基因( LDLR ) [3] ,增加胆固醇和脂肪合成,调控机体内胆固醇和脂肪合成的稳态。进一步的研究发现,SREBP1中含有的bHLH-Zip结构域能与E-boxes(5′-CANNTG-3′) 和固醇调节元件(Sterol regulatory element, SRE) (5′-TCACNCCAC-3′)结合,调控靶基因表达,进而调控各种生物学过程 [13] 。本研究发现,湖羊SREBP1基因序列与哺乳动物SREBP1基因序列同源性较高,特别是与反刍动物同源性高达96.48%以上,说明SREBP1是比较保守的转录因子。氨基酸序列分析结果表明,与其他物种的SREBP1相似,湖羊SREBP1L和SREBP1S都含有经典的bHLH-Zip结构,与前人的研究结果一致 [13] 。
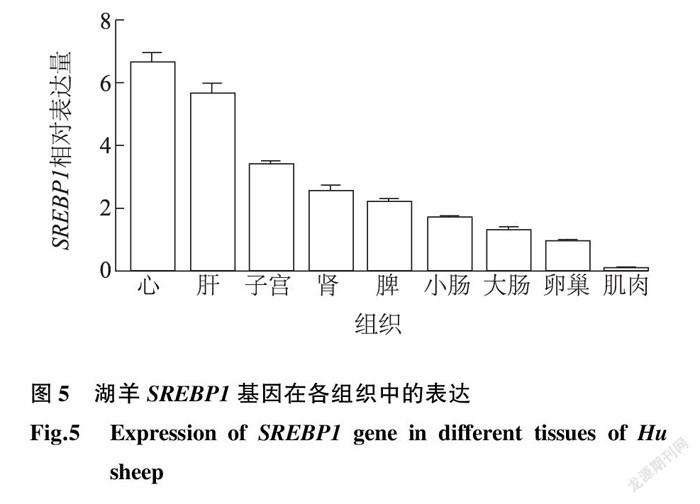
组织表达谱分析结果显示,SREBP1在牛、鸡等动物组织中广泛表达,可能参与调控各种生物学进程 [14-16] 。在HT29 细胞中过表达SREBP1导致 MMP7 表达量上调、激活NF-kappa B信号通路并促进结肠癌、直肠癌的侵袭 [17] 。在肾脏中,SREBP1激活TGF- β 信号,在肾纤维化中发挥重要的调控作用 [18] ;SREBP1与子宫内膜容受性相关联 [19] 。湖羊组织表达谱显示,SREBP1在湖羊的所有组织中均有表达,提示湖羊SREBP1参与多种组织生物学过程。但有研究结果显示,SREBP1在牛的背最长肌中高表达,而本研究结果显示其在湖羊肌肉组织中表达量最低,可能是因为背最长肌脂肪含量较高,与样品采集的部位有关 [15] 。
包梅等 [20] 的研究结果显示,SREBP1蛋白主要分布在牦牛乳腺腺泡上皮细胞、乳腺导管上皮细胞及血管内皮细胞,且SREBP1 mRNA表达量与牦牛泌乳量有关。而本研究的免疫组织化学染色结果发现,SREBP1在湖羊卵巢各级卵泡膜细胞、颗粒细胞和黄体细胞中均有表达,且研究发现SREBP1在卵巢组织中也发挥功能。多囊卵巢综合征女性和子宫内膜癌女性子宫内膜的SREBP1 基因表达水平与正常女性相比显著增加 [21] ,且SREBP1调控人的卵巢颗粒-黄体细胞中LHCGR(促黄体生成素受体)表达和孕酮水平 [22] 。提示SREBP1可能参与调控湖羊卵巢发育进而调控繁殖性能。
本研究获得湖羊SREBP1基因2个剪接体,分别编码SREBP1L和SREBP1S,含有经典的bHLH-Zip结构域。SREBP1在湖羊组织中广泛表达,在湖羊卵巢各级卵泡均有表达,主要定位于颗粒细胞和黄体细胞中。这些结果为进一步研究湖羊SREBP1的生物学功能提供了线索。
参考文献:
[1] SHIMANO H, SATO R. SREBP-regulated lipid metabolism: convergent physiology-divergent pathophysiology[J]. Nature Reviews Endocrinology, 2017, 13(12) :710-730.
[2] XUE L, QI H, ZHANG H, et al. Targeting SREBP-2-regulated mevalonate metabolism for cancer therapy[J]. Frontiers in Oncology, 2020, 10: 1510.
[3] BROWN M, RADHAKRISHNAN A, GOLDSTEIN J. Retrospective on cholesterol homeostasis: the central role of scap[J]. Annual Review of Biochemistry, 2017, 87: 1-25.
[4] GAO Y, ZHOU Y, GOLDSTEIN J, et al. Cholesterol-induced conformational changes in the sterolsensing domain of the Scap protein suggest feedback mechanism to control cholesterol synthesis[J]. The Journal of Biological Chemistry, 2017, 292(21):8729-8737.
[5] GOLDSTEIN J, DEBOSE-BOYD R, BROWN M. Protein sensors for membrane sterols[J]. Cell, 2006, 124: 35-46.
[6] LEE S, KANG S, ANG M J, et al. Deficiency of sterol regulatory element-binding protein-1c induces schizophrenia-like behavior in mice[J]. Genes, Brain and Behavior, 2018, 18(4):e12540.
[7] YU X, LIN Q, WU Z, et al. ZHX2 inhibits SREBP1c -mediated de novo lipogenesis in hepatocellular carcinoma via miR-24-3p[J]. The Journal of Pathology, 2020, 252(4):358-370.
[8] HUA X, WU J, GOLDSTEIN J, et al. Structure of the human gene encoding sterol regulatory element binding protein-1 (SREBF1) and localization of SREBF1 and SREBF2 to chromosomes 17p11.2 and 22q13[J]. Genomics, 1995, 25: 667-673.
[9] INOUE J, SATO R. A novel splicing isoform of mouse sterol regulatory element-binding protein-1 (SREBP-1)[J]. Bioscience, Biotechnology, and Biochemistry, 1999, 63: 243-245.
[10] ASSAF S, HAZARD D, PITEL F, et al. Cloning of cDNA encoding the nuclear form of chicken sterol response element binding protein-2 (SREBP-2), chromosomal localization, and tissue expression of chicken SREBP-1 and SREBP-2 genes[J]. Poult Sci, 2003, 82(1): 54-61.
[11] HF X, J L, HP W, et al. Sterol regulatory element binding protein-1 (SREBP-1) c promoter: characterization and transcriptional regulation by mature SREBP-1 and liver X receptor alpha in goat mammary epithelial cells[J]. J Dairy Sci, 2016, 99(2): 1595-1604.
[12] ADAMS C, REITZ J, BRABANDER J, et al. Cholesterol and 25-hydroxycholesterol inhibit activation of SREBPs by different mechanisms, both involving SCAP and insigs[J]. The Journal of Biological Chemistry, 2005, 279: 52772-52780.
[13] KIM J B, SPOTTS G, HALVORSEN Y D, et al. Dual DNA binding specificity of ADD1/SREBP1 controlled by a single amino acid in the basic helix-loop-helix domain[J]. Molecular and Cellular Biology, 1995, 15: 2582-2588.
[14] 張 乐,彭 燮,刘 扬,等. 牛 A-FABP 与SREBP1基因的组织表达规律研究[J].家畜生态学报,2014,35(11):18-23.
[15] 程 景,张元庆,王 曦,等.晋南牛固醇结合原件蛋白1基因在不同组织中表达规律及其与肌内脂肪含量的相关性研究[J].动物营养学报,2021,33(7):4079-4087.
[16] ASSAF S,HAZARD D,PITEL F,et al. Cloning of cDNA encoding the nuclear form of chicken sterol response element binding protein-2 (SREBP-2), chromosomal localization, and tissue expression of chicken SREBP-1 and -2 genes[J].Poult Sci,2003,82(1):54-61.
[17] GAO Y, NAN X, SHI X, et al. SREBP1 promotes the invasion of colorectal cancer accompanied upregulation of MMP7 expression and NF- κ B pathway activation[J]. BMC Cancer, 2019, 19:685.
[18] DOROTEA D, KOYA D, HA H. Recent insights into SREBP as a direct mediator of kidney fibrosis via lipid-independent pathways[J]. Frontiers in Pharmacology, 2020, 11:265.
[19] TAPIA PIZARRO A, VILOS C, MARIN J, et al. Bioinformatic detection of E47, E2F1 and SREBP1 transcription factors as potential regulators of genes associated to acquisition of endometrial receptivity[J]. Reproductive Biology and Endocrinology : RB&E, 2011, 9: 14.
[20] 包 梅,赵生贤,马 悦,等. 不同生理状态下牦牛乳腺组织中SREBP1的表达[J]. 中国兽医科学,2021,51(5):656-662.
[21] SHAFIEE M N, MONGAN N, SEEDHOUSE C, et al. Sterol regulatory element binding protein-1 (SREBP1) gene expression is similarly increased in polycystic ovary syndrome and endometrial cancer[J]. Acta Obstetricia et Gynecologica Scandinavica, 2017, 96 (5):556-562.
[22] LI Y, GUO X, GULAPPA T, et al. SREBP plays a regulatory role in LH/hCG receptor mRNA expression in human granulosa-lutein cells[J]. The Journal of Clinical Endocrinology & Metabolism,2019, 104 (10):4783-4792.
(责任编辑:陈海霞)
收稿日期:2021-11-25
基金项目:江苏省农业科技自主创新基金项目[CX(20)3013];国家自然科学基金项目(31902155)
作者简介:李 樊(1997-),女,湖北孝感人,硕士研究生,主要从事动物分子生物学研究。(E-mail)lf15205159110@163.com
通讯作者:曹少先, (E-mail)sxcao@jaas.ac.cn
