传统发酵酸凝硬质奶酪中乳酸菌的分离鉴定及其体外益生特性
2022-07-13伊力夏提艾热提徐杨林严宏孟戴志伟周建中
伊力夏提·艾热提,李 伟,徐杨林,严宏孟,戴志伟,周建中
(1.新疆农业大学食品科学与药学学院,乌鲁木齐 830052;2. 南京农业大学食品科技学院,南京 210095)
0 引 言
【研究意义】新疆伊犁地区特色乳制品种类繁多,包含着丰富的微生物资源[1-3]。通过传统发酵方式及自然选择的良好微生物制作而成[4],发酵过程包含自然发酵、晾干和成型[5]。新疆奶酪大多属于酸凝奶酪,依靠乳酸菌代谢产生的酸达到酪蛋白等电点从而成凝制成,研究传统发酵酸凝硬质奶酪中乳酸菌的分离鉴定及其体外益生特性,对筛选出优良益生菌有实际意义。【前人研究进展】新疆奶酪在含有丰富的微生物资源的同时对菌种的产酸特性有了自然地选择[6],菌种高产酸的特性使得奶酪的pH降低[7-8],配合硬质奶酪较低的水分活度使得新疆奶酪在有独特风味口感的同时抑制有害微生物的生长,便于保存运输。【本研究切入点】奶疙瘩含有牛乳中大部分的营养物质,富含磷酸盐类、钙及维生素类[9],食用奶酪不仅可以补充机体所需的微量元素还可以降低口腔pH值,使口腔酸性降低,从而避免了很多口腔疾病问题[10-11],目前鉴定乳酸菌的方法居多[12],其中最广泛引用的是16S rRNA和16S rDNA同源序列分析的方法[13]。目前,研究人员对新疆传统发酵乳制品的研究大多停留在菌株的鉴定方面,对乳酸菌的分离鉴定及其体外益生特性的研究较少。【拟解决的关键问题】从新疆伊犁地区昭苏县传统自然发酵制作的奶酪中分离乳酸菌,采用生理生化试验选取符合条件的乳酸菌,采用16S rDNA测序法检测其遗传信息,并对鉴定菌株进行体外益生特性试验,筛选出最优益生特性的乳酸菌,为体内验证及发酵益生酸奶产品提供发酵菌株。
1 材料与方法
1.1 材 料
1.1.1 奶酪
从伊犁昭苏民间不同作坊及农家采购的传统自然发酵奶酪。
主要试剂为MRS固体、肉汤培养基,杭州微生物试剂有限公司;引物、2×TSINGKE Master Mix、TSINGKE高纯度低电渗琼脂糖、DNA 凝胶回收试剂盒、DL2000 Marker,北京擎科新业生物技术有限公司。
1.1.2 主要仪器设备
UV-8000紫外分光光度计,上海元析仪器有限公司;XSZ-4GA显微镜,上海光学仪器厂;3730XL测序仪、2720 thermal cycler PCR仪,Applied Biosystems 公司;Legend Micro17 离心机,Thermo 公司;JY300C电泳仪、JYDF(定制)电泳槽、JY04S-3C型凝胶成像仪,北京君意东方电泳设备有限公司;L550板式离心机,湖南cence湘仪动力测试仪器有限公司。
1.2 方 法
1.2.1 乳酸菌筛选鉴定
1.2.1.1 乳酸菌分离与纯化
按照GB 4789.35-2016乳酸菌检验[14]方法,对样品进行梯度稀释,并涂布在MRS培养基上,于37℃恒温厌氧培养48 h。
培养48 h后分别挑取不同菌落特征菌落,再次划线接于MRS培养基上,于37℃恒温厌氧培养48 h[15],重复此操作直到固体平板上菌落形态一致。
1.2.1.2 菌株鉴定与保存
观察疑似乳酸菌菌株的菌落特征,对其进行革兰氏染色镜检及过氧化氢酶实验,选择革兰氏染色阳性、过氧化氢酶阴性的菌株进行斜面和甘油管保存(菌液和50%甘油按1∶1 的体积比接入甘油管内并置于实验室-40℃冰箱),并对其进行生理生化鉴定[16]。
1.2.1.3 各菌株生长性能
将乳酸菌株活化3代后,按3%的接种量接入MRS肉汤培养基中,每隔2 h测定菌液的OD600值,以空白培养基为对照重复3次[17]。
1.2.1.4 各菌株产酸能力
参考罗强等[18]方法,将乳酸菌株活化3代,按照3%的接种量接种于MRS肉汤培养基(pH 6.50)中,每隔2 h测定发酵液的pH值,每组进行3个平行。
1.2.1.5 各菌株产酸率
参照GB/T5413.34-2010[19]和缑敬轩[20]、龚加路[21]等的方法,将菌株以3%的接种量接入MRS肉汤培养基中,每隔2 h测滴定酸度,每组滴定重复3个平行。计算产酸率:
(1)
式中,c:NaOH的浓度(moL/L);v:滴定所消耗的NaOH溶液的体积(mL);v0:样品的体积(mL)。0.09:总酸转换系数。
1.2.1.6 各菌株分子生物学鉴定
乳酸菌16S rDNA鉴定以M.F.P.Domingos-Lopes等的方法为参考[22]进行扩增,将筛选出来的菌株用DNA提取试剂盒(TSP101试剂盒,北京擎科新业生物技术有限公司)提取DNA,用细菌16S rDNA基因的通用PCR扩增引物27 F(AGTTTGATCMTGGCTCAG)和1492 R(GGTTACCTTGTTACGACTT)进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳(150 V、100 mA、20 min)检测后,送至北京擎科生物科技有限公司昆明分公司(昆明)进行测序鉴定。将所获基因序列在NCBI gene bank上进行Blast比对,选择相似度最高菌株的序列,运用MEGA X软件构建菌株的系统发育进化树进行分析。
1.2.2 菌株体外益生特性
1.2.2.1 菌株耐胆盐能力
取培养至对数生长期的乳酸菌新鲜菌液,然后在含有0.1%、0.3%、0.5% 和1%(1%=0.01 g/mL)胆盐的MRS肉汤中培养24 h后测其OD600值,按公式2计算其耐受率[23]:

(2)
1.2.2.2 菌株耐酸能力
用1 moL/L HCl、1 moL/L NaOH调节MRS液体培养基的pH值分别为2、4、6、8将培养至对数生长期的菌液以2%的接种量,接种于不同pH值的MRS液体培养基中,置于37℃恒温培养箱24 h,测定OD600值,每组3个平行试验,按公式3计算其耐受率[24]。

(3)
1.2.2.3 菌株耐模拟人工胃液能力
人工胃液:取稀盐酸(1 moL/L)16.4 mL,加约800 mL蒸馏水与10 g胃蛋白酶,充分混匀溶解,加水定容至1 000 mL,调节pH至2.5,用0.22 μm无菌微孔滤膜过滤除菌[25]。
分别取1.0 mL菌悬液与9.0 mL人工胃液混合后,于37℃培养,分别在0、2、4 h取样,挑取菌落数合适的平板(30-300CFU),采用平板计数法测定活菌数,同时作平行实验。计算存活率[26]。

(4)
式中,N0:0 h的活菌数(空白培养基);Nt:不同时间段的活菌数。
1.2.3 表面特性测定
1.2.3.1 菌株表面疏水能力
将活化好的菌株接种于MRS肉汤培养基于37℃培养16~18 h,菌液以5 000 g/min离心15 min,并在磷酸盐缓冲液中悬浮2次。记录悬浮液在600 nm处的初级吸光度后,将3 mL菌株悬液转移到10 mL离心管中,加入1 mL的二甲苯涡旋2 min,室温下静置15 min,以便均相分离。去除上层有机相,测定下层水相的OD600值[27]。计算疏水性[28]。

(5)
式中,A0:试剂萃取前水相在600 nm波长处的吸光度;At:试剂萃取后水相在600 nm波长处的吸光度。
1.2.3.2 菌株自凝集能力
将供试菌株菌悬液的浓度调整为在600 nm波长处OD值约为1.0,分别取4 mL置于10 mL的试管中,在室温条件下静置待其分层,分别静置1、3、5 h后吸取1 mL上层悬液测OD600值,分别记作OD1、OD3、OD5,每个实验做3个平行。计算自凝集率[29]。

(6)
式中:A0:0 h时的水相在600 nm波长处吸光度;At:th时的水相在600 nm波长处吸光度。
2 结果与分析
2.1 各菌株菌落及细胞形态比较
研究表明,分离得到的36株菌株中有6株菌满足革兰氏阳性且过氧化氢阴性的条件,对这些菌落再次进行分离纯化。挑取单个菌落,并在MRS固体培养基中划线传代,最终获得在固体平板和镜检下形态一致的菌落。这6个菌株在固体培养基上的形态表现出一定的差异。图1,表1

图1 各菌株菌落及细胞形态(油镜×1 000)Fig.1 Colony and cell morphology of strains

表1 菌株菌落特征及菌体形态Table 1 Colonialand morphological characteristics of the strains
该6株菌种均为革兰氏阳性,过氧化氢酶阴性。在葡萄糖发酵实验当中均为阳性,能充分利用葡萄糖进行发酵。硫化氢实验当中该6株菌种均表现出阴性,符合初步鉴定为乳酸菌种的条件。表2

表2 菌株生理生化鉴定Table 2 Physiological and biochemical identification test results of the strains
2.2 菌株生长性能
研究表明,6株菌种的生长趋势均有所差异,其中菌株E11的生长速度最快,从0到10 h迅速繁殖,在此过程中其OD600值从0.150升到2.003,无明显延滞期,从10 h开始进入稳定期,生长速率变慢逐渐达到饱和状态。菌株B8、B34和B25的生长趋势基本相同,到达稳定期的时间短,分别在8至10 h基本进入稳定期达到饱和。菌株A75的生长趋势比较稳定,从0到28 h基本都在生长的状态,没有延滞期,从28 h开始基本进入稳定期。菌株A4从0到16 h的生长趋势几乎不变,从16 h开始生长速度加快。菌株E11、B8、B34和B25的最佳收获时间在10至20 h,A75的生长一直保持匀速生长,到20 h开始缓慢,一直到24 h基本稳定,其最佳收获期在20至24 h。菌株A4的生长趋势比较缓慢,一直到24 h开始生长加快,株菌的最佳收获期在24 h以后。图2

图2 各菌株40 h生长曲线Fig.2 Growth curve of strains within 40 h
2.3 菌株酸度
2.3.1 菌株产酸能力
研究表明,该6株菌种在MRS液体培养基当中的产酸性能有所差异。其中E11的pH下降最快,这也说明该菌株对发酵基质的利用率最高,发酵性能较强,从0到10 h其pH值从6.35下降至4.00。菌株B8、B34和B25的产酸性质曲线基本一致,从第12 h开始产酸缓慢,到了32 h开始基本停止产酸。菌株A75的产酸能力一直保持均匀的状态,产酸能力较弱。菌株A4的产酸性质最差,从开始到18 h基本保持一致,18到40 h其pH值开始下降,但趋势很缓慢,到了32 h基本停止产酸。图3

图3 各菌株40 h产酸能力变化Fig.3 Acid-producing ability of the strains within 40 h
2.3.2 菌株产酸率
研究表明,各个菌株的产酸率有着很明显的差异性。E11的产酸率最高,前18 h的产酸率最快,到了18 h之后其产酸率开始缓慢,最高产酸率到达2.21%,在这6株菌当中产酸性能最佳。菌株B25、B34和B8的产酸率几乎相同从0到26 h产酸率持续上升,最高分别达到1.39%、1.30%和1.16%,从26 h开始该3株菌的产酸率开始缓慢。菌株A75和A4的产酸率从起始至测定结束一直缓慢上升,其中A4到了32 h之后出现降低的趋势。图4

图4 各菌株40 h产酸率变化Fig.4 Acid production rate of strains within 40 h
2.4 菌株分子生物学鉴定
研究表明,菌株PCR扩增,在1 500 bp附近出现亮条,与预期结果相符,扩增成功。瑞士乳杆菌属共5株,分别为A4、A75、B8、B25和B34,属于植物乳杆菌属的为E11。图5,表3

表3 菌株相似鉴定Table 3 Analysis on the results of similar identification of strains

图5 PCR扩增后检测电泳(M为DNAmarker)Fig.5 PCR amplification electropherogram of strains(M is DNA marker)
E11单独位于1条枝,亲缘关系与植物乳杆菌相近,相似度高达100%,确定该菌株为植物乳杆菌属。A4、A75、B25、B34和B8聚集于1枝上,根据亲缘相似菌株与其相似度判断该菌种为瑞士乳杆菌属。6株菌的菌落特点、菌株形态和生理生化测定结果,鉴定其中A4、A75、B8、B25以及B34为瑞士乳杆菌,E11为植物乳杆菌。图6

图6 基于16S rDNA基因序列的系统发育树Fig.6 Phylogenetic tree of strains basedon 16S rDNA sequence
2.5 菌株体外益生特性
2.5.1 菌株耐酸及耐胆盐能力
研究表明,筛选出的6株乳酸菌在不同pH值的MRS肉汤培养基中的生长能力为菌株A4在pH 2的条件下耐受率只有3.64%,然而分离菌株E11、B34、B25、A75和B8在pH 2的条件下仍然能生长,耐受率分别达到21.79%、14.01%、13.23%、11.61%和11.14%。只有菌株E11在pH 2的高酸性条件下表现出最高的存活率,可判断其有良好的耐酸能力,能够在机体消化道里面定殖。
筛选出来的6株乳酸菌在不同pH值的MRS肉汤培养基中的生长能力。菌株A4在pH 2的条件下耐受率只有3.64%,分离菌株E11、B34、B25、A75和B8在pH 2的条件下仍然能生长,耐受率分别达到21.79%、14.01%、13.23%、11.61%和11.14%。只有菌株E11在pH 2的高酸性条件下表现出最高的存活率。图7
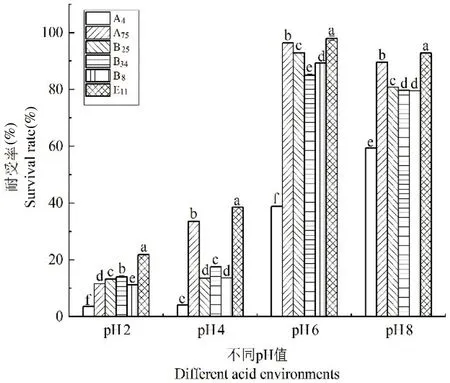
注:在图中不同的字母表示差异显著(P<0.05),同一个字母表示差异不显著(P>0.05),下同
该6株乳酸菌在不同浓度的胆盐MRS肉汤培养基的耐受率。大多数菌株能够在0.1%到0.3%的胆盐MRS肉汤里面存活,当胆盐浓度到达0.5%和1%时,大多菌株开始有了下降的趋势。其中菌株A75和E11在胆盐浓度达到0.5%和1%时仍表现出43.94%、33.14%和46.42%、38.76%的高耐受率,并在其2株菌之间差异显著。其余菌株在胆盐浓度达到0.3%开始出现存活率下降的趋势,甚至下降至10%左右,这些菌株对于高浓度胆盐有敏感性。图8

图8 菌株耐胆盐能力Fig.8 Bile salts tolerance of the strains
2.5.2 菌株在模拟人工胃液的耐受能力
研究表明,即使在pH 2.5培养2 h,各菌株均耐受模拟胃液的酸性条件,存活的菌株仍占初始细胞的90%左右。对模拟胃液最敏感的是瑞士乳杆菌A4,4 h时菌落总数从最初的10-9CFU/mL降到10-6CFU/mL。6株菌株当中对模拟胃液抵抗力最强的是植物乳杆菌E11和瑞士乳杆菌A75,到了4 h时菌落总数依然能保持很高的状态,2株菌都均能保持10-6CFU/mL的水平。表4

表4 各菌株在模拟人工胃液的耐受能力Table 4 Resistance tosimulated gastric solution of the strains
2.5.3 菌株表面疏水能力及自凝集能力
研究表明,各菌株用二甲苯处理过后表现出了不同程度的疏水能力。菌株A75和E11对二甲苯的疏水性最高(差异不显著),分别达到42.3%和44.26%,菌株B25和B8的疏水能力最低,只有16.51%和14.45%。图9

图9 各菌株表面疏水率Fig.9 Cell surfacehydrophobicity of the strains
各个菌株均表现出了不同程度的自凝集能力,随着处理时间的增长,各菌株的自凝集能力也随之增长。其中菌株E11的自凝集能力明显很高,在静止5 h之后自凝几率达到了63.6%,该菌株在上消化道运输过程中会比其余的菌株表现出更强的粘附性。菌株E11可能对上消化道的粘附性很强。图10

图10 各菌自凝集能力Fig.10 Auto-aggregatio ability of the strains
3 讨 论
近几年已经开始对新疆自然发酵乳制品进行研究,并尝试从中筛选出优良乳酸菌开发新型乳制品发酵剂,同时应用于各种食品发酵中[30]。Xin Lü等[31]从新疆传统发酵骆驼奶中分离筛选出来干酪乳杆菌,Xiaoji Zheng等[32]对新疆哈萨克族手工发酵制作奶酪微生物多样性进行研究,并检测出乳杆菌属、链球菌属以及酵母菌属等多种微生物菌群。陈欢等[33]从传统发酵奶酪中分离筛选出潜在益生乳酸菌乳酸明串球菌、格氏乳球菌、干酪乳杆菌以及瑞士乳杆菌等多种乳酸菌。
通过16S rDNA测序法筛选出来了6株乳酸菌,包括5株瑞士乳杆菌和1株植物乳杆菌。分子生物学鉴定,即16S rDNA或16S rRNA测序的原理是从菌株样本当中提取基因片段通过克隆、测序及探针杂交获得16S rRNA序列信息再与NCBI基因序列数据库中其他菌株的基因信息进行比较,确定该菌株在发育树中的位置,鉴定其微生物种类[34]。
能够耐受上消化道的条件是菌株具有潜在益生的主要特征,符合该条件的菌株可初步评估为能够生存和定值胃肠道[35]。大多数菌株能够在pH 3的条件下仍然能够表现出抵抗能力,但是很少有乳酸菌能够在pH 2的条件下生存,胃液的pH值在空腹或摄入酸性食品时可降至pH 1.5~pH 2,能够在这种极端条件下生存,可判定该菌株具有较强的耐酸性。胆盐是细菌生存的另一个严重障碍,也是刺激胃肠道菌株的主要因素[36]。益生菌的表面疏水能力和自凝集能力与其对肠黏膜的粘附能力有关,可间接判断和评价菌株在体内的粘附定置能力[35]。对各菌株进行在MRS液体培养基当中的耐受性,模拟人工胃液当中的存活率及表面特性等[37]。通过菌株的耐酸、耐胆盐、模拟消化系统当中的存活率以及其表面特性等能力能够判定该菌株为潜在益生特性的菌株,可间接判定为益生菌。能够耐受pH 2~3的酸度和浓度为0.3%~0.5%的胆盐可评估该菌株能够在体内消化系统中存活。对这些菌株进一步进行了表面特性的研究。研究的表面特性包括菌株的自凝集能力和疏水能力,在实验过程中所有菌株都表现出了不同水平的自凝集和疏水能力,其中植物乳杆菌E11在这6株菌株当中表现出最高的自凝集和疏水能力。
4 结 论
筛选36株疑似乳酸菌,其中有6株菌初步鉴定为目标乳酸菌菌株。将目标乳酸菌株进行16S rDNA分子生物学鉴定并分析基因测序。其中A4、A75、B8、B25和B34为瑞士乳杆菌(Lactobacillushelveticus),E11为植物乳杆菌(Lactobacillusplantarum)。
菌株E11、A75、B34、B8和B24表现较优异,其产酸率和产酸能力较高。分离菌株E11、B34、B25和B8的生长速率在这6株菌株当中最优,其中E11的生长速率最高。植物乳杆菌E11和瑞士乳杆菌A75在低酸和高胆盐条件下仍然能保持很高的存活率。菌株E11的表面特性最优,并在模拟人工胃肠液当中菌株E11的存活率最高,判定其为优良益生特性菌株。
