早期动脉粥样硬化中炎症细胞的分布情况
2022-07-11赵庭瑞王婷婷
王 隐,赵庭瑞,邹 瑶,于 超,王婷婷
(重庆医科大学药学院,重庆 400016)
根据《中国心血管健康与疾病报告2019概要》,我国现患心血管病的人数约有3.30亿,患病率及死亡率仍处于上升阶段;同时,无论在农村还是城市,其死亡率都居于首位,高于肿瘤和其他疾病[1]。心血管疾病的根本病因是动脉粥样硬化,动脉粥样硬化是一种全身慢性炎症性疾病,其发病机制非常复杂,与炎症、高脂血症及血流动力学改变等密切相关[2]。目前的研究表明[3],免疫系统在动脉粥样硬化的发生和发展中起关键性作用。在疾病发展的过程中,携带胆固醇的低密度脂蛋白触发炎症反应,引起T细胞活化和抗体产生等,将免疫细胞转化为促炎或抗炎的表型,并引导不同免疫细胞之间的相互作用,最终影响斑块的稳定性,并引起临床症状,如心肌梗塞和中风。
在动脉粥样硬化发生、发展过程中,局部微环境会发生一系列复杂的变化,并伴有多种免疫细胞的浸润[4]。免疫系统包括固有免疫系统和适应性免疫系统,固有免疫细胞包括中性粒细胞、单核巨/噬细胞、自然杀伤细胞、肥大细胞等,适应性免疫细胞主要包括T淋巴细胞和B淋巴细胞。Th17细胞作为CD4+T细胞的亚群之一,在类风湿关节炎等多个炎性疾病中可以分泌IL-17等细胞因子发挥重要作用[5],Tc17细胞作为CD8+T细胞的亚群之一,也有相同作用。在动脉粥样硬化发生发展过程中,众多免疫细胞涉及其中,这些细胞的生成、成熟及分裂分化等生命过程发生在不同的组织器官,不同阶段的细胞在疾病进程中有不同的功能,因此了解细胞在动脉粥样硬化小鼠全身免疫系统微环境中的分布至关重要。目前关于免疫应答在动脉粥样硬化中的作用研究主要集中于研究各种免疫细胞在动脉粥样硬化中晚期的作用[6],而在对早期动脉粥样硬化中除巨噬细胞外的其他炎性细胞浸润情况研究较少。因此,本研究运用高脂饲料喂养ApoE-/-小鼠,构建早期动脉粥样硬化模型,检测早期动脉粥样硬化小鼠的主动脉、外周血、脾脏和骨髓中各种免疫细胞的浸润情况及表型,以期阐明早期动脉粥样硬化中主要的固有免疫细胞和适应性免疫细胞的分布情况。
1 材料与方法
1.1 研究对象高脂饮食(含0.15%的胆固醇,MD12015,购自江苏美迪森生物医药有限公司)喂养4周的雄性ApoE-/-小鼠(6只,6w,C57BL/6背景,购自北京华阜康生物科技有限公司,北京市实验动物质量合格证许可证号SCXK(京)2014-0004)作为实验组,正常饮食(购自重庆腾鑫生物技术有限公司)喂养4周的同等大小的雄性C57BL/6小鼠[6只,从重庆医科大学动物中心获得,实验动物生产许可证SCXK(渝)2018-0003]作为对照组。所有小鼠都是在特定的无病原体条件(IVC环境)下饲养。所有动物实验均由重庆医科大学动物伦理与实验委员会审核批准。
1.2 实验材料实验试剂:抗小鼠CD45抗体(103114;103155)、Ly6G抗体(127605)、CD11b抗体(101225)、CD117抗体(105823)、FcεRIα抗体(134307)、NK1.1抗体(108736)、F4/80抗体(123108)、CD80抗体(104714)、CD3抗体(100222)、CD4抗体(100433)、CD8抗体(140416)购自美国Biolegend公司,抗小鼠CD163抗体(2006514)、IL-17A抗体(2142931)购自美国invitrogen公司,胶原酶Is(C1639),胶原酶XI(C5138),Ⅰ型DNA酶(10104159001)和透明质酸酶(H3506-100MG)购自美国Sigma-Aldrich公司,红细胞裂解液(RT122-02)购自天根生化科技(北京)有限公司,中性树脂(1118D021)、饱和油红O染液(G1260)及Masson三色染色试剂盒(G1340)购自北京索莱宝科技有限公司,苏木精(ZLI9610)购自北京中杉金桥生物技术有限公司,Fixation/Permeabilization Kit(554714)购自美国BD公司,cell activation cocktail (with Brefeldin A,423303)购自美国Biolegend公司,RPMI1640培养基(21870076)购自美国Gibco公司,组织固定液(含1%DEPC,AR1069)购自武汉博士德生物工程有限公司,胎牛血清(A6500-3011)购自德国Cegrogen公司,异戊巴比妥钠(Phenobarbital Sodium Salt,57-33-0)购自北京Notlas公司,PBS磷酸盐粉剂(B040100-0005)购自生工生物工程有限公司,肝素钠盐(A603251-1001)购自生工生物工程有限公司,低密度脂蛋白胆固醇(LDL-C)测定试剂盒(0302105-000464-00)、高密度脂蛋白胆固醇(HDL-C)测定试剂盒(0302105-000463-00)、总胆固醇(TC)测定试剂盒(0302105-000448-00)、甘油三酯(TG)测定试剂盒(0302105-000449-00)均购自深圳迈瑞生物医疗电子股份有限公司。
实验仪器:流式细胞仪(Cytoflex S,美国BECKMAN COULTER公司),光学显微镜(718026,日本Nikon公司),生化分析仪(BS-220,深圳迈瑞生物医疗电子股份有限公司),纯水仪(F0MB10660,美国Millipore公司),低温离心机(Microfuge 20R,美国BECKMAN COULTER公司)。
1.3 组织样本处理将ApoE-/-和C57小鼠用200 μL异戊巴比妥钠(3.75 g·L-1)腹腔麻醉后,用含肝素钠的聚丙乙烯管采集小鼠眼眶血并处死。心脏穿刺,用无菌2% PBS-肝素钠溶液完全灌注,冲洗心脏及所有血管中的血液。切除心脏并用组织固定液固定。收集脾脏、主动脉(包括胸主动脉和腹主动脉)、股骨和胫骨于无菌PBS溶液中。将主动脉剪成小块,转移至酶混合物工作液(包含各25 μL 450 kU·L-1的胶原酶Is、125 kU·L-1的胶原酶XI、60 kU·L-1的Ⅰ型DNA酶和60 kU·L-1的透明质酸酶的预冷PBS溶液)中,37 ℃下消化1 h[7];从股骨和胫骨收集骨髓。消化后的主动脉、骨髓以及脾脏分别经研磨棒和200目钢网加工制成单细胞悬液,便于后续流式细胞染色。离心外周血,2 000 r·min-1,5 min,取上层血清用于血脂水平检测,下层血细胞则用于流式细胞染色。将心脏进行石蜡包埋或冰冻制成切片,厚约7 μm。
1.4 血脂水平检测使用生化分析仪和相应的检测试剂盒测定小鼠血清血脂水平,包括总胆固醇、总甘油三酯、低密度脂蛋白-胆固醇和高密度脂蛋白-胆固醇。
1.5 流式细胞染色及分析细胞表面分子流式染色:分别用PE/Cy7标记的CD45抗体,FITC标记的Ly6G抗体,APC/Cy7标记的CD11b抗体,Percp/Cy5.5标记的CD117抗体,PE标记的FcεRIα抗体,BV650标记的NK1.1抗体,FITC标记的F4/80抗体,APC标记的CD80抗体,PE标记的CD163抗体标记主动脉、脾脏和骨髓组织单细胞悬液以及新鲜外周血细胞中的中性粒细胞CD45+(Ly6G+CD11b+)、肥大细胞CD45+(CD117+FcεRIα+)、自然杀伤细胞(CD45+NK1.1+)、巨噬细胞(CD45+F4/80+)、M1型巨噬细胞(CD45+F4/80+CD80+)及M2型巨噬细胞(CD45+F4/80+CD163+),4 ℃放置30 min后,100 μL staining buffer(含1%FBS的PBS溶液)洗涤1次,1 800 r·min-1离心5 min,50 μL胎牛血清封闭30 min;100 μL staining buffer洗涤1次,1 800 r·min-1,离心5 min;100 μL组织固定液(含1% DEPC)固定,4 ℃,20 min;100 μL staining buffer洗涤1次,1 800 r·min-1离心5 min;弃上清,150 μL PBS溶液重悬细胞,待上机;外周血染色后需先裂解其中红细胞再进行固定。细胞内因子染色:将主动脉、脾脏和骨髓组织单细胞悬液以及新鲜外周血细胞用cell activation cocktail (with Brefeldin A)刺激6 h,用BV605标记的CD45抗体,APC/Cy7标记的CD3抗体,BV650标记的γδ TCR抗体和PE/Cy7标记的CD8抗体分别标记不同组织器官中的T细胞(CD45+CD3+),CD4+T细胞(CD45+CD3+CD8-γδ T-)和CD8+T细胞(CD45+CD3+CD8+γδ T-),4 ℃放置30 min后,100 μL staining buffer洗涤1次,1 800 r·min-1离心5 min,50 μL胎牛血清封闭30 min;100 μL staining buffer洗涤1次,1 800 r·min-1,离心5 min;Fixation and Permeabiliation solutionn固定通透20 min,100 μL wash buffer (1×Perm/Wash solution)洗涤1次,1 800 r·min-1离心5 min,APC标记的IL-17A抗体标记CD4+T细胞和CD8+T细胞分泌的IL-17,4 ℃放置30 min后,100 μL wash buffer洗涤1次,1 800 r·min-1离心5 min;弃上清,150 μL PBS 溶液重悬细胞。流式细胞仪检测分析各样本中免疫细胞的比例。流式门控策略如Fig 1所示。
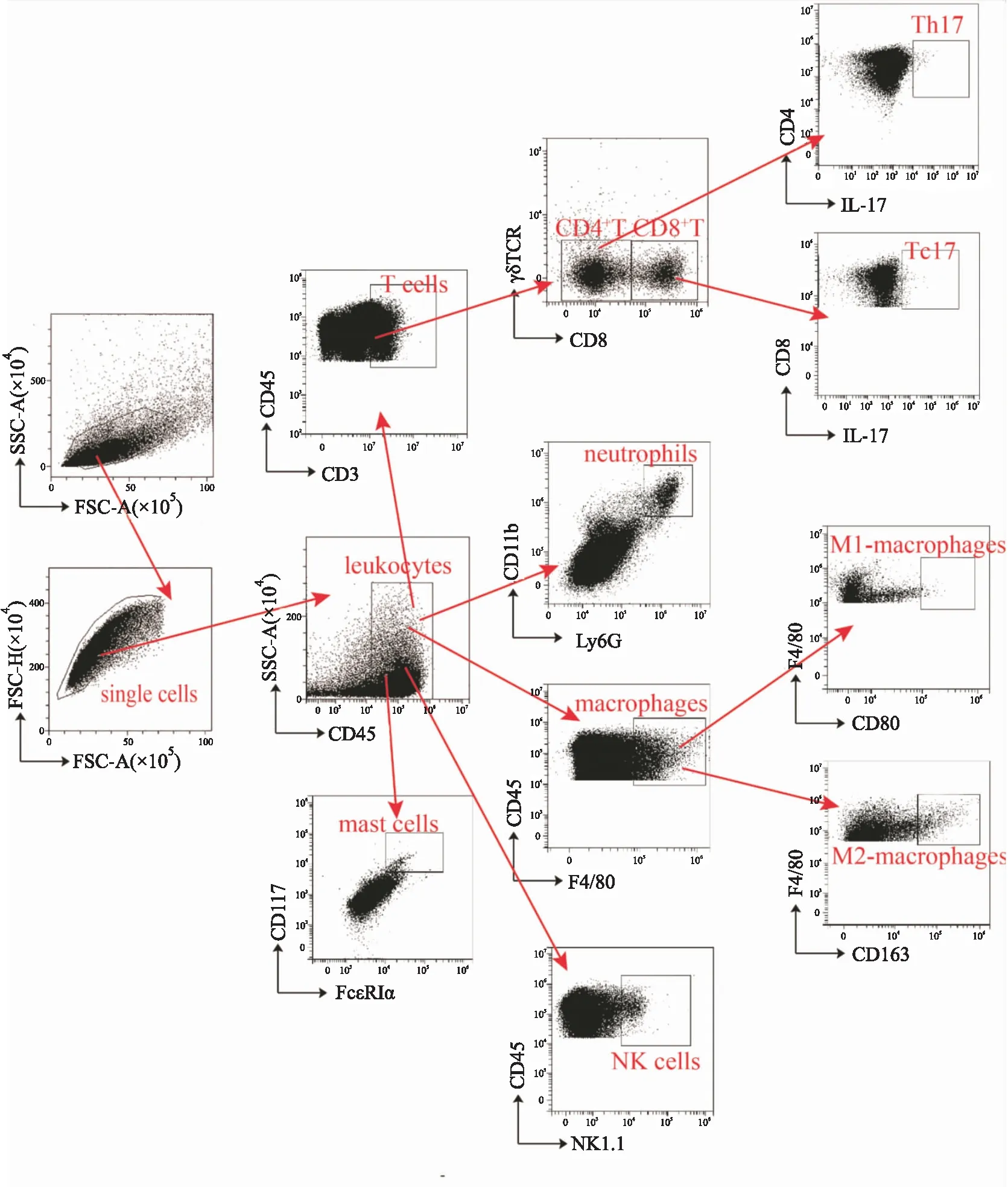
Fig 1 Gating strategy of flow cytometry
1.6 组织切片染色心脏冰冻切片油红O染色:室温复温30 min,油红O染色工作液(油红0染料 ∶超纯水=3 ∶2,体积比),37 ℃,30 min。弃去染液,超纯水洗去多余染液;60%异丙醇脱色30 s,超纯水终止分化;苏木精染液复染细胞核1 min,超纯水返蓝;中性树脂封片,光学显微镜下观察染色结果。心脏石蜡切片Masson染色:二甲苯脱蜡2次,每次10 min,酒精梯度水化各5 min,Weigert铁苏木精染色液染色5~10 min,酸性乙醇分化液分化5~15 s,水洗,Masson蓝化液返蓝3~5 min,水洗,纯水洗1 min,丽春红品红染色液染色5~10 min,弱酸工作液(纯水 ∶弱酸溶液=2 ∶1),磷钼酸溶液洗1~2 min,用配置好的弱酸工作液洗1 min,直接入苯胺蓝染色液中染色1~2 min,弱酸工作液洗1 min,95%乙醇快速脱水,无水乙醇脱水3次,二甲苯透明3次,中性树胶封固,光学显微镜下观察染色结果。

2 结果
2.1 早期动脉粥样硬化小鼠模型的构建及评价通过高脂饲料喂养ApoE-/-小鼠4周,建立早期动脉粥样硬化小鼠模型,在血管部位有粥样斑块合并病变,管腔轻度梗阻,血管平滑肌细胞无明显迁移或受累[8]。油红O染色显示,与C57小鼠相比,ApoE-/-小鼠主动脉根部斑块面积明显增加(Fig 2A,2B);而胶原纤维含量(Fig 2C,2D)没有差异。运用生化分析仪检测小鼠血脂水平发现,ApoE-/-小鼠的血脂(包括总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)明显高于C57小鼠(Fig 2E)。以上结果表明动脉粥样硬化小鼠模型构建成功。

Fig 2 Validation of a mouse model of atherosclerosisA, B:Comparison of Oil red O staining and plaque area size in mouse aortic root. C, D:Masson′s staining and collagen content quantification in mouse aortic root. E:Serum lipid levels of n=6). *P<0.05, **P<0.01 vs C57.
2.2 早期动脉粥样硬化小鼠主动脉中浸润的免疫细胞的检测及分析收集小鼠整条主动脉,制成单细胞悬液,运用流式细胞术检测其中炎性细胞浸润情况。结果显示:ApoE-/-小鼠主动脉中浸润的中性粒细胞、肥大细胞、自然杀伤细胞、巨噬细胞的比例均明显高于C57小鼠;进一步分析巨噬细胞的表型发现,具有促炎作用的M1型巨噬细胞在ApoE-/-小鼠主动脉中浸润明显增加;而具有抗炎作用的M2型巨噬细胞的比例无明显变化(Fig 3A,3B)。进一步分析T细胞及其亚型发现,ApoE-/-小鼠主动脉中浸润的CD3+T细胞(Fig 3C,3D)、IL-17+CD4+T细胞(Th17细胞)(Fig 3E,3F)及IL-17+CD8+T细胞(Tc17细胞)(Fig 3G,3H)的比例均较C57小鼠主动脉中明显升高。以上结果说明在早期动脉粥样硬化小鼠的主动脉中,不管是固有免疫细胞还是适应性免疫细胞,均有不同程度的浸润增加。提示免疫细胞在早期动脉粥样硬化斑块中发挥潜在作用。
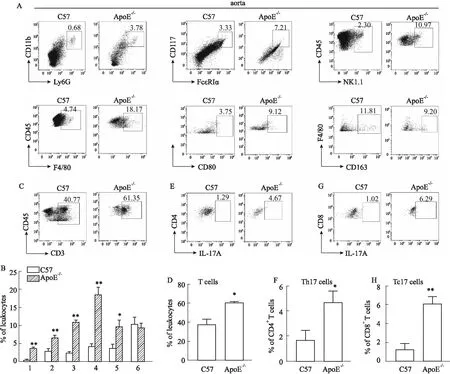
Fig 3 Infiltrating immune cells and phenotypes in aorta of mice with early atherosclerosisDetection and quantification of innate immune cells (A, B), T cells (C, D), Th17 cells (E, F) and Tc17 cells (G, H) in aorta. n=6). 1:neutrophils;2:mast cells;3:NK cells;4:macrophages;5:M1-macrophages;6:M2-macrophages.*P<0.05, **P<0.01 vs C57.
2.3 早期动脉粥样硬化小鼠外周血中免疫细胞的检测及分析血液在心脏和血管腔循环流动,可以参与运输、防御、调节人体渗透压等过程。血液中的白细胞丰富,既可以杀灭细菌、病毒等病原体,也参与形成慢性疾病的炎性状态。对ApoE-/-小鼠和C57小鼠外周血进行流式染色,结果发现:ApoE-/-小鼠外周血中性粒细胞、肥大细胞、自然杀伤细胞和单核细胞的比例与C57小鼠相比,均有升高趋势,其中肥大细胞和自然杀伤细胞比例显著升高(Fig 4A,4B);进一步分析单核细胞表型,结果显示ApoE-/-小鼠外周血中M1样单核细胞比例有升高趋势,M2样单核细胞比例有下降趋势。小鼠外周血T细胞及表型分析显示:ApoE-/-小鼠外周血中中T细胞和Th17细胞的比例显著增加,而Tc17细胞也呈现增加的趋势(Fig 4C-H)。
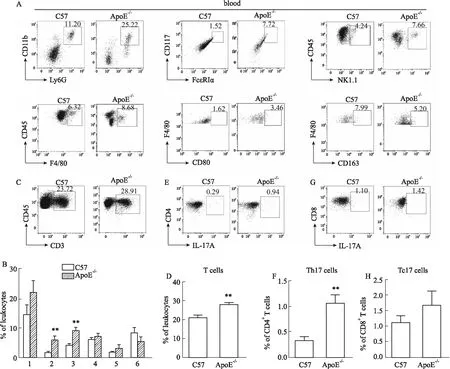
Fig 4 Immune cells and phenotypes in peripheral blood of mice with early atherosclerosisDetection and quantification of innate immune cells (A, B), T cells (C, D), Th17 cells (E, F) and Tc17 cells (G, H) in blood. n=6).1:neutrophils;2:mast cells;3:NK cells;4:monocytes;5:M1-monocytes;6:M2-monocytes. **P<0.01 vs C57.
2.4 早期动脉粥样硬化小鼠脾脏中浸润的免疫细胞的检测及分析脾脏作为次级淋巴器官,其白髓由密集的淋巴细胞组成,是机体发生特异性免疫应答的主要场所;红髓是免疫细胞发生吞噬作用的主要场所;边缘区有较多巨噬细胞,是脾内捕获、识别抗原,诱发免疫应答的重要部位,因此脾脏是动脉粥样硬化病变炎性细胞的重要应答器官。对ApoE-/-小鼠和C57小鼠脾脏单细胞悬液的流式结果分析发现:小鼠脾脏中浸润的中性粒细胞、肥大细胞和巨噬细胞比例在两组小鼠中无差异;而ApoE-/-小鼠脾脏中自然杀伤细胞和M1型巨噬细胞比例明显高于C57小鼠中(Fig 5A,5B)。T细胞的分析结果显示:ApoE-/-小鼠脾脏中浸润的T细胞(Fig 5C,5D)和Th17细胞(Fig 5E,5F)比例有上升趋势,Tc17细胞(Fig 5G,5H)比例明显增加。

Fig 5 Immune cells and phenotypes in spleen of mice with early atherosclerosisDetection and quantification of innate immune cells (A, B), T cells (C, D), Th17 cells (E, F) and Tc17 cells (G, H) in spleen. n=6).1:neutrophils;2:mast cells;3:NK cells;4:macrophages;5:M1-macrophages;6:M2-macrophages. *P<0.05, **P<0.01 vs C57.
2.5 早期动脉粥样硬化小鼠骨髓中浸润的免疫细胞的检测及分析骨髓是免疫细胞的生成器官,红骨髓除了具有活跃的造血功能外,还具有防御、免疫、创伤修复等功能。骨髓细胞成分复杂,包括各种血细胞系的不同发育阶段的细胞,如占40%~60%的粒细胞系,约20%的巨核细胞系等。在对ApoE-/-小鼠和C57小鼠骨髓单细胞悬液的流式结果分析发现:ApoE-/-小鼠和C57小鼠骨髓中生成的中性粒细胞和单核细胞比例无明显差异;虽然ApoE-/-小鼠骨髓中肥大细胞和自然杀伤细胞比例明显高于C57小鼠,但总体比例偏低(Fig 6A,6B)。两组小鼠间T细胞、Th17细胞和Tc17细胞比例均无统计学差异(Fig 6C-H)。

Fig 6 Immune cells and phenotypes in bone marrow of mice with early atherosclerosisDetection and quantification of innate immune cells (A, B), T cells (C, D), Th17 cells (E, F) and Tc17 cells (G, H) in bone marrow. n=6). 1:neutrophils;2:mast cells;3:NK cells;4:monocytes;5:M1-monocytes;6:M2-monocytes. **P<0.01 vs C57.
3 讨论
本研究通过流式细胞术检测分析发现,在早期动脉粥样硬化小鼠的主动脉和外周血中,除了单核/巨噬细胞的浸润增加,其他固有免疫细胞包括中性粒细胞、肥大细胞和自然杀伤细胞等的比例也有显著增加的趋势;进一步分析单核/巨噬细胞的表型发现,主动脉和外周血中的单核/巨噬细胞以发挥促炎作用的M1型表型为主;而在发生适应性免疫应答的脾脏中,固有免疫细胞的数量较少且在动脉粥样硬化小鼠和正常小鼠中无差异;此外,在免疫细胞的生成器官骨髓中,固有免疫细胞的比例在两组小鼠中也无差异。并且在早期动脉粥样硬化小鼠中,部分适应性细胞——T细胞、Th17细胞和Tc17细胞在主动脉、外周血和脾脏的比例明显增加,而在骨髓中的比例无显著变化。以上结果表明,在动脉粥样硬化发生的早期,动脉壁的脂质沉积主要促进了固有免疫细胞的募集和促炎作用的增强,而并未影响其在骨髓中的生成。在脂蛋白相关抗原及固有免疫细胞的共同作用下,适应性免疫系统中的T细胞活化并增殖,进一步促进了血管壁炎性微环境的形成。
动脉粥样硬化是一种由富含胆固醇的巨噬细胞在大中动脉壁异常积聚,导致的脂质代谢异常和先天性和适应性免疫对修饰性脂蛋白和受损血管壁成分的免疫反应引起的复杂慢性炎性疾病。在动脉粥样硬化发生、发展过程中,多种免疫细胞的浸润局部微环境[4]。斑块中免疫细胞的浸润往往预示着其在其他组织器官的浸润情况同样发生了变化。目前的研究表明,免疫细胞在动脉粥样硬化中的作用各异。在患有高脂血症和动脉粥样硬化的患者以及动脉粥样硬化的实验动物模型中发现循环单核细胞数量增加,并且与斑块大小和斑块分期相关[9]。单核细胞一旦渗入动脉壁,它们就会分化为巨噬细胞,巨噬细胞被认为在动脉粥样硬化的发生、发展中发挥着关键作用。在动脉粥样硬化患者破裂的斑块和小鼠动脉粥样硬化模型中,都发现了大量巨噬细胞浸润[10]。在动脉粥样硬化斑块局部多种促炎因子和抗炎因子的作用下,巨噬细胞的抗炎和促炎表型也处于不断的动态变化中[10]。在促炎细胞因子如IFN-γ、LPS等的作用下,巨噬细胞表现为促炎的M1表型,释放大量炎性介质如IL-1β、IL-6、TNF-α等,维持血管的慢性炎症状态进而促进动脉粥样硬化进展。而在IL-4、IL-13等抗炎细胞因子的作用下,巨噬细胞表现为抗炎的 M2 表型,通过释放IL-10、TGF-β等免疫抑制分子,促进局部炎症的消退和组织的修复,从而发挥保护作用。巨噬细胞除了分泌细胞因子,还表达多种趋化因子,巨噬源性的CCL3和血小板来源的CCL5等趋化因子可以参与中性粒细胞的募集[11],募集而来的中性粒细胞不仅可以参与炎症细胞组织重塑,还能促进其他白细胞进入血管外组织的炎症部位。除此之外,在炎性环境下,中性粒细胞还具有抗原呈递细胞特性。在类风湿性关节炎患者中,中性粒细胞表面的MHC Ⅱ类分子表达上升并增加其抗原呈递能力,导致T淋巴细胞激活[12]。固有免疫细胞除了中性粒细胞、单核/巨噬细胞,还包括自然杀伤细胞、肥大细胞等。肥大细胞是存在于黏膜和结缔组织中的多能白细胞,人冠状动脉病理学研究表明,肥大细胞不仅存在于动脉粥样硬化斑块中,且与非破裂的斑块相比,其数量在破裂的斑块中明显升高,影响纤维帽的稳定性[13]。早期研究发现,在动脉粥样硬化斑块中有大颗粒状的淋巴细胞(自然杀伤细胞)浸润,当小鼠体内CD47缺乏,可引起自然杀伤细胞、T细胞等细胞的激活,增加斑块形成,从而加剧动脉粥样硬化[14]。因此,动脉粥样硬化过程中涉及的固有免疫细胞及其作用的多样性表明了动脉粥样硬化研究的复杂性及必要性。
适应性免疫细胞,主要包括T细胞、B细胞,也是免疫细胞的组成部分。较多研究已证明活化的T细胞在动脉粥样硬化斑块中持续存在,CD4+T细胞和CD8+T细胞分别被MHC Ⅱ类分子和MHC Ⅰ类分子提呈的抗原激活,会分化为功能不同的辅助T细胞亚型-Th1细胞、Th2细胞、Th17细胞、调节性T细胞(Treg)、滤泡辅助T细胞(Tfh)以及杀伤T细胞亚型-Tc1细胞、Tc2细胞、Tc17细胞等。动脉粥样硬化是一种已知的Th1性疾病。斑块中的许多CD4+T细胞会表达与Th1细胞相关的促炎细胞因子γ-干扰素(IFN-γ)、IL-2、IL-3、TNF-α等,这些细胞因子可以激活巨噬细胞、T细胞和其他细胞因子,从而加剧炎症反应[15]。此外,在动脉粥样硬化斑块中,相当大比例的T细胞表达Th2相关细胞因子IL-4、IL-5和IL-13。在一项研究中,Th2细胞相关细胞因子IL-4拮抗Th1反应并减少了病灶的形成,而据报道耗竭IL-4对动脉粥样硬化具有保护作用[16]。同样,Th17细胞在动脉粥样硬化中的作用也存在争议:Th17细胞的主要细胞因子IL-17作用于血管内皮细胞、平滑肌细胞、巨噬细胞等,诱导促炎因子如IL-6、粒细胞集落刺激因子(GM-CSF)和趋化因子如CCL2、CXCL1、CXCL8、CXCL10分泌增加,募集中性粒细胞和单核细胞等到达斑块部位,影响斑块的稳定性并增大血管壁损伤范围[17];而其他研究则报道,IL-17通过抑制IFN-γ和血管内皮细胞黏附分子1(VCAM-1)等的产生,减少单核细胞和T细胞在损伤部位的聚集,并诱导血管平滑肌细胞产生Ⅰ型胶原等,从而控制损伤的发展并维持斑块的稳定性[18]。IL-17来源于多种免疫细胞,其中包括Th17细胞和Tc17细胞。这些研究中不同的发现反映了不同T细胞亚群在动脉粥样硬化中有迥异作用。
免疫应答在动脉粥样硬化发生、发展的各个阶段都发挥重要作用。但目前各种免疫细胞在中晚期动脉粥样硬化阶段的作用研究较为全面[6],本研究系统地阐明了多种免疫细胞在早期动脉粥样硬化中的分布情况,对深入了解动脉粥样硬化发生发展的免疫学机制奠定了基础;在全面而细致地研究动脉粥样硬化炎性微环境形成的机制及具体的作用机制方面具有重要意义。
