温度响应性纳米凝胶的制备及相转变机理探究
2022-07-11陈伟李雪婷鲁希华
陈伟,李雪婷,2,鲁希华,2
(1.东华大学 化学化工与生物工程学院,上海 201620;2.安徽美科迪智能微胶囊科技有限公司,安徽 铜陵 244000)
环境刺激响应性纳米凝胶可以根据外界刺激(如温度、pH等) 可逆地改变其溶解性、形状和构象[1-3]。其中,具有温度响应性的功能单体N-异丙基丙烯酰胺(NIPAM)[4-5],由于其均聚物聚N-异丙基丙烯酰胺(PNIPAM)的相变温度(Tp)接近人体生理温度,且高度可调,NIPAM被选为用于构造各种智能凝胶的基本功能单体[6-7]。
本文尝试合成与NIPAM 结构类似的丙烯酰胺单体,通过与NIPAM简单的共聚,制备温敏性共聚纳米凝胶。探究了单体配比、SDS用量和BIS含量对共聚纳米凝胶粒径、分散性的影响。利用变温红外光谱表征了纳米凝胶的相变行为,最后探究了纳米凝胶的生物相容性,证明其具有良好的生物医学应用潜力。
1 实验部分
1.1 试剂与仪器
环己胺、丙烯酰氯、二氯甲烷(DCM)、三乙胺、氢氧化钠、盐酸、N-异丙基丙烯酰胺(NIPAM)、N,N′-亚甲基双丙烯酰胺(BIS)、过硫酸铵(APS)、十二烷基硫酸钠(SDS)均为分析纯;透析袋MWCO(800~1 400 Da);超纯水;小鼠上皮成纤维细胞(L-929),中科院上海细胞库;DMEM/F12培养基,美国Hyclone公司;胎牛血清,美国Gibco 公司;CCK-8 试剂盒,上海翊圣生物科技有限公司;活细胞/死细胞双染试剂盒(Calcein AM/PI),美国 Hyclone 公司。
BI-200SM动态激光光散射仪; JEM-2100透射电镜;Nicolet Nexus 470傅里叶变换红外光谱仪;Avance 3hd 600 MHz全数字化核磁共振谱仪; Countstar细胞计数仪;Heraeus BB15型CO2细胞培养箱。
1.2 CHAA的合成[8]
将环己胺1.98 g(20 mmol)装在50 mL圆底烧瓶中,并溶于无水二氯甲烷(25 mL)中。冷却至 0 ℃(冰/水),加入无水三乙胺2.12 g(21 mmol)、丙烯酰氯溶液(1.90 g丙烯酰氯溶于5 mL无水二氯甲烷)中,在4 ℃下搅拌3 h。加热至室温,用 1 mol/L 盐酸溶液(30 mL)淬灭。萃取有机相,用 1 mol/L 氢氧化钠(30 mL)和盐水(30 mL)洗涤,用Na2SO4干燥,浓缩,得到橙色油状物质。通过硅胶柱色谱法(正己烷∶乙酸乙酯=5∶1) 洗脱,得到白色固体2.45 g,产率80%。
1.3 纳米凝胶的制备
通过乳液沉淀聚合法合成PNCH纳米凝胶(图1)[9]。
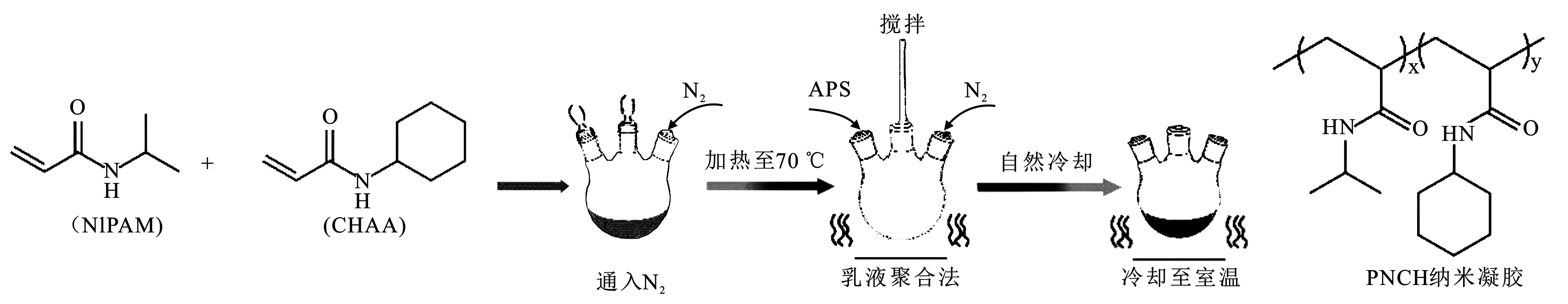
图1 P(NIPAM-co-CHAA)共聚纳米凝胶的合成示意图Fig.1 Synthesis of P(NIPAM-co-CHAA) copolymer nanogels
将共聚单体(NIPAM,CHAA)和BIS、SDS(0.05 g,2 mmol)溶于100 mL超纯水中。进料中的总单体为10 mmol/L,而共聚单体的摩尔比(NIPAM/PEAA/BIS=(100-x)∶x∶2根据所需的CHAA含量而变化。在70 ℃的氮气保护下,使用APS引发聚合4 h。冷却,用去离子水透析1周,每天更换透析水3次。根据CHAA占进料中总单体含量的比例,所得的PNCH纳米凝胶分别表示为PNCH3、PNCH5、PNCH7、PNCH10、PNCH13和PNCH16。具体配比见表1。

表1 不同单体配比P(NIPAM-co-CHAA) 纳米凝胶的制备配方Table 1 Preparation formula of P(NIPAM-co-CHAA) nanogels with different monomer ratios
1.4 单体和凝胶结构表征
1.4.1 单体的1H NMR 称取10 mg样品,置于 5 mm NMR 专用样品管中,用0.5 mL重水溶解后测试。
1.4.2 单体的红外光谱 采用KBr 压片法。样品研磨成粉末,用量1~2 mg。在4 000~400 cm-1范围内进行红外光谱扫描,扫描次数为16 次,分辨率为4 cm-1。
1.4.3 DLS表征 使用动态激光光散射仪测量纳米凝胶的粒径和粒径分布。激光波长为 532 nm,散射角度为90°,测试温度为5 ℃;变温测试时温度为5~44 ℃,以3 ℃为增量。
1.4.4 变温红外(FTIR) 表征 将冷冻干燥后的纳米凝胶固体溶于D2O (10%),在4 ℃ 环境内溶胀1周。将凝胶密封在两个CaF2窗片之间,用变温FTIR 测量。不同温度下的FTIR光谱均以 4 cm-1为分辨率记录在红外光谱仪上,进行10 次扫描,以得到可接受的信噪比。在20~40 ℃ 之间以 1 ℃ 为增量,收集随温度变化的光谱。
1.5 体外细胞实验
取100 mg 纳米凝胶干粉浸泡在10 mL完全培养基中24 h,无菌过滤后制成浸提液。48 孔板中每孔添加2×104细胞,培养24 h,形成细胞半融合层。每孔再添加800 μL 各组浸提液,培养24 h。在每孔中加入400 μL CCK-8 检测液,在37 ℃ 的培养箱中孵育1 h。使用酶标仪测定450 nm 处的吸光值,进而判断细胞的数量。
使用AM/PI 细胞染料对培养的细胞进行染色,材料的制备与上述实验一致,对处理好的材料上每孔种植1.0×105小鼠上皮成纤维细胞(L-929),置于浓度5% 的CO2培养箱中,培养24 h,温度37 ℃。取样进行活死染料染色,置于倒置荧光显微镜下,观察细胞的存活状态。
2 结果与讨论
2.1 单体CHAA的结构表征
疏水性单体CHAA 的1H NMR 谱图见图2。

图2 N-环己基丙烯酰胺(CHAA) 的1H NMR 谱图Fig.2 1H NMR Spectra of N-cyclohexylacrylamide
1H NMR (600 MHz,DMSO)δ7.93 (d,J=7.4 Hz,1H),6.20 (dd,J=17.1,10.2 Hz,1H),6.05 (dd,J=17.1,2.2 Hz,1H),5.54 (dd,J=10.1,2.2 Hz,1H),3.62~3.55 (m,1H),1.78~1.52 (m,5H),1.30~1.09 (m,5H),证明单体成功合成。
2.2 PNCH纳米凝胶的FTIR表征
利用傅里叶红外光谱表征了PNCH纳米凝胶的结构,见图3。
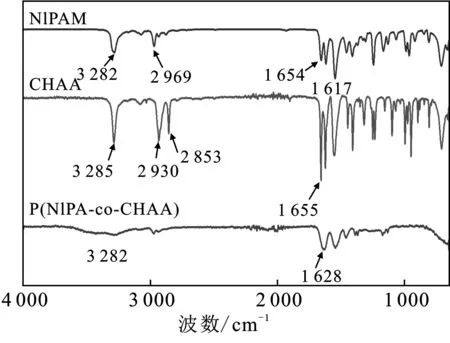
图3 单体NIPAM、CHAA和PNCH纳米凝胶的 红外光谱图Fig.3 Infrared spectra of monomer NIPAM,CHAA and PNCH nanogels
2.3 PNCH纳米凝胶的微观形貌表征
图4显示PNCH纳米凝胶的扫描电镜(SEM)和透射电镜(TEM)图像。

图4 PNCH纳米凝胶的SEM(a)和TEM(b)图
由图4可知,PNCH 纳米凝胶的微观内部结构有相互连接的多孔结构存在,这些多孔结构具有药物吸收/扩散和营养扩散输送的能力,能应用于细胞培养或药物输送。TEM 图像能看出PNCH纳米凝胶均呈“软球”状,呈现良好的单分散性。
2.4 单体配比对PNCH纳米凝胶粒径及分散性的影响
图5为单体配比对PNCH纳米凝胶粒径及分散性的影响。


图5 不同单体配比的PNCH纳米凝胶的 粒径(a)及粒径分布(b)图
由图5可知,随着单体CHAA 比例(CHAA/NIPAM=3%~16%) 的增加,PNCH纳米凝胶的粒径从210.3 nm 减小到143.2 nm,这可能是由于随着疏水性单体CHAA 含量的增加,纳米凝胶的疏水性增强,凝胶体系中疏水部分之间相互吸引的分子间相互作用,削弱了聚合物内部的相互作用[10],因此粒径减小。同时,PNCH纳米凝胶均表现出良好的单分散性(PDI 均小于0.05),不随CHAA 的增加而分散性变差。
2.5 乳化剂SDS用量对PNCH纳米凝胶粒径及分散性的影响
NIPAM与单体等比例,NIPAM∶CHAA∶BIS=95∶3∶2。添加不同用量的乳化剂SDS,分别溶于 100 mL 超纯水中,乳化剂用量对PNCH纳米凝胶粒径及粒径分布的影响见图6。


图6 不同SDS用量的PNCH纳米凝胶的 粒径(a)及粒径分布(b)图Fig.6 Particle size (a) and particle size distribution
由图6可知,随着乳化剂SDS 用量的增加,P(NIPAM-co-CHAA) 纳米凝胶的粒径从353.9 nm减小到152.8 nm。加入SDS前,凝胶体系的单分散指数较大(PDI=0.101);加入后,单分散性明显变好,降低为0.05 以下。这是由于乳化剂分子给出电荷形成带电荷保护层[11],阻止微滴彼此聚集,保持均匀的乳状液,凝胶微球带电荷保护层越多,粒径越小[12-13]。
2.6 交联剂BIS含量对PNCH纳米凝胶粒径及分散性的影响
实验条件同2.5节,SDS用量0.05 g,交联剂BIS用量对PNCH纳米凝胶粒径及粒径分布的影响见图7。

由图7可知,随着交联剂BIS 含量的增加,P(NIPAM-co-CHAA)纳米凝胶均表现出良好的单分散性(PDI 均小于0.05),粒径从210.3 nm减小到136.0 nm。交联剂BIS 在线性的PNCH链段之间产生化学键,使线性链段相互交联在一起,形成球状结构。BIS 用量增多,纳米凝胶交联程度增加,链段纠缠越多,粒径越小。
2.7 PNCH纳米凝胶的温度响应性
温度变化范围为20~40 ℃,增量为1 ℃。由 图8 可知,不同单体配比的PNCH纳米凝胶均表现出优异的温度响应性,随着温度的升高,纳米凝胶的粒径减小。PNCH纳米凝胶在Tp以下,显示亲水性,凝胶膨胀呈蓝色;而在高于Tp下,显示疏水性,凝胶将收缩,分散性变差,凝胶发生相变变白。这是由于PNCH纳米凝胶在较低温度下,聚合物链上的亲水基团与H2O 结合形成氢键,链段伸展,亲水性明显。随着温度的升高,氢键逐渐断裂,与H2O 的相互作用力减弱。同时,聚合物链中疏水作用增强,链段开始收缩成疏水性明显的球形结构,完成从无规链段向疏水小球的转变。随着疏水单体的增加,PNCH 纳米凝胶的Tp 从28.1 ℃变为25.8 ℃,这表明疏水性单体的引入增加了凝胶的疏水性,从而降低了体系的相变温度。

图8 不同单体配比的PNCH纳米凝胶粒径随温度 变化曲线;插图显示了纳米凝胶的相变前后状态






图9 PNCH3 纳米凝胶在D2O(10%) 中的变温红外光谱Fig.9 The temperature-dependent FTIR spectrum of PNCH3 nanogels in D2O (10%) variesa.3 020~2 800 cm-1(C—H)振动吸收峰区域;b.υas(CH3)频率随温度的变化;c.υas(CH2)频率随温度的变化;d.1 690~1 580 cm-1(CO)振动吸收峰区域;e.CO…D—N带(1 690~1 653 cm-1)的积分面积变化;f.CO…D—O—D带(1 624~1 580 cm-1)的积分面积变化

2.8 PNCH纳米凝胶的体外细胞毒性
CCK-8测定中含有WST-8 染料:2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐,在电子耦合试剂1-甲氧基-5-甲基吩嗪鎓硫酸二甲酯(PMS) 存在的情况下,被细胞内线粒体中的脱氢酶还原,形成水溶性较好的橙黄色甲瓒产物(Formazan)[19]。因此细胞增殖越多越快,活细胞数量越多,橙黄色甲瓒产物越多,颜色就越深;反之亦然。通过酶标仪测定 450 nm 处记录Formazan的吸光度(OD 值),就可以简单地估计细胞活力。ANOVA 单因素检验,p<0.05。
小鼠上皮成纤维细胞(L-929)和PNCH纳米凝胶培养24 h后的增殖分析图和细胞活死染色图见图10。
由图10b可知,培养24 h后活细胞占主导地位,24 h 内仅观察到微量死细胞,这表明纳米凝胶具有良好的细胞相容性。CCK-8 测定增殖结果与上述结果一致,培养24 h 后,空白样的OD 值为(0.25±0.01),PNCH3、PNCH7和PNCH13纳米凝胶的吸光度分别为(0.25±0.02)、(0.24±0.01)和(0.24±0.01),三种纳米凝胶同空白样相比,增值速率没有显著性差异。这两种实验结果可以说明PNCH纳米凝胶对小鼠上皮成纤维细胞(L-929) 没有明显的毒性,均能为其生长增殖提供一个良好的环境。这也表明PNCH纳米凝胶能用于生物医学领域,在组织工程、药物负载等需要低毒性和良好生物相容性要求的领域具有广阔的应用前景。


图10 L-929 细胞与不同单体比例的PNCH 纳米凝胶 培养24 h 后的增殖分析图(a)和细胞活死染色图(b)Fig.10 Proliferation analysis (a) and live-dead staining (b) of L-929 cells after 24 h incubation with different monomer ratios of PNCH nanogels
3 结论

