吡哆胺与辛伐他汀对糖尿病大鼠神经病理性疼痛的影响及内分泌调控意义
2022-07-08吕春凤天津市北辰医院天津300400
吕春凤 (天津市北辰医院,天津 300400)
神经病理性疼痛属于神经科常见症状之一,是指在没有外界刺激的条件下而感到的疼痛,是躯体感觉系统病变或疾病所直接导致的疼痛[1-2]。通常认为该病症与炎性反应、血管病、肿瘤、外伤、糖尿病、颈椎病、卟啉病、真性红细胞增多症、中毒、精神性因素等有关[3]。临床数据显示在我国糖尿病患者中,有高达约45%的患者会发生糖尿病神经病理性疼痛(DNP),且发病率随着糖尿病患者时间的延长而增加[4-5]。DNP主要是指以肢体远端受累为主的对称性周围神经病理学疼痛及自主神经异常,临床表现包括麻木、肌肉深部疼痛、平衡障碍、烧灼样及电击样疼痛、痛觉过敏等现象[6]。目前仍然需要进一步完善糖尿病神经病理性疼痛的诊治手段。临床治疗DNP的药物主要包括抗痉挛药物、抗抑郁药物及阿片类药物,一般是通过给药控制患者机体的血糖水平和针对性干预患者病理生理机制[7-8]。其中吡哆胺是具有维生素B6作用的自然物质之一,且临床效应要比维生素B6大数千倍。在已有研究报道中吡哆胺可用于改善糖尿病大鼠的肾脏功能和抑制糖尿病视网膜病变机制,因此推测吡哆胺对于糖尿病并发症起到很好的治疗效果[9]。辛伐他汀属于他汀类药物中的一种,除了传统应用于降低胆固醇、抗炎、钙离子通道调节之外,还被应用于坐骨神经压伤、慢性压迫性损伤等动物模型中,发现辛伐他汀能够在一定程度上缓解神经病理性疼痛的症状[10-11]。因此,本研究选取40只雄性SD(Sprague-Dawley)大鼠作为研究对象,将其中30只构建为糖尿病大鼠模型,根据不同给药方式来综合评价吡哆胺和辛伐他汀在DNP大鼠给药治疗中的应用效果及内分泌因子的表达。
1 资料与方法
1.1实验动物:本研究选取培育8~10周的40只健康雄性SD大鼠作为研究对象,体重180~220 g,饲养于25℃左右的动物房中,每天照明12 h,定期喂养食物和水。该研究按照实验方案开展实验,严格规范操作流程,不违背伦理要求。
1.2糖尿病大鼠模型的构建及治疗: 根据给药方式的不同将大鼠分为D0组(正常对照)、D1组(给予吡哆胺)、D2组(给予辛伐他汀)、D3组(无菌水),然后将D1组、D2组、D3组大鼠禁食12 h,禁水6 h,给各组大鼠腹腔注射一次性的60 mg/kg链脲佐菌素,3 d后通过剪尾法测定大鼠的血糖水平,当血糖>16.8 mmol/L即为建模成功。建模成功后,每天给大鼠予以200 mg/kg的吡哆胺或辛伐他汀进行灌胃处理,记录大鼠第0、1、2、4、6、8天的血糖水平和体重变化。
1.3大鼠疼痛反应检测:①机械疼痛检测:本研究采用北京友诚嘉业生物科技有限公司生产的电子测痛仪(Electric VonFrey)检测各组大鼠的机械刺激缩足反射阈值(PWMT),测量前先让大鼠在笼中适应30 min,然后将笼子放在金属网铁架上,测量开始后用金属头向大鼠后足底加压刺激,大鼠出现缩足反应后记录加压刺激的最大值,记录3次。②热阈痛检测:本研究采用四川佐诚科技有限公司生产的全自动热辐射刺激仪检测各组大鼠的热刺激缩足反应潜伏期(PWTL),测量前先让大鼠在笼中适应30 min,然后将笼子放在金属网铁架上,测量开始后用激光仪照射大鼠足后底,大鼠突然抬足时即可停止并记录照射时间,记录3次。
1.4RAGE和p-NF-kB蛋白表达检测:本研究采用免疫荧光染色检测大鼠脊髓背角组织星形胶质细胞的晚期糖基化终产物受体(RAGE)和p-NF-kB蛋白表达。具体步骤:①将大鼠腰段脊髓组织制备成冰冻切片,室温下放置20 min,用磷酸盐缓冲液洗涤3次;②将切片放置于1%的Triton X-100溶液培养20 min,用磷酸盐缓冲液洗涤3次;③将切片放在抗原修复液中20 min,用牛血清白蛋白培养1 h,弃掉封闭液,加入对应的一抗工作液,4℃过夜;④用磷酸盐缓冲液洗涤3次后加入对应的荧光二抗,室温环境培养1 h,完成后弃掉二抗工作液,用防荧光猝灭封片剂封片。用荧光显微镜观察拍照,采用ImageJ version 1.36b计算RAGE和p-NF-kB蛋白阳性表达率。
1.5FGF-2蛋白检测:本研究采用免疫组染检测FGF-2水平。具体步骤:①首先将大鼠背根神经节固定、包埋、连续切片,60℃烘干备用;②利用微波修复,磷酸盐缓冲液洗涤3次;③3%的去离子水培育15 min,磷酸盐缓冲液洗涤3次,加入稀释好的一抗FGF-2,4℃下过夜;④加入聚合物辅助剂培育20 min,磷酸盐缓冲液洗涤3次,再加入生物素标记的抗兔聚合物37℃培养30 min;⑤加入二氨基联苯胺(3,3'-diaminobenzidine)显色30 min,自来水冲洗,中性树胶封片。用武汉亿凡光电有限公司生产的Olympus显微镜下选取10个高清视野区域,观察并记录阳性细胞,采用福州迈新生物技术开发有限公司生产的HPIAS-1000高清晰度彩色病理图文分析系统自动计算阳性单位(PU值)。
1.6统计学分析:本研究数据处理采用SPSS 19.0版本统计软件对数据进行处理,D0、D1、D2、D3组大鼠的血糖、体重、PWMT、PWTL、RAGE、p-NF-kB蛋白表达、FGF-2S水平比较采用方差分析。以P<0.05表示差异有统计学意义。
2 结果
2.14组大鼠血糖及体重变化:图1为1周内4组大鼠血糖及体重变化,可以看出D1、D2、D3组大鼠在1周内的血糖及体重变化并不明显,始终处于平稳状态,且3组间比较差异无统计学意义(P>0.05);D0组大鼠在1周内的血糖始终
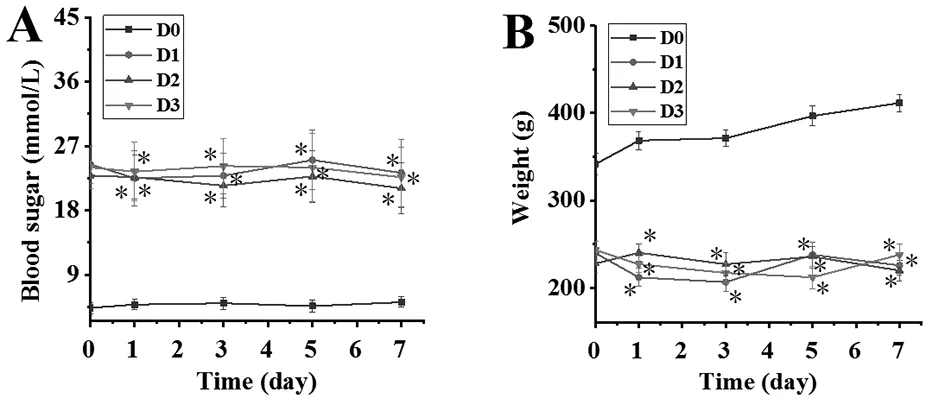
注:A为4组大鼠血糖;B为4组大鼠体重;①表示相较于D0组,P<0.05图1 4组大鼠血糖及体重变化
2.24组大鼠疼痛阈值比较:D0组大鼠的PWMT、PWTL 1周内未发生明显变化;D3组大鼠的PWMT、PWTL 1周内随时间推移而明显下降,且显著低于D0、D1、D2组,差异有统计学意义(P<0.05);D1、D2组大鼠的PWMT、PWTL 1周内随时间推移而稍有下降,但两者比较差异无统计学意义(P>0.05)。见图2。
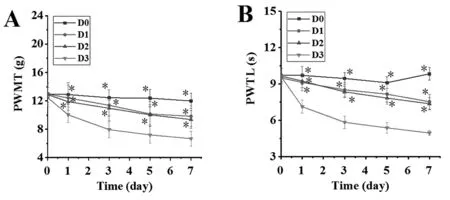
注:A为4组大鼠PWMT;B为4组大鼠PWTL;①表示相较于D3组,P<0.05图2 4组大鼠疼痛阈值比较
2.34组大鼠RAGE蛋白表达:如图3所示,D3组大鼠的 RAGE蛋白阳性表达率明显高于D1、D2组,且差异有统计学意义(P<0.05);D0组大鼠的 RAGE蛋白阳性表达率明显低于D1、D2组,且差异有统计学意义(P<0.05);D1组和D2组大鼠的 RAGE蛋白阳性表达率比较差异无统计学意义(P>0.05)。图4为4组大鼠星形胶质细胞RAGE荧光染色结果,图4A可见星形胶质细胞亮度较低,RAGE蛋白阳性表达的细胞数量明显较少。图4D可见RAGE蛋白阳性表达的细胞数量明显较多,亮度较大,高于图4B、C。
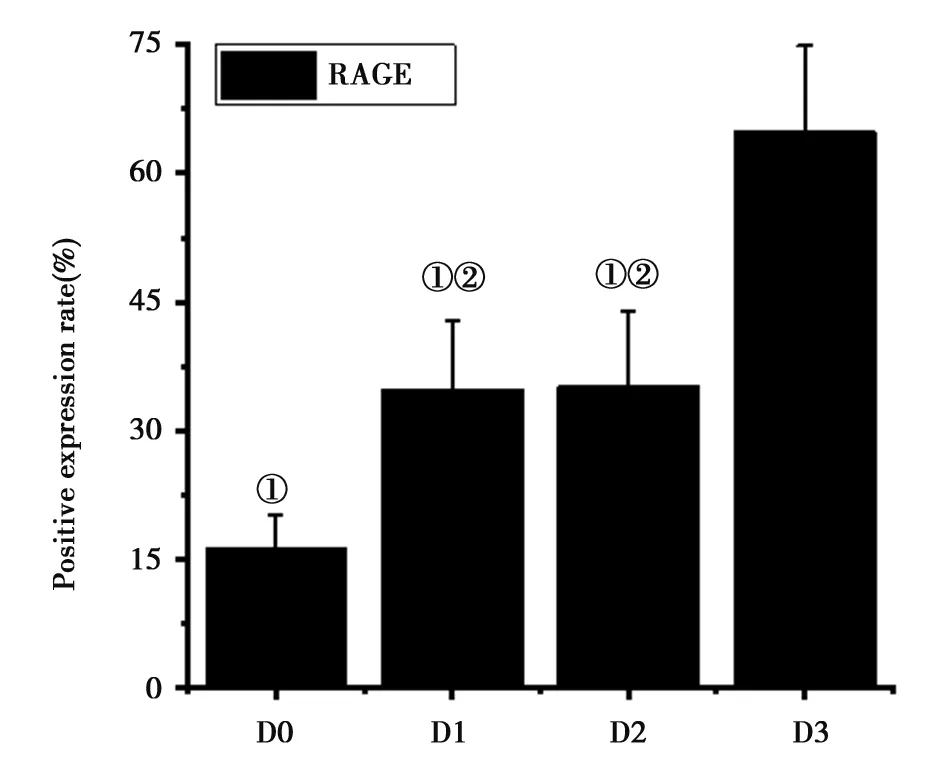
注:①表示相较于D3组,P<0.05;②表示相较于D0组,P<0.05图3 4组大鼠RAGE蛋白阳性表达率
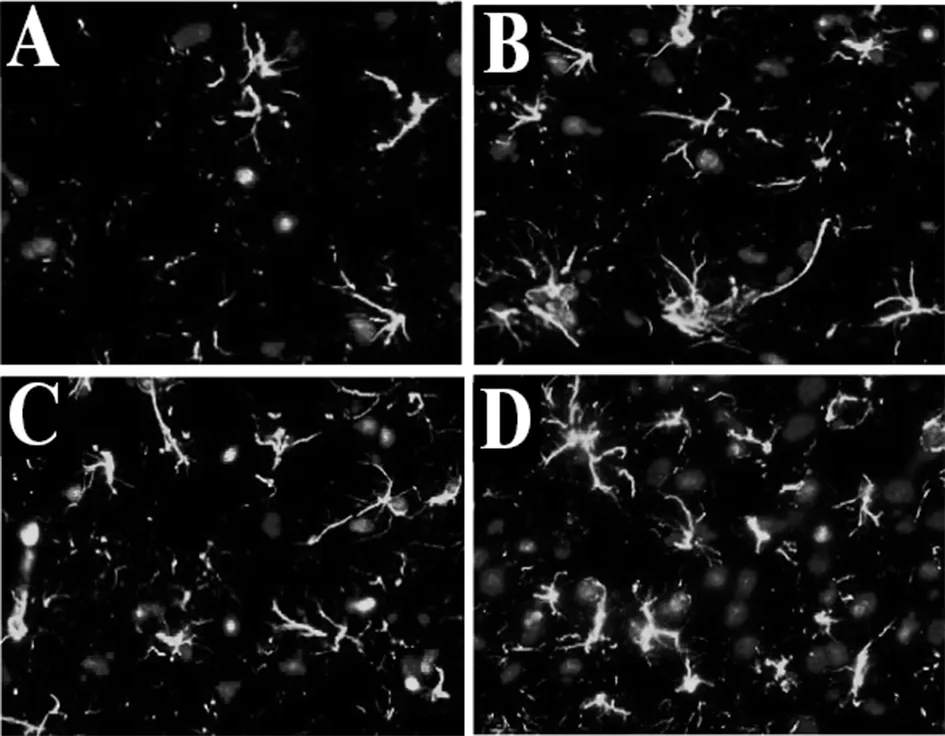
注:A为D0组荧光染色;B为D1组荧光染色;C为D2组荧光染色;D为D3组荧光染色图4 4组大鼠星形胶质细胞RAGE荧光染色结果(×200)
2.44组大鼠p-NF-κB蛋白阳性表达:如图5所示,D3组大鼠的p-NF-κB蛋白阳性表达率明显高于D1、D2组,差异有统计学意义(P<0.05);D0组大鼠的p-NF-κB蛋白阳性表达率明显低于D1、D2组,差异有统计学意义(P<0.05);D1组和D2组大鼠的p-NF-κB蛋白阳性表达率比较差异无统计学意义(P>0.05)。图6为4组大鼠星形胶质细胞p-NF-κB荧光染色结果,图6A可见星形胶质细胞亮度较低,p-NF-κB蛋白阳性表达的细胞数量明显较少。图6D可见p-NF-κB蛋白阳性表达的细胞数量明显较多,亮度较大。图6B、C的p-NF-κB蛋白阳性表达的细胞数量相差不大。
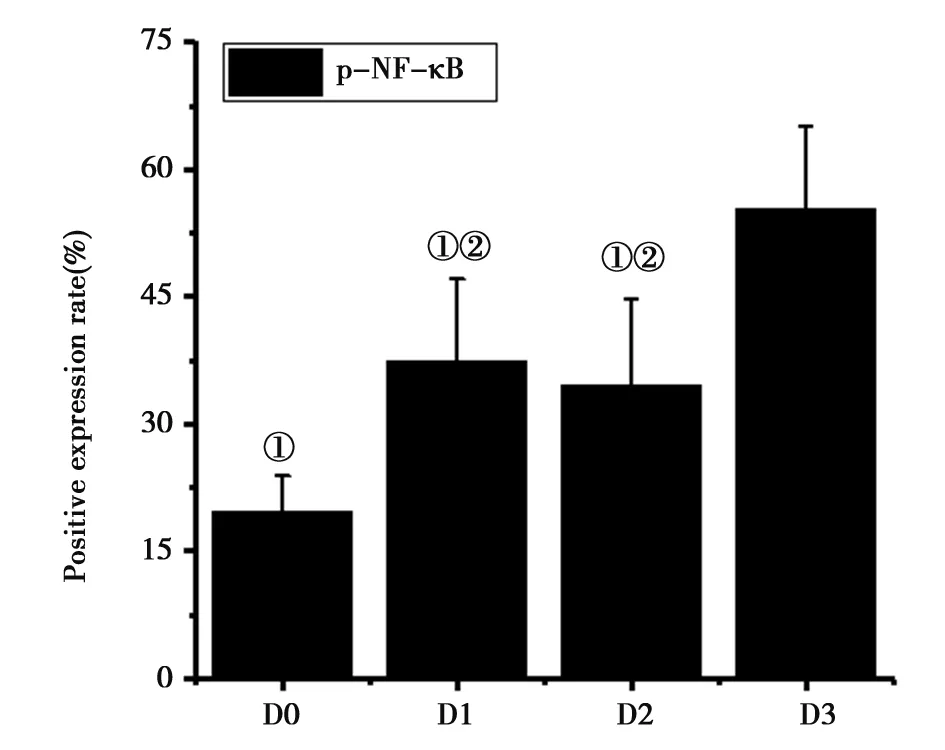
注:①表示相较于D3组,P<0.05;②表示相较于D0组,P<0.05
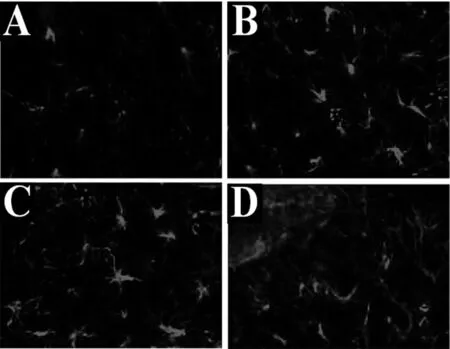
注:A为D0组荧光染色;B为D1组荧光染色;C为D2组荧光染色;D为D3组荧光染色图6 4组大鼠星形胶质细胞p-NF-κB荧光染色结果(×200)
2.54组大鼠FGF-2蛋白阳性表达:D3组大鼠的FGF-2蛋白PU值明显高于D1、D2、D3组,差异有统计学意义(P<0.05);D0组大鼠的FGF-2蛋白PU值表达率明显低于D1、D2组,差异有统计学意义(P<0.05);D1组和D2组大鼠FGF-2蛋白PU值比较差异无统计学意义(P>0.05),见图7。图8A、8B、8C、8D为4组大鼠FGF-2蛋白免疫组染结果。图8D可见大鼠背神经节细胞中存在大量的FGF-2蛋白阳性细胞,阳性主要分布在胞核中,着色均为大片的黄色、棕黄色。图8B、C可见部分FGF-2蛋白阳性细胞,着色为蓝色或棕黄色,阳性主要分布于胞核中。图8A可见FGF-2蛋白阳性细胞较少,出现不少蓝色细胞区域。见图7。
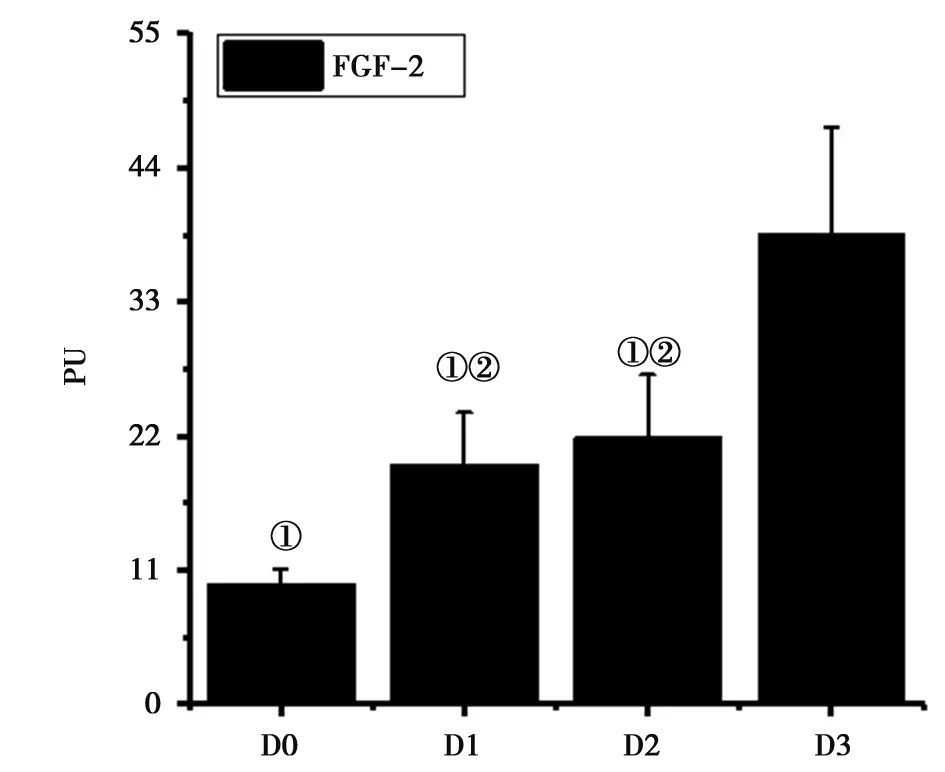
注:①表示相较于D3组,P<0.05;②表示相较于D0组,P<0.05图7 4组大鼠FGF-2蛋白阳性表达
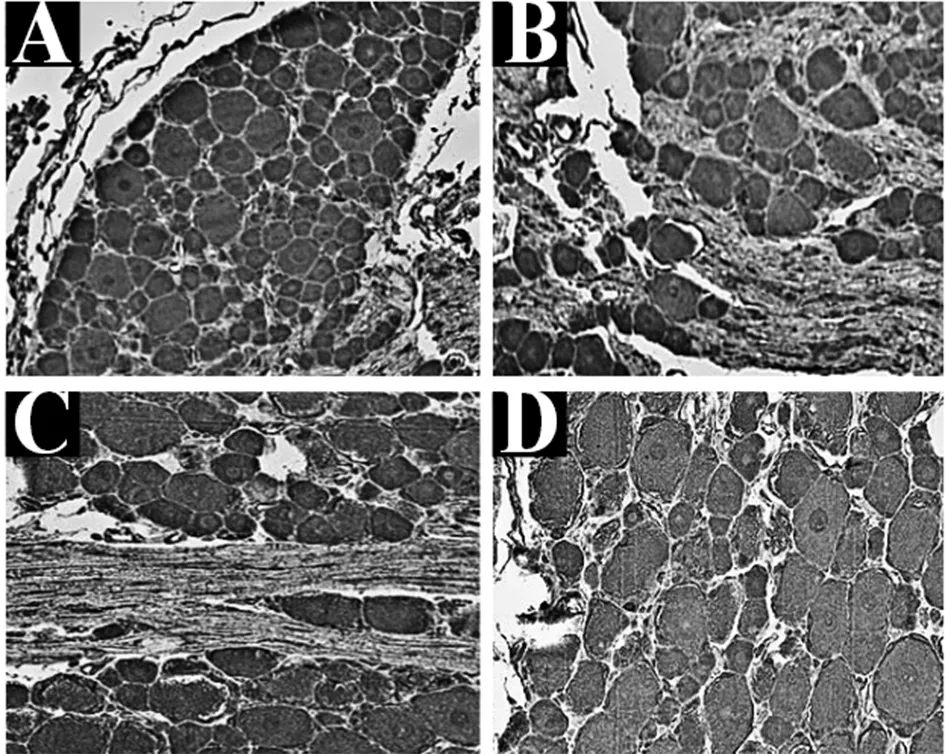
注:A为D0组免疫组染;B为D1组免疫组染;C为D2组免疫组染;D为D3组免疫组染图8 4组大鼠FGF-2蛋白免疫组染图(×400)
3 讨论
疼痛疾病是一种世界性难题,其中糖尿病神经病理性疼痛作为常见的糖尿病并发症状,是由于多种途径的综合作用,包括多元醇途径、蛋白激酶C途径、晚期糖基化终末产物代谢途径等,这些途径都可能引发机体炎性反应、基因表达改变、线粒体功能失衡,最终导致糖尿病神经病变[12]。吡哆胺和辛伐他汀都是目前临床研究中可能对于糖尿病神经病理性疼痛产生治疗效果的药物[13],所以本研究将8~10周的30只健康雄性SD大鼠构建了糖尿病神经病理性疼痛模型,并给予吡哆胺和辛伐他汀进行药物治疗。结果与陈波等[14]的研究结果相类似,表明吡哆胺和辛伐他汀两种药物对于糖尿病大鼠的血糖及体重都没有产生显著影响。与正常对照组相比,糖尿病大鼠建模后表现出多食、多饮、多尿的表现,毛发变黄,活力下降[15]。D3组大鼠的PWMT、PWTL 1周内随时间推移而明显下降,且显著低于D0、D1、D2组,说明吡哆胺和辛伐他汀都能有效改善机械疼痛阈值,减轻大鼠的机械痛敏及热痛阈。D1、D2组大鼠的PWMT、PWTL 1周内随时间推移而稍有下降,但两者比较差异无统计学意义(P>0.05),这说明吡哆胺和辛伐他汀对于大鼠的机械痛敏和热痛阈改善效果相近[16]。
D3组大鼠的 RAGE蛋白阳性表达率明显高于D1、D2组,D1组和D2组大鼠的 RAGE蛋白阳性表达率比较差异无统计学意义(P>0.05),这与刘星玥等[17]的研究结果相类似,表明糖尿病会导致大鼠脊髓背角中的RAGE表达升高,而吡哆胺和辛伐他汀都能够在一定程度上降低RAGE的过表达,且改善效果相近。D3组大鼠的 p-NF-κB蛋白阳性表达率明显高于D1、D2、D3组,D1组和D2组大鼠的p-NF-κB的蛋白阳性表达率比较差异无统计学意义(P>0.05),这同样表明吡哆胺和辛伐他汀对于p-NF-κB的激活有着较强的抑制作用,改善大鼠的神经病变[18]。D3组大鼠的FGF-2蛋白PU值明显高于D1、D2、D3组,D1组和D2组大鼠FGF-2蛋白PU值比较差异无统计学意义(P>0.05),这与于婷等[19]的研究结果存在差异。成纤维细胞生长因子是分泌蛋白家族的一大种类,已有研究证实其可以通过自分泌、内分泌等途径参与机体内多种不同的生理生化反应,而FGF-2作用其中一种内分泌因子,也在糖尿病大鼠内分泌调控中起到了相应作用[20]。由此,结果表明正常大鼠的FGF-2蛋白表达较低,而糖尿病大鼠呈现高表达状态,提示FGF-2参与了大鼠神经病理疼痛的产生和维持,而吡哆胺和辛伐他汀则可以降低FGF-2的表达。
本研究将8~10周的30只健康雄性SD大鼠构建了糖尿病神经病理性疼痛模型,并分别给予吡哆胺和辛伐他汀进行药物治疗,10只正常大鼠作为对照。通过比较各组大鼠的机械疼痛、热阈痛、RAGE、FGF-2和p-NF-κB蛋白表达,结果发现内分泌因子FGF-2参与了大鼠神经病理疼痛的产生和维持。吡哆胺和辛伐他汀能够通过抑制RAGE、p-NF-κB的激活及FGF-2蛋白的表达,来有效减轻糖尿病大鼠的机械痛敏及热阈痛,且改善效果相近。但是本研究并没有更为细致的划分吡哆胺和辛伐他汀的用量,来探讨最佳用药量的选择,后续考虑加大大鼠的样本量,做进一步分析。总之,本研究结果为糖尿病神经病理性疼痛的治疗提供了理论基础。
