苦参素对离体大鼠胰岛素分泌的影响
2022-07-07高璟英夏李霞卫园园白汝雪
高璟英,夏李霞,卫园园,白汝雪
糖尿病是一种高发的慢性进行性疾病,按照国际糖尿病联盟报告,2021年全球成年糖尿病病人达到5.37亿例,相较于2019年,糖尿病病人增加了7 400万例,增幅达16%,突显出全球糖尿病患病率增长迅速,糖尿病导致过早死亡和残疾,给社会带来沉重的经济负担,防治工作需全球共同行动[1]。苦参素是中药苦参的主要成分,具有抗炎、抗病毒、保肝、抗肿瘤、免疫调节、抗氧化、调节离子通道等作用[2-6]。多项研究显示,苦参素可降低血糖,促进胰岛素分泌[7-8],具体机制尚未明确。本研究探讨离体大鼠胰岛中苦参素对电压门控性钾通道的作用,为苦参素应用于糖尿病的防治提供理论基础。
1 材料与方法
1.1 实验动物 雄性Sprague-Dawley(SD)大鼠,体质量(250±20)g,由山西医科大学实验动物中心提供。每5只1笼,温度(25±2)℃,湿度55%~60%,自由摄食和饮水。动物的饲养和处理均得到了山西医科大学动物饲养和动物使用伦理委员会批准。
1.2 实验试剂 苦参素、青链霉素、多聚赖氨酸、histopaque-1077分离液购自美国Sigma公司;胎牛血清、RPM1-1640培养基购自美国Gibco公司;胶原酶P、DispaseⅡ购自美国Roche公司;Hanks缓冲液购自武汉博士德生物工程有限公司;大鼠胰岛素放射免疫试剂盒购自北京北方生物技术研究所;葡萄糖4-(2-羟乙基)-1-哌嗪乙磺酸[4-(2-hydroxyethyl)piperazine-1-ethanesulfonic acid,HEPES]、分析纯氯化钠(NaCl)、氯化钾(KCl)、氯化镁(MgCl2)、氯化钙(CaCl2)、磷酸二氢钾(KH2PO4)、硫酸镁(MgSO4)、碳酸氢钠(NaHCO3)、氢氧化钾(KOH)、氢氧化钠(NaOH)购自上海生工生物股份有限公司;无水乙醇购自天津市北辰方正试剂厂;清蛋白购自北京索莱宝公司。
1.3 实验仪器 CO2培养箱购自美国Thermo公司;体视显微镜购自深圳市隆基仪器设备有限公司;超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;HEKA膜片钳系统购自德国HEKA公司;Narishige MODEL PP-830电极拉制仪购自日本东京Narishige公司;MICRO-FORGE MF-200抛光仪购自美国World Precision Instruments公司。
1.4 实验方法
1.4.1 胰岛的分离和培养 麻醉处死大鼠,打开腹腔,找到胆总管和胰管在肠端的交汇处,使用止血钳夹住,体视镜下,剥离胆总管后剪小口。使用注射器将配制的胶原酶P 10 mL(1 mg/mL)从剪好的小口缓慢注入胰腺。待胰腺膨胀后剥离,放入50 mL的离心管中,38 ℃水浴,消化约11 min,之后加入适量的4 ℃含10%胎牛血清的1640培养基和Hanks缓冲液终止消化,离心(1 200 r/min)3 min后,弃去上清液,加入10 mL histopaque-1077分离液吹匀后,用注射器沿着管壁缓慢将1640培养基10 mL注入管中,再次离心(3 200 r/min)23 min,在培养基和分离液之间看到的即为胰岛。将挑选的胰岛置于培养箱中,37 ℃,5%CO2,97%湿度培养待用。
1.4.2 胰岛细胞的分离和培养 将挑选的胰岛置于eppendorf(EP)管中,加入DispaseⅡ酶液100 μL,消化5 min后,采用4 ℃含10%胎牛血清的1640培养基终止消化,离心(1 000 r/min)2 min后,弃掉上清液,将消化得到的细胞滴于多聚赖氨酸处理过的玻片上,待细胞沉降、贴壁,在培养皿中加入含10%胎牛血清的1640培养基,37 ℃,5%CO2,97%湿度培养待用。
1.4.3 胰岛素分泌实验 实验分3轮,每轮4组。实验时先将每个EP管中加入含葡萄糖2.8 mmol/L的Krebs-Ringer bicarbonate HEPES(KRBH)液1 mL,将培养的胰岛加入EP管中,置于培养箱中37 ℃预孵育30 min后取出,弃上清液。KRBH液组成:NaCl 128.8 mmol/L,KCl 4.8 mmol/L,CaCl22.5 mmol/L,KH2PO41.2 mmol/L,MgSO41.2 mmol/L,NaHCO35 mmol/L,HEPES 10 mmol/L,清蛋白2%,pH值7.4。第1轮实验中,胰岛分别置于含葡萄糖2.8 mmol/L,葡萄糖2.8 mmol/L+苦参素1 μmol/L,葡萄糖2.8 mmol/L+苦参素10 μmol/L,葡萄糖2.8 mmol/L+苦参素100 μmol/L的KRBH液中孵育。第2轮实验中,胰岛分别置于含葡萄糖11.1 mmol/L,葡萄糖11.1 mmol/L+苦参素1 μmol/L,葡萄糖11.1 mmol/L+苦参素10 μmol/L,葡萄糖11.1 mmol/L+苦参素100 μmol/L的KRBH液中孵育。第3轮实验中,胰岛分别置于含葡萄糖16.7 mmol/L,葡萄糖16.7 mmol/L+苦参素1 μmol/L,葡萄糖16.7 mmol/L+苦参素10 μmol/L,葡萄糖16.7 mmol/L+苦参素100 μmol/L的KRBH液中孵育。每轮实验胰岛被孵育30 min后,吸取各组上清液,-20 ℃保存,用于检测胰岛素含量。最后在胰岛中加入酸乙醇(无水乙醇∶盐酸∶水体积比为150∶3∶47),利用超声细胞粉碎仪破碎、稀释后,-20 ℃保存,检测胰岛中储存的胰岛素含量。胰岛素含量采用放射免疫分析法测定,即上清液胰岛素含量/胰岛中储存的胰岛素含量。
1.4.4 膜片钳实验 实验分为对照组和苦参素(10 μmol/L)组。配制电压门控性钾通道(voltage-gated potassium channel,Kv)的电极内液、电极外液,药物溶解于相应的电极外液中。Kv电极内液:KCl 140 mmol/L,MgCl21 mmol/L,NaCl 10 mmol/L,HEPES 10 mmol/L,乙二醇双(2-氨基乙基醚)四乙酸[methylenebis(oxyethylenenitrilo) tetraacetic acid,EGTA]0.05 mmol/L,使用KOH调节pH值至7.3。Kv电极外液:NaCl 141.9 mmol/L,KCl 5.6 mmol/L,MgCl21.2 mmol/L,HEPES 5 mmol/L,葡萄糖11.1 mmol/L,使用NaOH调节pH值至7.4。Narishige MODEL PP-830电极拉制仪拉制电极,MICRO-FORGE MF-200抛光仪抛光电极,使电极电阻达到4~7 MΩ。采用EPC-10型膜片钳放大器收集电信号,通过去极化刺激激发动作电位、Kv。破膜后细胞膜电容>7 picofarad(pF)的细胞是β细胞[9]。记录Kv设置:钳制电压为-70 mV,刺激从-70 mV增加到+80 mV,步阶为10 mV,时程为400 ms,选取最终50 ms 稳定以后的均值。记录动作电位设置:钳制电压为-70 mV,选择电流钳模式,给予150 picoampere(pA),4 ms的电流刺激细胞,记录从开始去极化到复极化达到距离静息电位10 mV的时间作为动作电位时程[10]。

2 结 果
2.1 不同剂量苦参素对胰岛素分泌的影响 低糖(2.8 mmol/L)时,苦参素(1 μmol/L、10 μmol/L、100 μmol/L)对胰岛素分泌无影响(P>0.05)。高糖(11.1 mmol/L、16.7 mmol/L)时,苦参素(10 μmol/L、100 μmol/L)促进了胰岛素分泌(P<0.01)。与葡萄糖11.1 mmol/L比较,葡萄糖11.1 mmol/L+苦参素(10 μmol/L)胰岛素分泌增加;与葡萄糖16.7 mmol/L比较,葡萄糖16.7 mmol/L+苦参素(10 μmol/L、100 μmol/L)胰岛素分泌增加。详见表1。

表1 不同剂量苦参素对胰岛素分泌的影响(±s)
2.2 苦参素抑制了β细胞的Kv 电流-膜电位曲线表明苦参素(10 μmol/L)抑制了Kv,详见图1。测试电压为30 mV时,与对照组比较,苦参素(10 μmol/L)组电流被抑制(P<0.01)。详见表2。
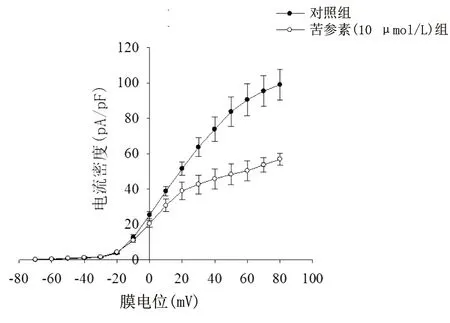
图1 两组电流-膜电位曲线图

表2 苦参素对电压门控性钾通道的影响(±s) 单位:pA/pF
2.3 苦参素对β细胞的动作电位时程的影响 苦参素(10 μmol/L)延长了大鼠胰岛β细胞的动作电位时程。与对照组比较,苦参素组动作电位时程延长(P<0.01)。详见图2、表3。
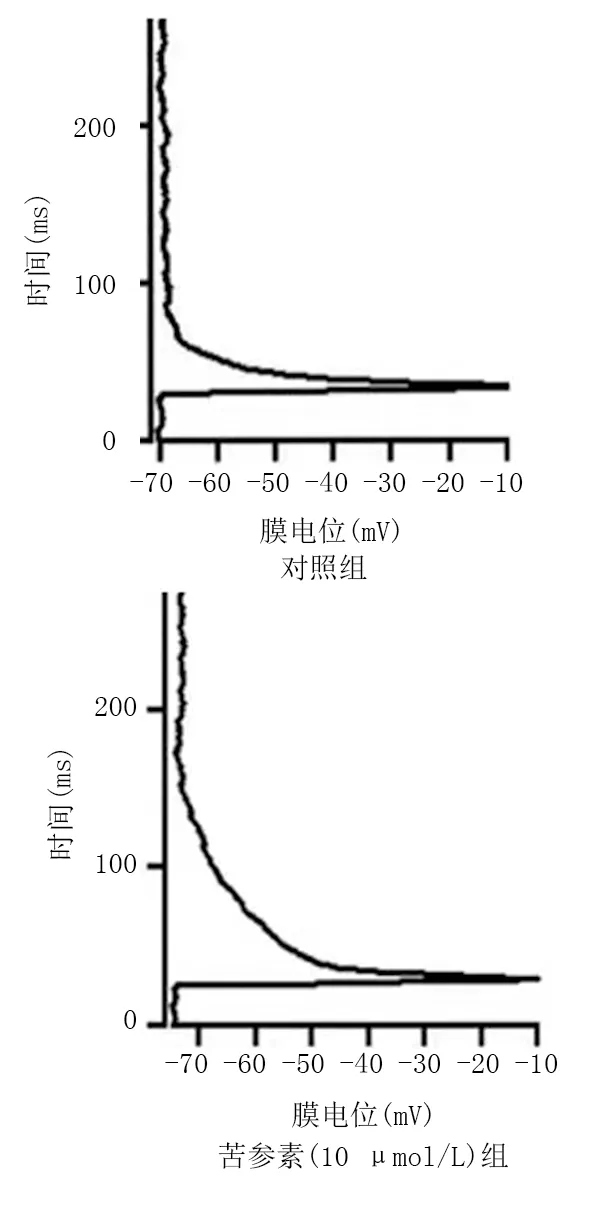
图2 两组胰岛β细胞膜电位-动作电位时程变化图

表3 苦参素对动作电位时程的影响(±s) 单位:ms
3 讨 论
作为重大的慢性非传染性疾病,糖尿病及血管并发症的防控工作已成为“健康中国2030”规划的重要内容之一[11]。有研究显示,口服苦参素后,2型糖尿病病人空腹血糖、三酰甘油、总胆固醇和肿瘤坏死因子-α水平降低,胰岛素抵抗得到了改善[7]。糖尿病大鼠中,苦参素明显增加了胰岛数目,促进了胰岛素分泌,提高了胰岛素敏感性,增加了肌肉葡萄糖转运蛋白-4的水平,降低了血脂,同时升高血清胰高血糖素样肽-1(GLP-1)水平[8]。血管内皮细胞功能受损是糖尿病血管并发症发展的重要起始因素和关键因素。脐静脉内皮细胞中,苦参素通过抑制炎性因子和腺苷A2B受体的表达,减轻了高糖导致的内皮细胞毒性[12]。
胰岛β细胞中,葡萄糖刺激胰岛素分泌与细胞膜离子通道密切相关。Kv是胰岛β细胞上主要的复极化通道。葡萄糖使细胞内ATP水平增加,导致ATP敏感性钾通道关闭,引起细胞膜去极化,活化了电压门控性钙通道,钙离子进入细胞,促进了胰岛素分泌。细胞膜去极化激活了Kv,钾离子排出细胞,促进β细胞复极化,阻止钙离子通过电压门控性钙通道进入细胞,因此阻止了胰岛素分泌[13]。
为阐明苦参素在胰岛β细胞中的作用,本研究分析苦参素与Kv的关系。结果显示,低糖时,苦参素未影响胰岛素的分泌;高糖时,苦参素促进了胰岛素分泌,表明苦参素调节胰岛素分泌的作用是依赖于葡萄糖浓度。膜片钳实验中,苦参素抑制了Kv,延长了动作电位时程。相关研究表明,Kv被抑制后,可以通过延长动作电位时程而升高细胞内钙离子浓度[14-16],从而引起胰岛素分泌,且这种促胰岛素分泌效应是葡萄糖依赖性的[16-18],与本研究结果一致,进一步证实Kv在苦参素促胰岛素分泌中的重要作用。
总之,大鼠的胰岛β细胞中,苦参素的促胰岛素分泌作用与抑制Kv、延长动作电位时程有关,为探讨苦参素调节胰岛细胞功能的机制开拓了新的视野,为治疗糖尿病提供了理论依据。
