基于TLR4/NF-κB/NLRP3和PI3K/Akt通路研究甘遂及其炮制品对水负荷小鼠的利尿作用及机制
2022-07-07宁晨旭苏晓娟任可乐刘晓琴孟祥龙赵彩蓉赵泓瑜张朔生
宁晨旭,苏晓娟,任可乐,刘晓琴,孟祥龙,赵彩蓉,赵泓瑜,王 娟,张朔生*
基于TLR4/NF-κB/NLRP3和PI3K/Akt通路研究甘遂及其炮制品对水负荷小鼠的利尿作用及机制
宁晨旭1, 2,苏晓娟1, 2,任可乐1, 2,刘晓琴1, 2,孟祥龙1, 2,赵彩蓉1, 2,赵泓瑜1, 2,王 娟1, 2,张朔生1, 2*
1. 山西中医药大学中药与食品工程学院,山西 晋中 030619 2. 山西中医药大学 中药炮制山西省重点实验室,山西 晋中 030619
研究甘遂及其炮制品对水负荷小鼠的利尿作用及机制。通过网络药理学探究甘遂的利尿作用机制。ICR小鼠给予甘遂及其炮制品后,ig大量生理盐水建立水负荷模型,测定水负荷差值及脏器指数;取十二指肠及空肠,观察病理变化;采用ELISA法测定小鼠血清中炎性因子指标白细胞介素-1β(interleukin-1β,IL-1β)、IL-18、IL-4、IL-10及小肠组织中氧化应激指标丙二醛(malondialdehyde,MDA)和还原型谷胱甘肽(glutathione,GSH)水平;采用Western blotting测定小鼠小肠组织中Toll样受体4(Toll-like receptor 4,TLR4)、核因子-κB(nuclear factor-κB,NF-κB)、NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)、磷脂肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)和蛋白激酶B(protein kinase B,Akt)蛋白表达。通过构建“中药-成分-疾病-通路-靶点”网络及通路富集分析得到甘遂及其炮制品主要通过参与氧化应激反应及PI3K/Akt等信号通路调节水肿。体内实验结果显示,与模型组比较,各给药组小鼠水负荷差值在各个时间段均显著升高(<0.01);血清中IL-1β、IL-18及小肠组织MDA水平均显著降低(<0.05、0.01),血清中IL-4、IL-10及小肠组织GSH水平均显著升高(<0.05、0.01);小肠组织TLR4、NLRP3、p-NF-κB/NF-κB、p-PI3K/PI3K及p-Akt/Akt蛋白表达水平均显著降低(<0.01)。在各给药组中,1~6 h甘遂的利尿作用最强,醋甘遂和甘草制甘遂的利尿作用均有所缓解,说明甘遂经炮制后会缓和其刺激性而平衡其利尿作用。甘遂及其炮制品对水负荷小鼠均可以不同程度地抗水负荷并产生利尿作用,并可以通过抑制TLR4通道介导的NF-κB/NLRP3信号通路及PI3K/Akt信号通路从而抑制IL-1β和IL-18的表达。
甘遂;甘草制甘遂;醋甘遂;水负荷模型;炎性细胞因子;磷脂肌醇-3-激酶/蛋白激酶B信号通路;NOD样受体蛋白3
甘遂是大戟科植物甘遂T. N. Liou ex T. P. Wang的干燥块根,其性苦味寒,有毒,具有泻水逐饮、消肿散结的功效,传统临床常用来治疗水肿胀满、胸腹积水、痰饮积聚、气逆咳喘、二便不利,现代临床常用于治疗肝硬化腹水及胰腺炎等。甘遂主要含有大戟二烯醇、表大戟二烯醇、巨大戟醇、甘遂萜酯A及甘遂萜酯B等萜类成分[1-2]。甘遂临床上常利用利尿作用治疗水肿、臌胀、胸胁停饮及其引起的炎症及氧化应激反应。生甘遂虽然利尿作用明显,但甘遂的生品具有强烈的刺激性。依据中药传统炮制理论,中药经炮制后会减毒增效,故临床常应用甘遂醋制品及甘草制品来减缓甘遂的刺激性。生甘遂经醋制后会降低其毒副作用并缓解其刺激性[3]。清代的《外科证治全生集》认为甘遂经甘草制可以祛其苦寒之性[4]。本课题组前期应用热重-微商热重技术模拟炮制过程,从定性角度阐释醋炙甘遂的整体化学成分变化规律;运用响应曲面法,优选出醋甘遂的最佳炮制工艺,并从抗炎因子、促炎因子水平的角度初步探究甘遂醋炙后的利尿作用以及醋炙后毒性的变化及其炮制减毒的机制;依据甘遂不同提取部位受热过程中挥发成分的动态变化来确定甘遂炮制的最佳炮制温度点(即炮制火力),以CCK-8和乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测法来筛选生甘遂毒性部位[3];运用响应曲面法优选甘草制甘遂的炮制工艺[5-6]。现代研究中以醋甘遂研究居多,而甘草制甘遂研究居少。
水肿激发炎性通路进而抑制利尿作用[7-8]。NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性小体对众多抗炎因子、促炎因子的表达起到至关重要的作用,磷脂肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)在炎症细胞的迁移中也有很重要的作用,蛋白激酶B(protein kinase B,Akt)是PI3K的直接靶蛋白,PI3K/Akt信号通路也是常见的炎性信号通路[9-10]。核因子-κB(nuclear factor-κB,NF-κB)及Toll样受体4(Toll-like receptor 4,TLR4)上游蛋白激发NLRP3炎性小体,从而促进促炎因子白细胞介素-1β(interleukin-1β,IL-1β)和IL-18的释放,而PI3K/Akt信号通路的激活也可能会直接促进IL-1β和IL-18的释放。故本研究采用网络药理学[11]方法对甘遂的泻水逐饮机制进行分析,并基于PI3K/Akt及TLR4/NF-κB/NLRP3信号通路对生甘遂、醋甘遂及甘草制甘遂3个炮制品进行药效验证实验,探究甘遂利尿的作用机制。
1 材料
1.1 数据库及软件
中药系统药理学数据库(TCMSP,http://tcmspw. com/tcmsp.php);Swisstargetsprediction(http://www. swisstargetprediction.ch/);人类基因数据库(GeneCards,https://www.genecards.org/);美国国家生物技术信息中心(NCBI,https://www.ncbi.nlm. nih.gov/);String数据库(https://string-db.org/cgi/ input.pl);Venny 2.1软件(http://bioinfogp.cnb.csic.es/ tools/venny/index.html);Cytoscape 3.8.0软件(http:// cytoscape.org)。
1.2 动物
清洁级ICR雄性小鼠96只,体质量(20±3)g,7周龄,购自斯贝福(北京)生物技术有限公司,动物批号110324200103969947,实验动物许可证号SCXK(京)2019-0010。动物饲养于山西中医药大学中药炮制省重点实验室动物房,温度(24±1)℃,湿度(50±10)%,自由进食饮水,光照条件保持昼夜交替,适应性饲养5 d。动物实验经山西中医药大学医学伦理委员会批准(批准号2019LL201)。
1.3 药材
生甘遂(批号20200909)、甘草(批号20190807)购自山西和仁堂中药饮片有限公司,经山西中医药大学张朔生教授鉴定分别为大戟科植物甘遂T. N. Liou ex T. P. Wang的干燥块根、豆科植物甘草Fisch.的干燥根和根茎。
1.4 药品与试剂
米醋购自山西紫林醋业有限公司;羧甲基纤维素钠(批号20190201)购自天津百伦斯生物技术有限公司;呋塞米(批号2003022)购自天津力生制药股份有限公司;小鼠IL-1β ELISA试剂盒(批号30369)、小鼠IL-4 ELISA试剂盒(批号MU30385)、小鼠IL-18 ELISA试剂盒(批号MU30380)、小鼠IL-10 ELISA试剂盒(批号MU30380)、小鼠丙二醛(malondialdehyde,MDA)ELISA试剂盒(批号MU30447)、小鼠还原型谷胱甘肽(glutathione,GSH)ELISA试剂盒(批号MU30932)、TLR4抗体(批号BS3489)、NF-κB p65抗体(批号BS1253)、p-NF-κB p65抗体(批号AP0475)购自武汉贝茵莱生物科技有限公司;苏木素-伊红(HE)染色试剂盒(批号20190711)购自北京索莱宝科技有限公司;无水乙醇(批号20191023)购自国药集团化学试剂有限公司;二甲苯(批号200926)购自天津市申泰化学试剂有限公司;石蜡(批号20180725)购自北京北化康泰临床试剂有限公司;PI3K抗体(批号BS3678)、磷酸化PI3K(phosphorylated PI3K,p-PI3K)抗体(批号AP0153)、Akt抗体(批号BS1810)、p-Akt抗体(批号BS4006)、β-actin抗体(批号AP0060)购自Bioworld Technology公司;NLRP3抗体(批号BA3677)、HRP标记的山羊抗兔单克隆抗体(批号BA1054)、增强型RIPA裂解液(批号AR0102-500)、广谱磷酸酶抑制剂混合物(批号AR1195)、蛋白质抑制剂PMSF(批号AR1178),丽春红染色液(批号AR0142-100)、5×蛋白上样缓冲液(批号AR1112-10)购自武汉博士德生物工程有限公司。
1.5 仪器
Histocentre 3型石蜡包埋机、Finesse 325型石蜡切片机、系统全自动组织脱水机(英国Shandon有限公司);BX53型荧光显微成像(日本Olympus公司);DM6000B型生物显微镜(德国Leica公司);U3000型高效液相色谱仪(美国Thermo Fisher Scientific公司);AX224ZH/E型电子天平(奥豪斯仪器有限公司);TGL16M型高速冷冻离心机(湖南湘立科学仪器有限公司);DNM9602型酶标仪、GeneGnome成像系统(基因有限公司)。
2 方法
2.1 网络药理学预测
2.1.1 甘遂活性成分及水肿靶点的筛选 通过TCMSP数据库进行甘遂活性成分的筛选,根据口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18,将筛出的活性成分在TCMSP数据库和Swisstargets数据库中进行靶点预测[12]。在GeneCards数据库和NCBI数据库进行人类基因检索,筛选得到水肿相关靶点。
2.1.2 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)构建、GO功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路通路富集分析 将活性成分和疾病的共有的靶点输入String数据库构建PPI网络,将共有靶点进行GO功能和KEGG通路富集分析,引用String数据库,筛选校正值≤0.05的条目。
2.2 实验验证
2.2.1 醋甘遂及甘草制甘遂的制备 醋甘遂及甘草制甘遂均按本课题组通过响应曲面优化而得的工艺进行炮制:醋甘遂最佳炮制工艺为加醋量为31.54%,270 ℃炒制3.5 min;甘草制甘遂的最佳炮制工艺为加甘草汁的量为27%,干燥温度为180 ℃,干燥时间为11 min。按照《中国药典》2020年版方法分别测定甘遂生品、醋甘遂及甘草制甘遂中的大戟二烯醇含量[13],其质量分数分别为(0.230 50±0.043 72)、(0.122 00±0.018 12)、(0.144 60±0.030 80)mg/g。《中国药典》2020年版规定甘遂含大戟二烯醇(C30H50O)不得少于0.12%,符合《中国药典》2020年版规定。
2.2.2 分组、造模及给药 根据《中国药典》2020年版确定人的给药剂量为0.5~15.0 g[13],按照《中药药理研究方法学》(第3版)[14]中小鼠与人的等效剂量比值为9.1进行换算,并依据预实验结果,ICR雄性小鼠随机分为对照组、模型组、呋塞米(15 mg/kg)组及甘遂高、中、低剂量(300、150、75 mg/kg)组及醋甘遂高、中、低剂量(300、150、75 mg/kg)组和甘草制甘遂高、中、低剂量(300、150、75 mg/kg)组。呋塞米及甘遂不同炮制品的粉末用0.5%羧甲基纤维素钠溶解。对照组和模型组ig 0.2 mL 0.5%羧甲基纤维素钠,各给药组ig相应药物,1次/d,连续7 d。末次给药前禁食24 h,给药1 h后,轻轻按压小鼠腹部使其排尽余尿,模型组和各给药组小鼠ig 1 mL生理盐水造模,即刻称定体质量作为水负荷零时体质量,在水负荷实验后1、2、4、6 h后称定体质量,作为水负荷实时体质量,计算水负荷差值。
水负荷差值=水负荷零时体质量-水负荷实时体质量
2.2.3 十二指肠及空肠病理变化 实验结束后,取各组小鼠十二指肠及空肠,于10%福尔马林液中固定48 h,经常规脱水、石蜡包埋、4 µm切片后,进行HE染色,透明并封片后,于显微镜下观察并拍照。
2.2.4 血清炎性因子水平的检测 实验结束后,用采血管收集各组小鼠血液,室温凝固30 min,10 000 r/min离心15 min,收集上清,按照ELISA试剂盒说明书测定血清IL-1β、IL-18、IL-4和IL-10水平。
2.2.5 小肠组织氧化应激指标MDA及GSH水平的检测 取小鼠小肠组织,用PBS(0.01 mol/L,pH 7.4)冲洗,洗去组织表面残留的血液或杂质。称定小肠组织质量,剪碎后加入预冷的PBS(临用前加入蛋白酶抑制剂)于冰上匀浆,4 ℃、10 000 r/min离心5~10 min,取上清,于−20 ℃或−80 ℃保存。按照ELISA试剂盒说明书测定MDA及GSH水平。
2.2.6 小肠组织p-PI3K/PI3K、p-Akt/Akt和TLR4/NF-κB/NLRP3通路相关蛋白表达 取小鼠小肠组织100 mg,加入1 mL增强型RIPA裂解液匀浆,冰上裂解30 min,4 ℃、12 000 r/min离心5 min,取上清液,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用含5%脱脂奶粉的TBST溶液封闭3 h,用TBST溶液洗3次;分别加入p-PI3K抗体(1∶500)、PI3K抗体(1∶500)、p-Akt抗体(1∶500)、Akt抗体(1∶500)、TLR4抗体(1∶500)、NLRP3抗体(1∶500)、NF-κB抗体(1∶500)和β-actin抗体(1∶5000),4 ℃静置过夜,TBST 溶液洗3次;加入HRP标记的羊抗兔二抗(1∶2000),室温孵育1 h,TBST洗3次后显影,将PVDF膜进行扫描,采用Image J图像分析软件测定目的条带灰度值。
2.2.7 统计学处理 采用Graphpad Prism 8软件进行统计并作图,实验数据符合正态分布并用来表示,采用单因素方差分析并经过方差齐性检验及组间检验。
3 结果
3.1 甘遂不同炮制品对水负荷小鼠利尿作用的影响
如表1所示,与对照组比较,模型组小鼠水负荷差值在各个时间段均显著升高(<0.01),说明水负荷模型造模成功;与模型组比较,呋塞米组水负荷差值在各个时间段均显著升高(<0.01);1、2、6 h后,甘遂、醋甘遂及甘草制甘遂高、中剂量组水负荷差值均显著高于模型组(<0.01);4 h时,甘遂及醋甘遂高、中剂量和甘草制甘遂各剂量组水负荷差值显著高于模型组(<0.01)。
表1 甘遂不同炮制品对水负荷小鼠利尿作用影响(, n = 8)
Table 1 Effect of different processed products of Kansui Radix on diuretic effect of water-loaded mice (, n = 8)
组别剂量/(mg·kg−1)水负荷差值/g 1 h2 h4 h6 h 对照—0.22±0.020.23±0.010.27±0.050.37±0.04 模型—0.81±0.12##1.23±0.05##1.23±0.05##2.20±0.09## 呋塞米151.76±0.05**2.77±0.50**3.30±0.11**3.75±0.09** 甘遂3001.73±0.09**2.86±0.74**3.36±0.19**3.71±0.10** 1502.46±0.32**2.85±0.34**3.50±0.07**3.90±0.40** 750.53±0.131.34±0.111.45±0.132.12±0.33 醋甘遂3001.53±0.36**1.95±1.52**2.48±0.20**3.31±0.25** 1501.46±0.12**2.35±0.35**3.06±0.06**3.42±0.15** 750.70±0.100.90±0.121.10±0.162.15±0.31 甘草制甘遂3001.84±0.10**2.66±1.08**3.15±0.03**3.85±0.17** 1501.55±0.13**2.15±1.70**3.00±0.17**3.57±0.14** 750.79±0.131.54±0.222.32±0.19**2.56±0.32
与对照组比较:##<0.01;与模型组比较:*<0.05**<0.01,表2~4同
##< 0.01control group;*< 0.05**< 0.01model group, same as tables 2—4
3.2 甘遂不同炮制品对水负荷小鼠脏器指数的影响
如表2所示,与对照组比较,模型组肾、胃、小肠的脏器指数显著降低(<0.01);与模型组比较,醋甘遂高剂量组和甘草制甘遂高剂量组小鼠的胃脏指数显著升高(<0.05、0.01),说明醋甘遂高剂量组及甘草制甘遂高剂量组可能对受损伤的胃有治疗作用,表明甘遂炮制可增强疗效;甘遂高、中剂量组及醋甘遂高、中剂量组和甘草制甘遂各剂量组小肠指数均显著高于模型组(<0.05、0.01),而甘草制甘遂高剂量组及醋甘遂高剂量的小肠指数要高于甘遂高剂量组的小肠指数,说明甘遂经炮制后可能会降低对小肠的刺激性,从而提高小肠指数。
3.3 甘遂不同炮制品对水负荷小鼠十二指肠和空肠病理变化的影响
如图1所示,对照组小鼠十二指肠与空肠黏膜完整,且无增生。模型组十二指肠绒毛增生、肥大,黏膜层增厚伴有肠黏膜层坏死;空肠绒毛增生、肥大,充满整个肠腔,黏膜层增厚,局部性坏死并伴有肠萎缩,说明急性水负荷模型造模成功,导致小鼠水肿并伴有炎症。呋塞米组小鼠十二指肠绒毛轻度损坏,空肠轻度增生。甘遂高剂量组十二指肠绒毛增生,空肠黏膜组增厚,肠腔消失,甘遂中剂量组肠绒毛增生,空肠绒毛增生;甘遂低剂量组十二指肠和空肠绒毛增生,肠粘连;醋甘遂高剂量组十二指肠绒毛轻度损坏,空肠黏膜和肠腺增生;醋甘遂中剂量组十二指肠和空肠的黏膜轻度损坏;醋甘遂低剂量组绒毛增生并有一定程度的损坏,空肠绒毛轻度增生肥大;甘草制甘遂高剂量组十二指肠和空肠绒毛增生伴有肠萎缩;甘草制甘遂中剂量十二指肠绒毛增生充满肠腔,空肠基本正常;甘草制甘遂低剂量组十二指肠和空肠绒毛增生充满肠腔,肠萎缩肠腔消失。
表2 甘遂不同炮制品对水负荷小鼠脏器指数的影响(, n = 8)
Table 2 Effect of different processed products of Kansui Radix on organ index of water loaded mice (, n = 8)
组别剂量/(mg·kg−1)脏器指数/(mg·g−1) 肾胃小肠 对照—22.52±1.699.36±0.3143.55±2.98 模型—15.68±1.57##6.56±1.10##24.42±2.12## 呋塞米1517.47±1.718.10±0.9033.32±2.81** 甘遂30016.96±1.417.00±0.5531.54±1.88** 15016.36±1.276.76±0.9232.00±2.23** 7515.94±1.317.19±0.9527.17±3.90 醋甘遂30016.90±1.578.86±1.03*38.98±1.55** 15016.69±1.917.31±0.7329.87±3.24* 7516.44±1.717.34±0.9232.77±2.62 甘草制甘遂30016.59±1.169.13±1.45**39.96±2.46** 15016.62±1.407.74±1.0931.06±3.04* 7516.91±1.007.76±1.1131.16±3.66*
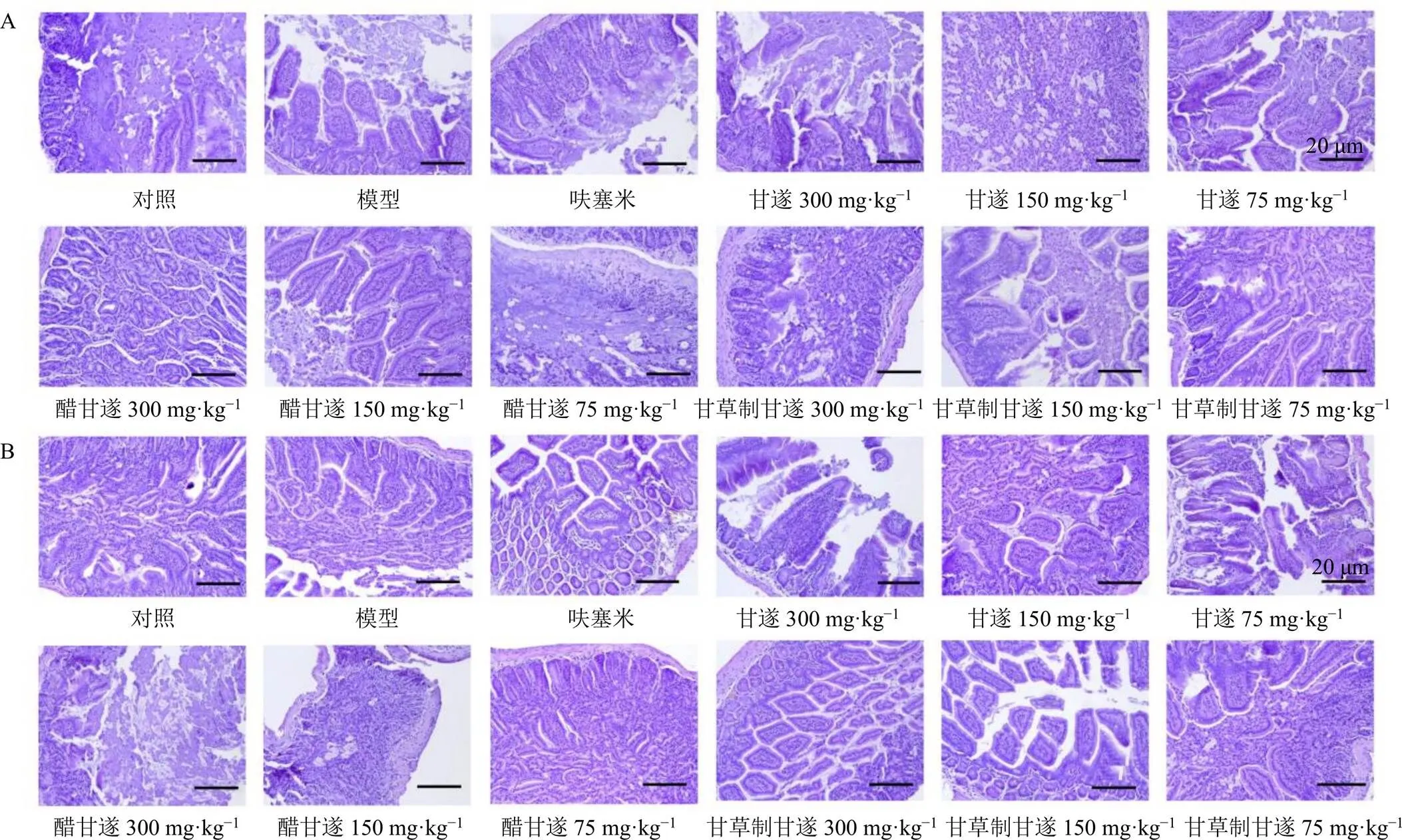
图1 甘遂不同炮制品对水负荷小鼠十二指肠(A) 和空肠(B) 病理变化的影响(HE, ×200)
3.4 甘遂不同炮制品对水负荷小鼠血清IL-1β、IL-18、IL-4和IL-10水平的影响
如表3所示,与对照组比较,模型组小鼠血清中IL-1β和IL-18水平显著升高(<0.01),IL-4和IL-10水平显著降低(<0.01);与模型组比较,各给药组血清中IL-18水平显著降低(<0.05、0.01),IL-10水平显著升高(<0.05、0.01);除甘遂高剂量组和甘草制甘遂低剂量组外,其余各组血清中IL-1β水平均显著降低(<0.05、0.01);甘遂中剂量组、醋甘遂高剂量组和甘草制甘遂高、中剂量组血清中IL-4水平显著升高(<0.05、0.01)。在各给药组中,炮制品组的IL-1β、IL-18水平低于生品组,IL-4、IL-10水平高于生品组。在炮制品组中,甘草制甘遂组的IL-1β、IL-18、IL-4及IL-10水平与醋甘遂无显著差异。
3.5 甘遂不同炮制品对水负荷小鼠小肠组织MDA和GSH水平的影响
如表4所示,与对照组比较,模型组小鼠小肠氧化应激指标MDA水平显著升高(<0.01),GSH水平显著降低(<0.01);与模型组比较,除甘遂高剂量组外,其余各给药组MDA水平均显著降低(<0.05、0.01),GSH水平均显著升高(<0.05、0.01)。
表3 甘遂不同炮制品对水负荷小鼠血清IL-1β、IL-18、IL-4和IL-10水平的影响(, n = 8)
Table 3 Effect of different processed products of Kansui Radix on IL-1β, IL-18, IL-4and IL-10 levels in serum of water loaded mice (, n = 8)
组别剂量/(mg·kg−1)IL-1β/(pg·mL−1)IL-18/(pg·mL−1)IL-4/(pg·mL−1)IL-10/(pg·mL−1) 对照—244.10±12.82256.20±29.14157.00±8.71162.00±7.43 模型—351.00±25.62##448.90±32.14##114.20±4.41##115.10±3.10## 呋塞米15313.10±18.92*347.40±31.68**137.80±6.91**130.30±3.47* 甘遂300334.20±20.27385.00±18.96*116.00±1.77128.40±10.75* 150278.20±7.26**333.10±37.91**131.10±9.18*132.30±10.54* 75262.10±25.77**300.80±45.15**124.00±2.56130.90±5.04* 醋甘遂300250.70±13.12**262.10±28.81**130.40±7.25*142.30±3.48** 150254.50±24.18**281.00±31.46**124.60±5.41138.60±4.87** 75279.60±21.56**302.60±29.13**123.50±4.21126.80±2.76* 甘草制甘遂300278.30±20.36**264.00±36.47**138.80±4.79**150.20±8.28** 150290.90±26.98**286.60±36.33**136.10±4.74*142.20±5.49** 75299.70±23.96302.40±38.28**120.30±8.71128.20±8.79*
表4 甘遂不同炮制品对水负荷小鼠小肠组织MDA和GSH水平的影响(, n = 8)
Table 4 Effect of different processed products of Kansui Radix on MDA and GSH levels in small intestinal of water loaded mice (, n = 8)
组别剂量/(mg·kg−1)MDA/(nmol·L−1)GSH/(μg·mL−1) 对照—142.50±15.852.78±0.18 模型—452.30±29.42##1.94±0.11## 呋塞米15388.50±28.26*2.28±0.17* 甘遂300424.80±33.132.04±0.20 150364.70±18.97**2.12±0.07** 75357.80±22.25**2.31±0.07** 醋甘遂300321.20±27.72**2.45±0.18** 150368.60±25.34**2.44±0.11** 75382.20±34.69*2.00±0.14* 甘草制甘遂300342.30±33.41**2.54±0.05** 150367.50±30.84**2.30±0.06** 75372.30±20.52*2.05±0.10**
3.6 网络药理学预测分析
甘遂获得8个活性成分,347个靶点。甘遂泻水逐饮的活性成分主要有大戟二烯醇(euphol)、多根乌头碱(karacolidine)及甘遂醇(kanziol)等(表5)。以“Edema”为关键词,在GeneCards数据库和NCBI基因数据库进行人类基因检索,共得到1334个水肿相关基因。将筛选出的靶点与疾病靶点输入Venny 2.1软件,得到111个共有靶点,作为药物作用于疾病的预测靶点(图2)。将药物和疾病的共有靶点输入String数据库进行PPI网络的构建,将生物种类设定为“Homo sapiens”,得到PPI网络(图3-A、B),该网络中有111个节点、1015条边,平均度值为18.3。将PPI网络导入Cystoscape 3.8.0,通过NetworkAnalyzer工具进行拓扑分析,以度值为参考标准,通过度值排序,选取分值大于平均分的基因作为关键靶点,共选出40个关键靶点,将前20个靶点使用R3.6.3进行图片绘制,横坐标为每个靶点的度值(图3-C)。将成分-疾病-靶点网络图导入Cytoscape 3.8.0中进行拓扑分析,将成分进行度值排序,度值越高说明成分越重要,构建成分-疾病-靶点网络图,导入Cytoscape 3.8.0进行网络图的绘制(图4)。甘遂泻水逐饮的成分-疾病-靶点网络图显示关键靶点主要包括:有丝分裂原活化蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,CASP3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、MAPK1、MAPK8等。MAPK3、MAPK1、MAPK8属于细胞应激反应机制的关键靶点,CASP3与NLRP3炎性小体密切相关。将共有靶点进行GO功能分析,引用String数据库,筛选校正值≤0.05的条目,总共富集到1533条生物过程,110条分子功能,61条细胞组成,使用R 3.6.3软件绘制柱状图(图5-A)。将共有靶点进行KEGG通路富集分析,使用String数据库,筛选校正值≤0.05的条目,总共富集到134条信号通路,使用R 3.6.3绘制柱状图(图5-B)。将中药-成分-疾病-通路-靶点网络文件导入Cytoscape 3.8.0进行网络图的绘制(图6),甘遂中的活性成分主要作用于PI3K/Akt信号通路、癌症信号通路、RAS信号通路、RAS相关蛋白1(Ras related protein 1,RAP1)信号通路以及缺氧诱导因子(hypoxia inducible factors,HIF)信号通路。PI3K/Akt信号通路、RAS及HIF信号通路同为炎性通路,RAS信号通路与PI3K/Akt信号通路也有一定的相关性,在一定程度上可以参与调节PI3K/Akt信号通路。
表5 甘遂活性成分
Table 5 Active ingredients in Kansui Radix
编号化合物名称OB/%DL MOL002587euphorbetin35.890.54 MOL002588(3S,5R,10S,13R,14R,17R)-17-[(1R)-1,5-dimethyl-4-methylenehexyl]-4, 4,10,13,14-pentamethyl-2,3,5,6,7, 11,12,15,16,17-decahydro-1H-cyclopenta[a]phenanthren-3-ol42.370.77 MOL002590karacolidine60.530.71 MOL002593kansuinin A44.520.55 MOL002597euphol42.120.75 MOL00259820-OD-ingenol Z32.050.85 MOL002599kanziol41.650.75 MOL0026033-O-(2,3-dimethylbutanoyl)-13-O-dodecanoyl-20-deoxyingenol30.820.65

图2 甘遂活性成分与水肿靶点的Venn图
综上所述,本研究经网络药理学分析发现甘遂泻水逐饮的活性成分包含大戟二烯醇及甘遂醇,通过拓扑分析甘遂的关键靶点有MAPK3、CASP3及EGFR等,而通过GO功能及KEGG通路分析预测出的信号通路主要为PI3K-Akt信号通路及RAS等信号通路。MAPK超家族包括Janus激酶(Janus kinase,JNK)/应激活化蛋白激酶(stress-activated protein kinase,SAPK)、大丝裂原活化蛋白激酶1(big mitogen-activated protein kinase l,BMK1)/细胞外调节蛋白激酶(extracellular regulated protein kinases 5,ERK5)和p38 MAPK等家族。其中JNK/SAPK和p38 MAPK主要对炎症因子和多种细胞的应激信号进行传导。MAPK是细胞反应机制的一部分,在细胞信号传导通路中起着重要作用。CASP3在细胞凋亡的执行阶段起着关键作用。EGFR对肿瘤细胞的繁殖、生长、修复和存活等起着重要作用。RAS信号通路可能与慢性肾炎有一定的相关性。PI3K/Akt信号通路及这些关键靶点基因均与炎症因子相关,说明甘遂的利尿作用与炎性因子的表达有关。

图3 PPI网络图 (A、B) 和拓扑分析图(C)
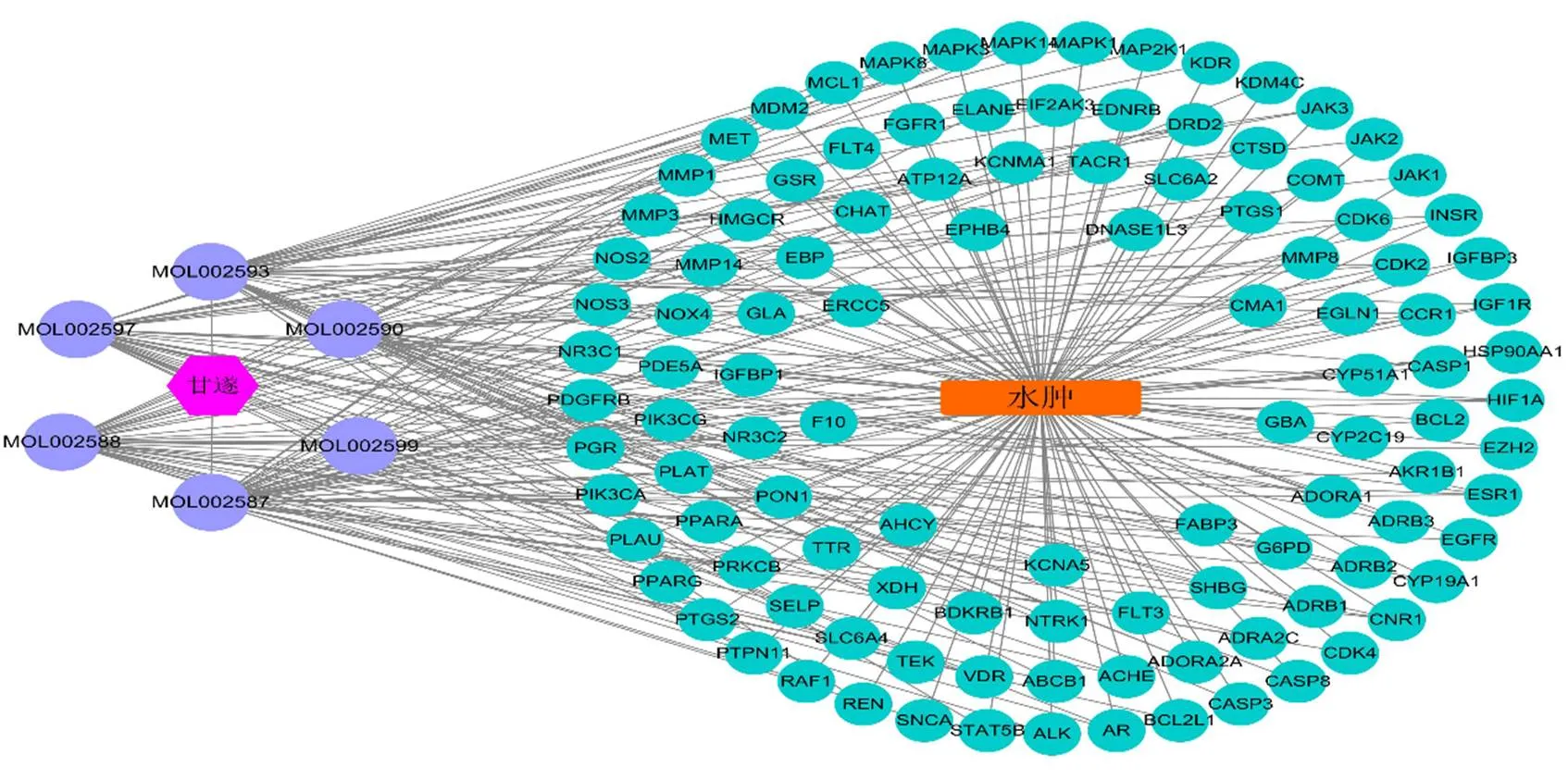
紫色为中药,绿色为活性成分,淡紫色为药物作用于疾病的靶点,红色矩形为疾病

图5 GO功能(A) 和KEGG通路(B) 富集分析
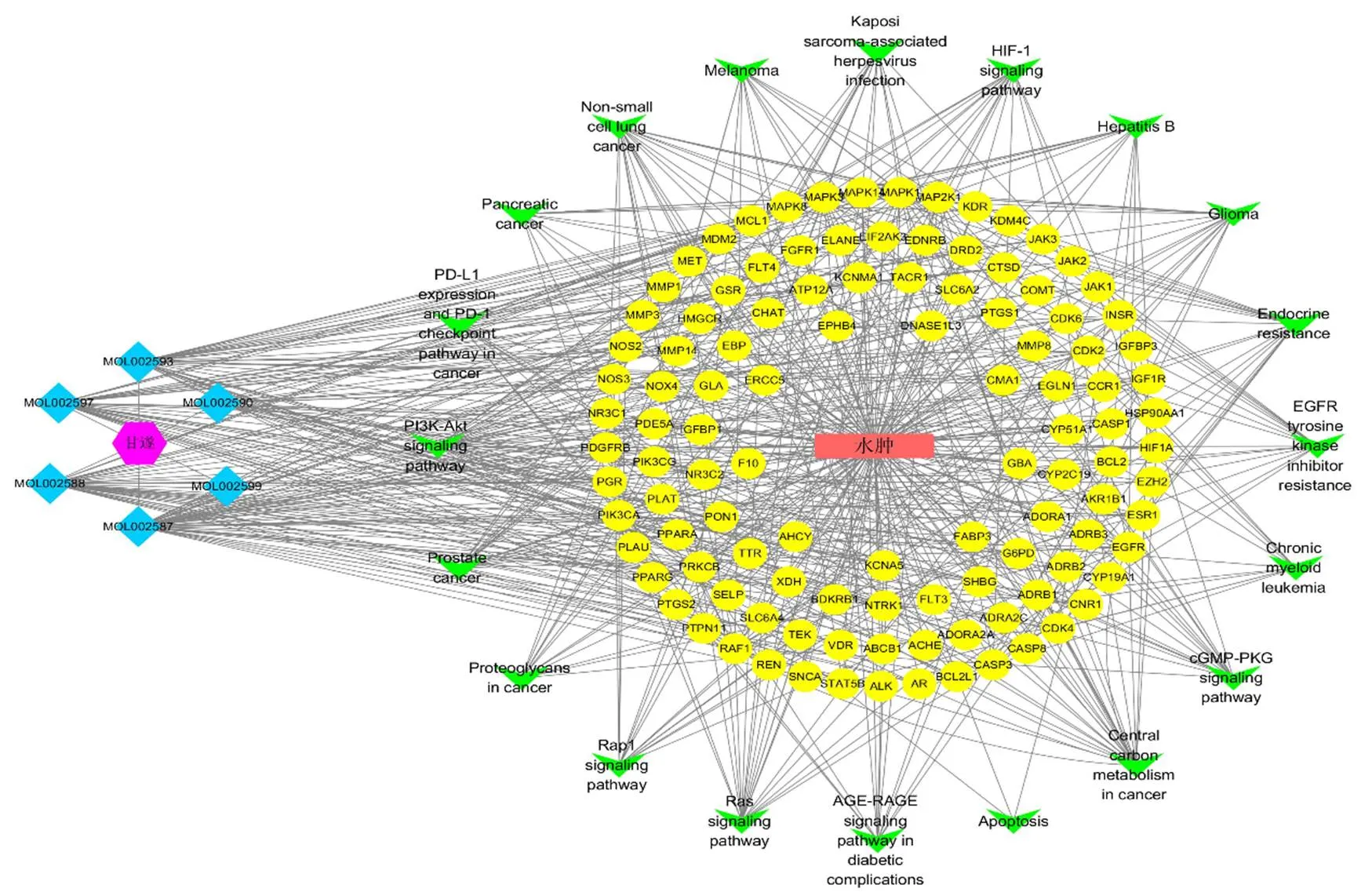
紫色为中药,蓝色为化合物,黄色为中药作用于疾病的靶点,绿色为最显著的前20条通路,红色为疾病
3.7 实验验证
3.7.1 TLR4/NF-κB/NLRP3信号通路相关蛋白表达 如图7-A~D所示,与对照组比较,模型组小鼠小肠组织TLR4、NLRP3和p-NF-κB p65/NF-κB p65蛋白表达水平均显著升高(<0.01);与模型组比较,各给药组小肠组织TLR4、NLRP3和p-NF-κB p65/NF-κB p65蛋白表达水平均显著降低(<0.01),说明甘遂生品及各个炮制品均可不同程度地抑制TLR4/NF-κB/NLRP3信号通路。
3.7.2 PI3K/Akt信号通路相关蛋白表达 如图7-E~G所示,与对照组比较,模型组小鼠小肠组织p-PI3K/PI3K和p-Akt/Akt蛋白表达水平均显著降低(<0.01);与模型组比较,呋塞米组、甘遂高剂量组、醋甘遂各剂量组及甘草制甘遂高剂量组小肠组织p-PI3K/PI3K和p-Akt/Akt蛋白表达水平均显著升高(<0.01),说明甘遂生品及各个炮制品均可不同程度地抑制PI3K/Akt信号通路。
4 讨论
根据中医药的基本理论,甘遂为泻水逐饮的要药,且治疗水肿具有明显的疗效。但目前关于甘遂泻水逐饮的机制尚不清楚。本研究通过网络药理学进行系统研究,旨在探索甘遂泻水逐饮的作用机制,并通过体内水负荷实验对甘遂不同炮制品的泻水逐饮作用机制进行验证。通过TCMSP数据库共筛选出甘遂泻水逐饮的活性成分主要有千金子素(euphorbetin)、(3,5,10,13,14,17)-17-[(1)-1,5- dimethyl-4-methylenehexyl]-4,4,10,13,14-pentamethyl- 2,3,5,6,7,11,12,15,16,17-decahydro-1-cyclopenta[a] phenanthren-3-ol、甘遂萜酯A(kansuinin A)、大戟二烯醇(euphol)、多根乌头碱(karacolidine)和甘遂醇(kanziol)。千金子素会导致肠道脂褐素和活性氧的堆积,从而引起肠道毒性[15]。甘遂萜酯A在体内外均具有抗肿瘤的作用[16]。大戟二烯醇作为一种四环三萜,可诱导胶质母细胞瘤细胞自噬,对肠上皮细胞具有一定的细胞毒性,是甘遂中既具有抗癌作用又具有细胞毒性的毒效活性成分[17]。
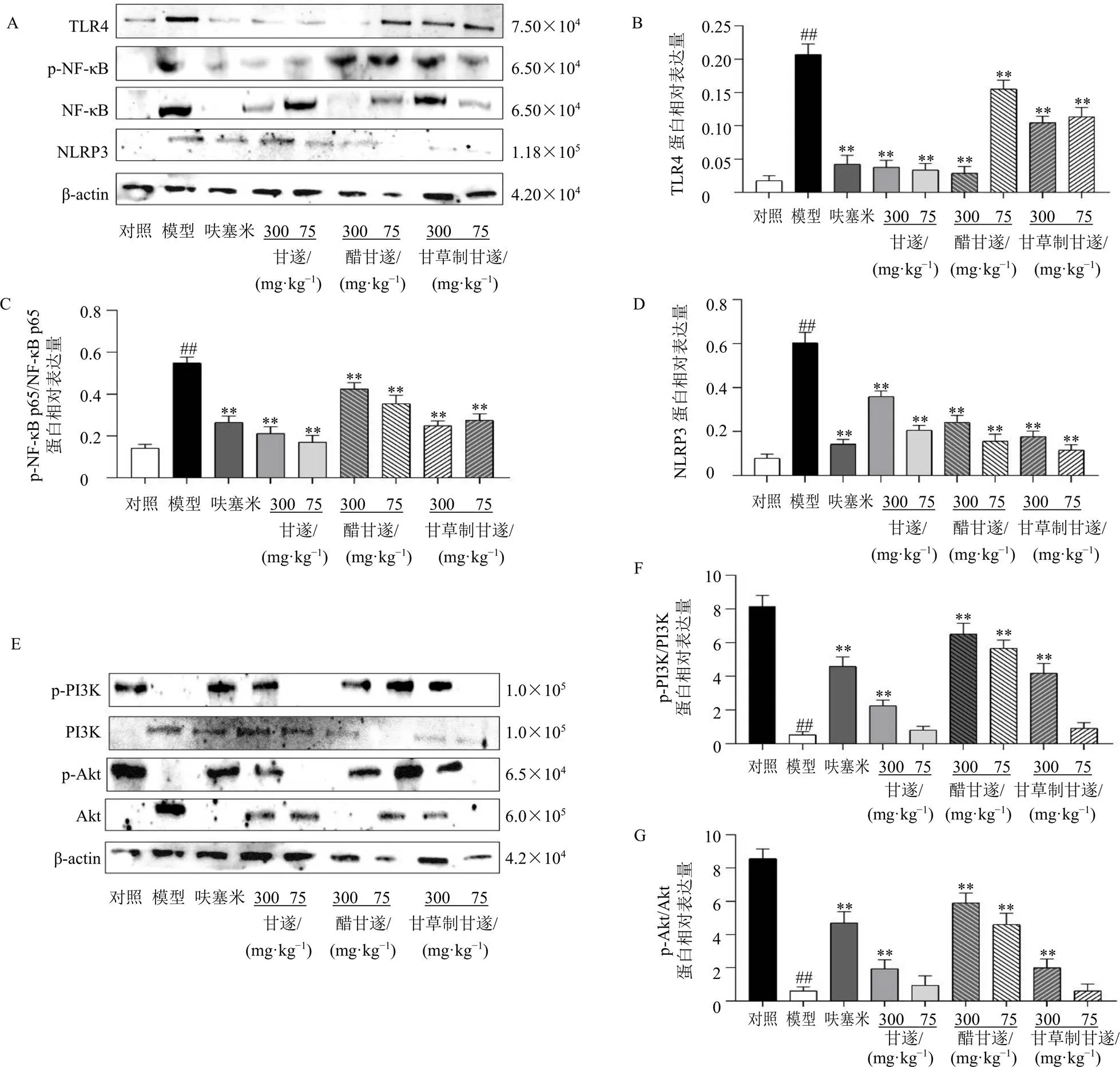
与对照组比较:##P<0.01;与模型组比较:**P<0.01
根据GO功能富集分析显示,关键靶点关联的生物学过程有氧化应激反应、MAPK活性的调节、细胞的化学应激反应、生殖结构发育。根据KEGG通路富集分析显示,甘遂中的活性成分主要作用于PI3K/Akt信号通路、癌症信号通路、RAS信号通路、RAP1信号通路以及HIF信号通路。以上通路都和炎症反应相关,研究表明,PI3K/Akt信号通路是产生水肿的重要通路,并且与炎症反应密切相关[18-19]。PI3K/Akt信号通路的核心成分为PI3K和Akt蛋白,PI3K蛋白由1个催化亚基和1个调节亚基构成。Akt蛋白是一类PH结构域的丝氨酸/苏氨酸激酶,在细胞未受信号刺激时,游离于细胞质。因此推测甘遂的活性成分可能通过PI3K/Akt/NLRP3/NF-κB或者直接影响NLRP3炎性小体信号通路介导炎症,下调Caspase-1蛋白,抑制IL-1β前体成为IL-1β。
本研究结果显示,对照组水负荷差值6 h内并无明显变化,而甘遂高、中剂量组及醋甘遂高、中剂量组和甘草制甘遂高、中剂量组水负荷差值均有明显上升的趋势,而甘遂低剂量组、醋甘遂低剂量组以及甘草制甘遂低剂量组水负荷差值在1~2 h有明显的上升的趋势,而在2~4 h水负荷差值则趋于平缓,但在6 h内,甘遂低剂量组、醋甘遂低剂量组以及甘草制甘遂低剂量水负荷差值总体仍为上升的趋势。1~6 h,甘遂的利尿作用最强,醋甘遂和甘草制甘遂的利尿作用均有缓解,而醋甘遂和甘草制甘遂相比并无显著差异。
IL-1β和IL-18属于促炎因子,IL-4和IL-10属于抗炎因子。IL-1β和IL-18的释放与NLRP3炎性小体的激活息息相关[20]。NLRP3炎性小体是一种大分子蛋白质混合体。IL-1β和IL-18的释放有2种途径激发,一种是由NF-κB等上游蛋白激发NLRP3炎性小体,从而促进IL-1β和IL-18的释放;另一种直接触发NLRP3炎性小体,导致Casepase-1的活化,而将IL-1β和IL-18前体进行切割,最终产生IL-1β和IL-18。IL-4和IL-10主要是由Th2细胞分泌而来,且能促进Th2细胞的分化[21]。IL-4可以诱导B细胞转换成免疫球蛋白E(immunoglobulin E,IgE),并且上调主要组织相容性复合体(major histocompatibility complex,MHC)II类的产生。IL-10可以通过活化的巨噬细胞来抑制炎性因子的产生[22]。机体小肠发生氧化应激反应时,氧化最终产物为MDA,会引起蛋白质交联聚合并具有细胞毒性。MDA可以反映机体小肠的过氧化的程度,间接反映细胞损伤的程度[23-24]。GSH是机体主要的抗氧化巯基物质,这2个指标能够反映机体小肠组织的氧化还原状态[25-26]。
体内实验表明甘遂的不同炮制品对水负荷小鼠均有较强的利尿作用,甘遂泻下作用最强。ICR小鼠短时间ig大量生理盐水可引起小肠的局部水肿并促进炎症因子的表达,因而进一步验证甘遂泻水逐饮的作用与炎症反应的相关性。结果显示,甘遂的不同炮制品中,甘遂生品组炎性因子表达高于其他炮制品,而甘遂醋制品与甘草制品的炎性因子表达并无显著差异,甘遂及其炮制品均显著抑制TLR4/NF-κB/NLRP3和PI3K/Akt通路相关蛋白的表达,说明甘遂通过醋制及甘草制均会抑制炎性蛋白信号通路进而减少其炎性因子的表达(图8)。

图8 甘遂不同炮制品通过抑制TLR4通道介导的NF-κB/NLRP3及PI3K/Akt信号通路从而抑制炎性因子表达
综上所述,甘遂及其炮制品对水负荷小鼠均可以不同程度地抗水负荷并产生利尿作用,并可以通过抑制TLR4通道介导NF-κB/NLRP3信号通路及PI3K/Akt信号通路从而抑制炎性因子的表达。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘倩, 韦衡秋, 彭柳莹. 甘遂泻水散结作用的研究进展 [J]. 中外医学研究, 2019, 17(9): 184-186.
[2] 程显隆, 肖新月, 邹秦文, 等. 生甘遂及其炮制品中2种三萜成分的含量研究 [J]. 中国药事, 2010, 24(6): 550-552.
[3] 何美菁. 醋甘遂炮制工艺与醋制减毒增效相关性的研究 [D]. 太原: 山西中医药大学, 2019.
[4] 沈俊美, 陈春梅, 靳其珍, 等. 甘遂历代炮制方法初考 [J]. 时珍国医国药, 2000, 11(10): 894-895.
[5] Zhang X Y, Su X J, Ning C X,. Investigation of the processing technology and mechanism ofby licorice based on response surface methodology and integrative pharmacology [J]., 2021, 6(3): 22.
[6] Meng X L, Liang Y L, Lyu C Z,. Effects of processing technology on essential oil and pharmacological action of frankincense [J]., 2021, 6(3): 23.
[7] 李慧玉, 雷帆, 王玉刚, 等. 甘遂对水负荷小鼠排尿以及肾脏,,mRNA表达的影响 [J]. 中国中药杂志, 2012, 37(5): 606-610.
[8] 孙文学, 盛云华, 黄坚, 等. 商陆利尿作用与肾毒性研究进展[J]. 世界中医药, 2020, 15(23): 3586-3592.
[9] 张蒙, 甘华田. PI3K/AKT信号传导通路与肠道炎症 [J]. 华西医学, 2006, 21(1): 192-193.
[10] 刘旭丹. RES通过TLR4与PI3K/Akt信号通路发挥抗IL-1β诱导的骨关节炎作用的体外实验研究 [D]. 沈阳: 中国医科大学, 2018.
[11] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[12] Ru J L, Li P, Wang J N,. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines [J]., 2014, 6: 13.
[13] 中国药典 [S]. 一部, 2020: 89-90.
[14] 陈奇. 中药药理研究方法学 [M]. 第2版. 北京: 人民卫生出版社, 2006: 1262-1264.
[15] Zhu A, Ji Z H, Zhao J W,. Effect offactor L1 on intestinal barrier impairment and defecation dysfunction in[J]., 2019, 65: 153102.
[16] 马红. 甘遂抗肿瘤化合物的分离及药效学研究 [D]. 天津: 天津大学, 2016.
[17] Silva V A O, Rosa M N, Miranda-Gonçalves V,. Euphol, a tetracyclic triterpene, frominduces autophagy and sensitizes temozolomide cytotoxicity on glioblastoma cells [J]., 2019, 37(2): 223-237.
[18] Ahmad Shah. PI3K/AKT信号通路在THP-1细胞中对NLRP3炎症小体的调节作用 [D]. 大连: 大连医科大学, 2017.
[19] He D, Wang H Y, Xu L,. Saikosaponin-a attenuates oxidized LDL uptake and prompts cholesterol efflux in THP-1 cells [J]., 2016, 67(6): 510-518.
[20] Song L M, Pei L, Yao S L,. NLRP3 inflammasome in neurological diseases, from functions to therapies [J]., 2017, 11: 63.
[21] 王少鑫, 浦江, 刘超群, 等. 炎症因子TNF-α、IL-6和IL-4在溃疡性结肠炎中的表达及临床意义 [J]. 胃肠病学和肝病学杂志, 2015, 24(1): 104-106.
[22] 陈倩, 陈幽兰, 戴彦成, 等. 健脾清肠方对慢性结肠炎IL-10−/−小鼠结肠组织炎症因子水平的影响 [J]. 中国中医药信息杂志, 2021, 28(7): 82-87.
[23] 戴梓茹, 孔艳, 王培, 等. 敲除SOCS1a基因对斑马鱼肝脏氧化应激的影响 [J]. 生物学杂志, 2021, 38(5): 23-27.
[24] Sritawan N, Suwannakot K, Naewla S,. Effect of metformin treatment on memory and hippocampal neurogenesis decline correlated with oxidative stress induced by methotrexate in rats [J]., 2021, 144: 112280.
[25] Wu X H, Li H, Wan Z J,. The combination of ursolic acid and empagliflozin relieves diabetic nephropathy by reducing inflammation, oxidative stress and renal fibrosis [J]., 2021, 144: 112267.
[26] Liu L L, Liu X L, Zhao L Y,. 1, 8-cineole alleviates bisphenol A-induced apoptosis and necroptosis in bursa of Fabricius in chicken through regulating oxidative stress and PI3K/AKT pathway [J].2021, 226:112877.
Diuretic effect and mechanism ofand its prepared products on water-loaded mice through TLR4/NF-κB/NLRP3 and PI3K/Akt signaling pathways
NING Chen-xu1, 2, SU Xiao-juan1, 2, REN Ke-le1, 2, LIU Xiao-qin1, 2, MENG Xiang-long1, 2, ZHAO Cai-rong1, 2, ZHAO Hong-yu1, 2, WANG Juan1, 2, ZHANG Shuo-sheng1, 2
1. College of Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong 030619, China 2. Key Laboratory of Chinese Medicine Processing in Shanxi Province, Shanxi University of Chinese Medicine, Jinzhong 030619, China
To study the diuretic effect and mechanism of Gansui () and its prepared products on water-loaded mice.Diuretic effects ofwas explored by network pharmacology. After ICR mice were givenand its processed products, a large amount of normal saline was used to establish a water load model, water load difference and organ index were measured; Duodenum and jejunum were taken to observe the pathological changes; ELISA method was used to measure levels of inflammatory factor indicators interleukin-1β (IL-1β), IL-18, IL-4, IL-10 in serum and oxidative stress indicators malondialdehyde (MDA) and glutathione (GSH) in small intestinal tissue; Western blotting was used to measure protein expressions of Toll-like receptor 4 (TLR4), nuclear factor-κB (NF-κB), NOD-like receptor protein 3 (NLRP3), phosphatidylinositol-3-kinase (PI3K) and protein kinase B (Akt) in small intestinal tissue.and its processed products mainly regulated edema by participating in oxidative stress response and PI3K/Akt and other signaling pathways through the construction of “traditional Chinese medicine-ingredient-disease-pathway-target” network and pathway enrichment analysis. The results ofexperiments showed that compared with model group, water load difference of mice in each administration group was significantly increased at each time period (< 0.01); Levels of IL-1β, IL-18 in serum and MDA in small intestinal tissue were significantly decreased (< 0.05, 0.01), levels of IL-4, IL-10 in serum and GSH in small intestinal tissue were significantly increased (< 0.05, 0.01); TLR4, NLRP3, p-NF-κB/NF-κB, p-PI3K/PI3K and p-Akt/Akt protein expressions in small intestinal tissue were significantly decreased (< 0.01). In each administration group, diuretic effect ofwas the strongest at 1—6 h, and diuretic effect of vinegarandetprocessedwere relieved, indicating that processedwould ease its irritation and balance its diuretic effect.and its prepared products can resist water load to different degrees and produce diuretic effect on water-loaded mice, and inhibit IL-1β and IL-18 expressions through NF-κB/NLRP3 signaling pathway and PI3K/Akt signaling pathway mediated by TLR4 channel.
;etprocessed; vinegar; water-loaded model; inflammatory cytokines; phosphatidylinositol-3-kinase/protein kinase B signaling pathway; NOD-like receptor protein 3
R285.5
A
0253 - 2670(2022)13 - 4007 - 12
10.7501/j.issn.0253-2670.2022.13.014
2021-12-30
山西应用基础研究计划面上自然科学基金资助项目(201901D111342);山西省中医药大学中药炮制学科建设项目(2018-1);山西省中医药大学中药炮制与方药配伍研究科技创新团队(2018TD-006)
宁晨旭,硕士研究生,研究方向为中药炮制现代研究。E-mail: sunshine213112@163.com
张朔生,教授,博士生导师,研究方向为中药炮制现代研究。E-mail: zhangshuosheng@aliyun.com
[责任编辑 李亚楠]
