巴西海木提取物抗生殖系统氧化损伤活性研究
2022-07-04常馨月米晓董明然王同瑾胡美赓沈俊宇路娟陈曦中国医学科学院北京协和医学院药用植物研究所北京0093FITOTERAPIABIOTECHLTDA公司巴西0040000
常馨月,米晓,董明然,王同瑾,胡美赓,沈俊宇,路娟*,陈曦*(.中国医学科学院 北京协和医学院 药用植物研究所,北京 0093;.FITOTERAPIA BIOTECH LTDA公司,巴西 0040-000)
多项研究强调了诱发精子质量下降和睾丸功能损伤的因素,其中环境诱因和生活方式对男性生殖健康产生了较大影响[1-3]。邻苯二甲酸二(2-乙基己基)酯(DEHP)是应用最广泛的增塑剂之一,可通过饮水、饮食、皮肤接触(化妆品)和呼吸进入人体,具有雌激素样作用,影响生物体内激素的正常分泌,对人体健康造成不同程度的危害[4-5]。
楝科植物巴西海木(Trichilia catiguaA.Juss.)是主产于南美洲的一种小型灌木,作为巴西传统药物常用于缓解疲劳、压力和壮阳。以巴西海木为原料的保健品“Catuama”在巴西商业化应用已有20余年的历史[6]。现代药理研究表明巴西海木具有显著的抗炎、抗菌[7-9]及抗氧化作用[10-14]:巴西海木的乙酸乙酯组分可有效抑制鱼藤酮引发的神经细胞SH-SY5Y氧化损伤;抑制缺血再灌注引起的氧化损伤等,且在健康的人类志愿者中没有出现毒副作用[15]。研究表明,巴西海木树皮的醇提物中含有绿原酸、原花青素B2、花青素C1、表儿茶素、儿茶素、黄烷-3醇、β-谷甾醇、豆甾醇和莰烯醇等化合物[16-18],其中黄酮类化合物和酚类也被认为是其抗氧化活性的基础[19]。巴西海木在民间医学中广泛用于治疗阳痿等生殖系统疾病,而目前现代药理学研究主要集中在神经系统的抗氧化作用,生殖系统相关作用及机制报道较少,故本研究以生殖系统为切入点进行研究。本研究利用H2O2致TM4细胞氧化损伤模型初步筛选出巴西海木对于细胞氧化损伤具有保护作用的提取物;建立DEHP致雄性小鼠生殖系统氧化损伤模型,进一步对筛选出的提取物进行药效评价;通过qRT-PCR研究相关基因的表达情况,初步探究其生殖系统保护作用机制,为巴西海木的开发利用提供依据。
1 材料
1.1 仪器
AB265-S 电子分析天平(瑞士 METTLER TOLEDO公司),Infinite M1000 多功能连续波长酶标仪(瑞士 TECAN公司),B25-12DT 型超声波清洗器(宁波新芝生物科技股份有限公司),SC-3610 低速离心机(安徽中科中佳科学仪器有限公司),MCO-15AC二氧化碳培养箱(三洋电机株式会社),IX51 型荧光倒置显微镜(日本OLYMPUS公司),NanoDrop 2000 分光光度计(美国Thermo Fisher Scientific公司),LightCycler 480 实时系统(瑞士 Roche公司)。
1.2 试药
巴西海木树皮由FITOTERAPIA BIOTECH LTDA 公司于巴西东北巴伊亚州采集得到。由中国医学科学院药用植物研究所云南分所李海涛研究员鉴定为楝科巴西海木(Trichilia catiguaA.Juss.)的树皮。
30%过氧化氢溶液(北京化工厂),胎牛血清(FBS,德国 PAN Seratech公司),Cell counting kit-8(CCK-8,日本 DOJINDO/同仁化学),无水乙醇、石油醚、乙酸乙酯、正丁醇(分析纯,天津北联精细化学品开发有限公司),水溶性维生素E(VE,Trolox)、磷酸盐缓冲液(PBS)、二甲基亚砜(DMSO)、马血清(HS)(索莱宝生物科技有限公司),Trypsin-EDTA(0.25%)、DMEM/F12培养基(上海英潍捷基贸易有限公司),总蛋白定量测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒、丙二醛(MDA)测定试剂盒(南京建成科技有限公司),兔抗Nrf2(bs-1074R)、SOD2(bs-20667R)、SOD3抗体(bs-3895R)(Bioss),RNAiso Plus(9108-9109)、Prime Script RT Master Mix(RR036A)、TB Green Premix Ex Taq(RR82WR)(日本 TaKaRa BIO株式会社)。
1.3 细胞培养
TM4小鼠睾丸支持细胞(北京协和细胞资源中心),采用含5%HS+2.5%FBS的DMEM/F12 培养基,在37℃含5%CO2的培养箱中培养。每日换液,细胞生长到对数生长期时,传代(比例为1∶6)并开展实验,实验用细胞控制在10代以内。
1.4 实验动物
健康雄性SPF级ICR小鼠(18~22 g),由北京华阜康生物科学有限公司提供,实验动物许可证号:SLXD-20210507012。动物实验均经中国医学科学院药用植物研究研究所动物伦理委员会批准,并按照美国国立卫生研究院的指南进行。饲养条件:温度(23±2)℃,相对湿度(55±5)%,光暗周期同昼夜周期,所有小鼠正式实验前均适应性喂养一周。
2 方法与结果
2.1 巴西海木提取物的制备[20-21]
2.1.1 巴西海木提取物制备方法 取巴西海木树皮粉末100 g各4份,以料液比=1∶10分别加入蒸馏水,50%、70%、95%乙醇溶液1000 mL,充分搅拌后冷浸两次,每次24 h,过滤,合并两次浸出液,旋蒸浓缩后60℃下烘干。取50%粗提物、70%粗提物以及95%粗提物干燥粉末各5 g,加300 mL蒸馏水震荡使其均匀分散在水溶液中,依次用石油醚、乙酸乙酯、正丁醇进行萃取,收集得到相应萃取液组分后再次进行旋蒸烘干。巴西海木树皮粉末13种提取物代号见表1。
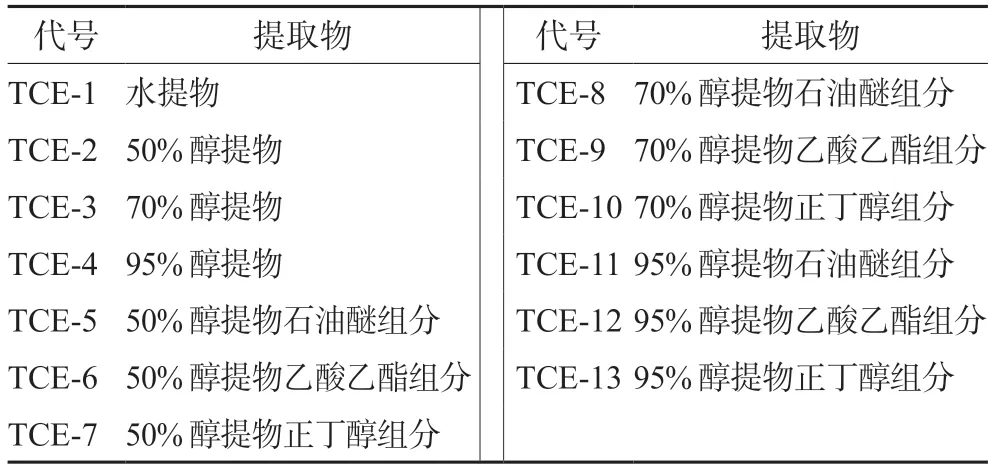
表1 巴西海木树皮13种提取物对应代号 Tab 1 Corresponding codes of 13 extracts from bark of Trichilia catigua A.Juss.
2.1.2 巴西海木提取物制备结果 使用水及50%、70%及95%乙醇溶液粗提得到4种巴西海木粗提物(TCE-1~TCE-4);不同浓度醇提物经石油醚、乙酸乙酯及正丁醇依次萃取得到9种组分(TCE-5~TCE-13),共13种提取物。称定干燥,以生药量计算各提取物得率,结果见表2。
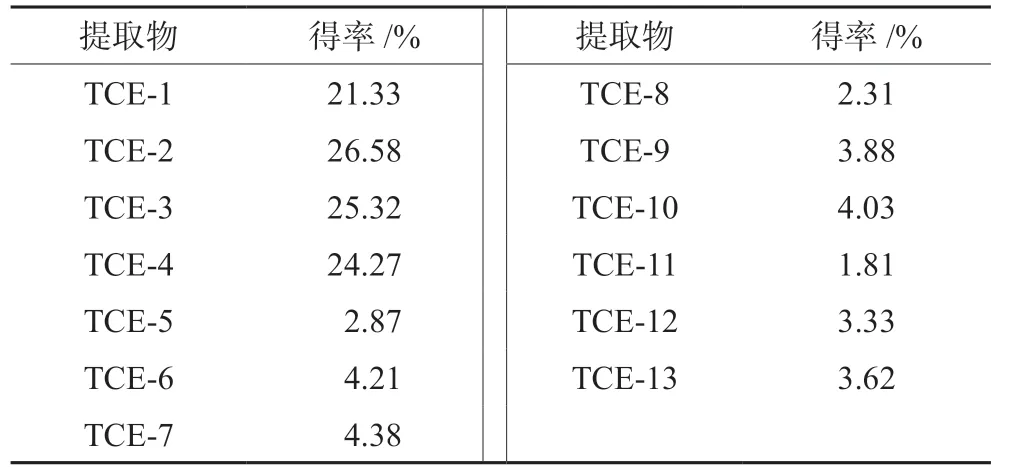
表2 巴西海木13种提取物得率 Tab 2 Yield of 13 extracts from Trichilia catigua A.Juss.
2.2 巴西海木提取物对TM4细胞增殖率的影响
2.2.1 方法 使用DMSO分别溶解13种提取物配制成160 μg·mL-1的含药溶液,使用完全培养基逐级稀释,分别得到质量浓度为160、80、40、20、10、5 μg·mL-1的溶液。取对数生长期的TM4细胞悬液100 μL(1×105个·mL-1)接种于96孔板,培养24 h,细胞生长至80%融合时吸去原有培养基,给药组加入不同质量浓度待测含药溶液各100 μL,对照组加入完全培养基100 μL,继续孵育24 h。24 h后吸去原有培养基,加入100 μL 10%CCK-8稀释液,反应1 h后,450 nm波长处测定OD值,计算细胞增殖率。
细胞增殖率(%)=(测定组OD值-空白组OD值)/(对照组OD值-空白组OD值)× 100%-1。
2.2.2 结果 由图1可知,TCE-4、TCE-5、TCE-7、TCE-8、TCE-10、TCE-11、TCE-13可降低细胞增殖率,对TM4细胞有明显杀伤作用,故不进行后续药效评价。给予5~160 μg·mL-1TCE-1、TCE-2、TCE-3、TCE-6、TCE-9、TCE-12后TM4细胞增殖,可用于后续抗氧化损伤药效实验。

图1 不同提取物对细胞增殖率的影响(±s,n=6)Fig 1 Effect of different extracts on the cell proliferation rate(±s,n=6)
2.3 过氧化氢损伤条件的确定[22]
2.3.1 方法 取30%H2O2溶液18 μL加至10 mL基础培养基中配制成18 000 μmol·L-1的H2O2母液,分别精密移取1000、833、667、500、333、167、56 μL H2O2溶液后加基础培养基稀释至10 mL,得到1800、1500、1200、900、600、300、100 μmol·L-1H2O2溶液。按照“2.2”项下方法将细胞接种培养24 h后弃去上清培养基,加入终浓度为100、300、600、900、1200、1500、1800 μmol·L-1H2O2各200 μL分别作用2 h、4 h后,测定OD值,计算细胞存活率。倒置显微镜下观察细胞形态、细胞数量的变化,确定细胞存活率降至50%~60%的H2O2浓度及作用时间。细胞存活率按下式计算:
细胞存活率(%)=(测定组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
2.3.2 结果 由图2可知,H2O2对于细胞的损伤程度随着H2O2浓度的升高和损伤时间的延长而增强。在600 μmol·L-1的浓度下作用2 h和4 h后,TM4细胞存活率均为50%~60%,故确定H2O2损伤TM4条件为600 μmol·L-1H2O2损伤2 h。图3显示该损伤条件下TM4细胞形态发生明显变化,细胞板上黏着减少,细胞数量减少约33%。

图2 不同浓度H2O2分别作用2 h、4 h后细胞存活情况(±s,n=3)Fig 2 Cell viability after treatment with different concentrations of H2O2 for 2 h and 4 h(±s,n=3)

图3 600 μmol·L-1 H2O2损伤2 h后(A)及空白对照组(B)的细胞形态(×20)Fig 3 Cell morphology of the group after 600 μmol·L-1 H2O2 injury for 2 h(A)and blank control group(B)(×20)
2.4 巴西海木提取物对氧化损伤TM4细胞存活率的影响
2.4.1 方法 细胞分为空白对照组,模型组,阳性药组(VE组),水提物组,给药组(TCE-1、TCE-2、TCE-3、TCE-6、TCE-9、TCE-12),其中VE组给药浓度为20 μg·mL-1[23],各给药组给药浓度分别为20、40、80 μg·mL-1。按照“2.2.1”项下方法接种细胞培养24 h,除对照组外,其余各组吸去原有培养基并用PBS冲洗后加入200 μL 600 μmol·L-1的H2O2损伤2 h。2 h后弃去上清并用PBS冲洗残余H2O2溶液,给药组加入含药培养基,阳性药组加入VE溶液,模型组及对照组加入基础培养基继续培养,24 h后按照“2.2.1”项下方法测定OD值,按“2.3.1”项下公式计算各组细胞存活率。
2.4.2 结果 如图4所示,给予600 μmol·L-1H2O2损伤2 h后,与空白对照组相比,模型组细胞存活率降低约50%;与模型组相比,给药组细胞存活率均有一定提高。TCE-1、TCE-2、TCE-3、TCE-6、TCE-9、TCE-12均有一定的抗氧化损伤作用,给予80 μg·mL-1TCE-2、TCE-6、TCE-9可显著提高TM4细胞存活率(P<0.01),明显抑制H2O2诱导的TM4细胞存活率降低的损伤情况。后续对这3个提取物进行研究。

图4 不同组别TM4细胞存活率变化(±s,n=3)Fig 4 Changes of the viability of TM4 cells in each group(± s,n=3)
2.5 TM4细胞氧化指标变化
2.5.1 方法 细胞分为对照组,模型组,VE组,给药组(TCE-2、TCE-6、TCE-9)。其中VE组给药浓度为20 μg·mL-1,给药组给药浓度为80 μg·mL-1,按照“2.4.1”项下方法损伤细胞并给药。给药24 h后去除含药培养基,PBS洗涤细胞后,收集细胞,加入细胞裂解液,冰上裂解30 min,4℃、12 000 r·min-1离心15 min,收集上清液,BCA法测定蛋白浓度,按照试剂盒检测 SOD、MDA和GSH-Px的含量,计算公式如下:
SOD抑制率(%)=[(OD对照组-OD对照空白组)- (OD测定组-OD测定空白组)]/(OD对照组-OD空白组)×100%。
SOD活力(U·mgprot-1)=SOD抑制率/50%×反应体系/稀释倍数/待测样本蛋白含量
MDA(nmol·mgprot-1)=(OD测定组-OD空白组)/(OD标准组-OD空白组)×标准品浓度/样本蛋白含量
GSH-Px酶活力(U·mgprot-1)=(OD非酶管-OD酶管)/(OD标准管-OD空白管)×标准浓度×稀释倍数/反应时间/取样量/蛋白含量
2.5.2 结果 如图5所示,与空白对照组比,模型组SOD和GSH-Px的活力显著降低,MDA含量升高(P<0.01);与模型组比,80 μg·mL-1TCE-9可显著提高GSH-Px的活力(P<0.01),80 μg·mL-1TCE-6可显著提高SOD和GSH-Px的活力,降低MDA含量(P<0.01)。表明TCE-6可显著抑制H2O2造成TM4细胞氧化损伤,可进一步进行体内药效实验。

图5 各组SOD活力、MDA含量、GSH-Px活力的变化(±s,n=6)Fig 5 Changes of SOD activity,MDA content and GSH-Px activity in each group(±s,n=6)
2.6 小鼠睾丸组织氧化指标变化
2.6.1 方法 小鼠随机分为对照组,赋形剂组,模型组,左卡尼汀组,VE组及TCE-6低、中、高剂量给药组(L-TCE-6、M-TCE-6和H-TCE-6),每组12只。除对照组及赋形剂组外,各组给予2.5 mg·kg-1DEHP灌胃7 d制备雄性小鼠氧化损伤模型。DEHP灌胃结束后,对照组给予蒸馏水,赋形剂组给予玉米油,左卡尼汀组给予500 mg·kg-1左卡尼汀,VE组给予100 mg·kg-1VE,TCE-6低、中、高剂量给药组(L-TCE-6、M-TCE-6和H-TCE-6)分别给予300、600、900 mg·kg-1TCE-6,连续灌胃给药28 d。末次给药后,禁食过夜。第29日处死小鼠后完整地取出睾丸样本,剥去周围的脂肪和结缔组织。按照检测试剂盒说明书要求,分别检测各组睾丸组织中 SOD、GSH-Px活力及MDA含量。
2.6.2 结果 如图6所示,与对照组相比,DEHP睾丸组织匀浆中SOD、GSH-Px活力显著降低,MDA含量显著升高(P<0.01);与模型组相比,给予M-TCE-6组SOD、GSH-Px活力显著升高(P<0.05);H-TCE-6组SOD、GSH-Px活力显著升高,MDA含量显著降低(P<0.05)。结果表明TCE-6可通过降低MDA含量,提高SOD和GSH-Px活力起到抗氧化损伤作用。

图6 各组SOD活力、MDA含量、GSH-Px活力变化(±s,n=12)Fig 6 Changes of SOD activity,MDA content and GSH-Px activity in each group(±s,n=12)
2.7 氧化相关基因相对表达量的测定
2.7.1 方法 于冰上取“2.6.1”项下收集的睾丸组织样本,根据RNAiso Plus试剂盒说明提取总RNA,测定总RNA的浓度和纯度,然后反转录为cDNA。合成的cDNA进行qRT-PCR分析。采用LightCycler 480 实时系统进行聚合酶链反应并测量mRNA的相对表达量。反应条件 95℃ 30 s,随即40个循环聚合酶链反应,循环温度方案:95℃ 5 s,55℃ 30 s,72℃ 30 s。循环结束后,95℃温育5 s,60℃温育1 min,之后保持95℃。以Gapdh作为内参基因、氧化相关基因Nrf2、SOD2、SOD3的引物序列见表3。
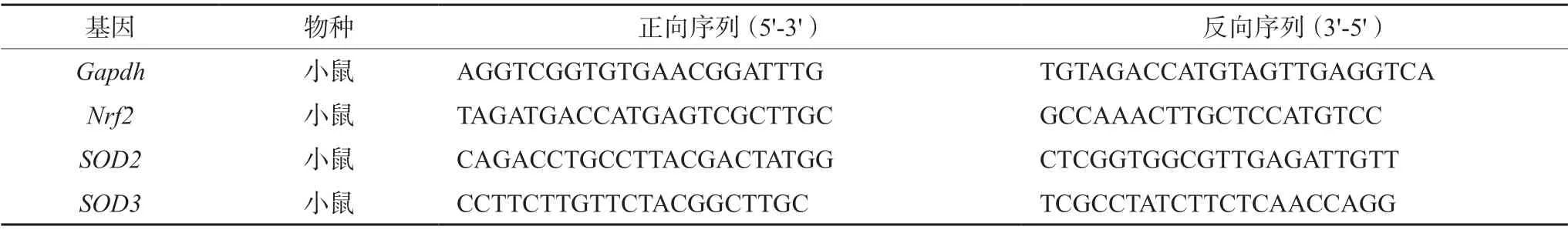
表3 qRT-PCR分析基因引物序列 Tab 3 Primers analyzed by qRT-PCR
2.7.2 结果 通过qRT-PCR检测3个关键氧化相关基因表达水平(见图7)。与对照组相比,DEHP诱导后Nrf2、SOD2及SOD3mRNA相对表达水平显著下降(P<0.01);与模型组比较,给予600、900 mg·kg-1TCE-6可显著上调Nrf2、SOD2及SOD3mRNA相对表达水平(P<0.05);300 mg·kg-1TCE-6可显著上调Nrf2和SOD2mRNA相对表达水平(P<0.05)。结果提示,TCE-6可能通过调节Nrf2、SOD2及SOD3mRNA的表达发挥抗生殖系统氧化损伤活性。

图7 TCE-6对氧化相关基因的相对表达量的影响(±s,n=12)Fig 7 Effect of TCE-6 on the relative expression of oxidation-related genes(±s,n=12)
2.8 数据处理
实验数据采用 SPSS 25.0版统计软件进行处理,计量资料以均值±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05作为差异具有统计学意义。所有数据作图均由 GraphPad Prism 6.0 软件生成。
3 讨论
3.1 模型选择依据
H2O2诱导是目前最为常用的细胞氧化损伤造模方式。H2O2易穿透细胞膜,可与细胞内Fe2+反应产生高毒性的羟自由基,也可通过氧化蛋白质、DNA等产生过量自由基或引发脂质过氧化损伤导致组织损伤和细胞死亡[24-25]。TM4细胞是位于生精小管内的一种细胞,为生殖细胞提供生存和减数分裂过程中所需的营养,维持TM4细胞的稳态对于精子的发生及正常功能有着至关重要的作用。因此药物对TM4细胞所产生的作用,可直接反映该药作用于生殖系统的效果,TM4细胞存活率变化对于巴西海木药效部分的筛选具有重要意义。故本实验采用H2O2诱导TM4细胞氧化损伤模型筛选巴西海木提取物。经研究表明,TCE-6可以显著提高H2O2损伤后的细胞存活率以及SOD、GSH-Px活力;显著降低MDA含量,故筛选出TCE-6进行后续动物模型药效评价。
多项研究表明,邻苯二甲酸盐可以诱导睾丸组织氧化应激,导致生殖细胞DNA损伤和线粒体功能受损,降低与睾酮合成相关的基因活性,导致睾丸组织功能和精子发育受损[26-28]。DEHP对男性生殖健康具有较强的毒性作用,通过干扰生殖内分泌系统,降低精子活力,减少精子数量,导致睾丸等实质器官萎缩和形态异常[4-5,29],引发氧化应激是其产生生殖系统毒性的主要机制。基于DEHP的危害及机制,本实验采用DEHP诱导的雄性小鼠生殖损伤模型验证TCE-6的药效活性。
3.2 抗氧化活性研究结果
随着对氧化应激的深入研究,已确定其与许多疾病密切相关,例如各种炎症损伤、中风[30]以及男性不育症[31-32]等。当机体发生氧化应激时,会驱动一系列病理反应,所产生的活性氧类与抗氧化系统失衡。对于生殖系统而言,这种失衡会导致生殖细胞损伤,睾丸能量供应受阻,从而对生殖系统产生实质伤害[33-35]。MDA是脂质过氧化产物,其含量的大小可反映机体内脂质过氧化的程度,间接地反映出细胞和组织损伤的程度[36]。SOD和GSH-Px是抗氧化防御系统的重要组成部分,能够清除机体内过多的MDA,具有保护细胞和组织的作用,其活力的高低间接反映了组织抗氧化应激能力[37]。DEHP诱导后睾丸组织中MDA含量显著提高,GSH-Px和SOD活力显著降低,说明睾丸组织产生脂质过氧化,且不能有效清除活性氧自由基,睾丸组织发生氧化损伤。
目前药理学研究证实巴西海木提取物在神经系统上具有较好的抗氧化损伤活性,对于氧化标志物SOD、MDA以及谷胱甘肽(GSH)、氧化谷胱甘肽(GSSG)、过氧化氢酶(CAT)和蛋白质羰基(PCGs)水平均有改善作用[5-9]。本研究以生殖系统为切入点探究其抗氧化活性,检测了氧化与抗氧化反应的标志物。结果表明900 mg·kg-1TCE-6可通过降低睾丸组织MDA含量,提高SOD和GSH-Px活力,调节睾丸组织抗氧化酶水平,抑制睾丸组织脂质过氧化损伤。
qRT-PCR研究相关基因的活性发现给药后Nrf2、SOD2和SOD3mRNA表达水平显著提高。激活SOD酶活性途径可促进SOD的抗氧化酶的生成,调控氧化物质水平,减少ROS的产生,调节O2-水平[38],从而减少氧化应激损伤,维持组织的正常功能。Nrf2是抗氧化防御过程中主要的调节剂,可调节下游抗氧化酶的表达,维持生物体内氧化/抗氧化水平的平衡,其含量受到上游KELCH样ECH关联蛋白1(Keap1)等信号分子介导的泛素化或者蛋白酶体途径的调节。静息状态下,Nrf2与胞质中的Keap1相结合,处于非活性状态;当机体处于氧化应激状态时,Nrf2与Keap1解偶联后转入核内,与抗氧化反应元件(ARE)结合,激活下游抗氧化蛋白基因的表达,以减少氧化损伤[39-42]。TCE-6可能通过促进睾丸组织内Keap1-Nrf2偶联体解离,增加Nrf2核转位及表达,进而激活下游SOD、GSH-Px等抗氧化酶转录,增强抗氧化损伤能力。
3.3 总结与不足
本研究表明TCE-6具有较好的抗生殖系统氧化损伤活性。通过H2O2损伤TM4细胞模型筛选出TCE-6作为其抗生殖系统氧化损伤的活性部位,通过DEHP损伤雄性小鼠模型验证了该部分体内抗生殖系统损伤活性,并发现该活性可能是通过上调SOD酶家族表达和调节Nrf2信号通路实现的。但由于睾丸组织行使功能的机制复杂多变,由氧化应激介导的细胞凋亡和线粒体能力代谢失衡有可能协同氧化应激共同损伤睾丸组织[43],本研究结果不能完全推论出巴西海木的作用机制。因此,下一步将深入探究巴西海木抗凋亡以及维护线粒体功能等的作用,综合评价其生殖系统的保护作用机制。
