双特异性磷酸酶1在宫颈鳞癌中的表达及作用研究
2022-07-02热孜亚库尔班古力米热乃扎尔古力米热布然江董志红
热孜亚·库尔班,古力米热·乃扎尔,古力米热·布然江,董志红
(新疆医科大学附属肿瘤医院 1门诊部,2妇外三科,3妇科放疗二病区,乌鲁木齐 830011)
近年来,宫颈鳞状细胞癌(简称宫颈鳞癌)发病率呈逐年上升趋势,目前对宫颈鳞癌实施精准治疗的相关研究较少[1]。因此,寻找新的治疗靶标进行有效干预在宫颈鳞癌的精准治疗中具有重要意义。双特异性磷酸酶1(Dual specificity phosphatase 1,DUSP1)作为丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)基因家族的重要成员[2-3],被认为是肿瘤抑制因子和癌症相关炎症的调节器。有研究表明,DUSP1 参与调控多种肿瘤的发生和发展[4-6],但DUSP1 在宫颈鳞癌恶性进展中的生物学功能及分子机制尚不清楚。宫颈鳞癌细胞C33a 和SiHa 常用于体外宫颈鳞癌的机制研究分析[7]。本研究旨在通过临床样本及体外细胞实验,探讨DUSP1 参与宫颈鳞癌的发病机制,以期为宫颈鳞癌的精准治疗提供新的策略。
1 资料与方法
1.1 一般资料收集新疆医科大学附属肿瘤医院妇科2017 年1 月—2019 年5 月收治的73 例Ⅰ-Ⅳ期宫颈鳞癌患者的肿瘤组织、癌旁组织(距癌组织2 cm)及其临床病理资料。患者平均年龄(45.67±9.25)岁。按2018年国际妇产科联盟FIGO 分期标准进行分期,其中≤IB 期28 例,>IIA 期45 例。纳入标准:病理组织活检证实为Ⅰ-Ⅳ期宫颈鳞癌患者。排除标准:(1)患有其他系统恶性肿瘤者;(2)妊娠期或哺乳期妇女;(3)曾接受化疗、免疫治疗或靶向治疗的宫颈鳞癌患者;(4)临床资料缺失者。患者均已签署知情同意书,并通过新疆医科大学附属肿瘤医院医学伦理委员会审批(K-2019066)。
1.2 细胞与试剂人子宫颈鳞癌C33a、SiHa 细胞(中国科学院细胞库)。细胞计数试剂盒-8(Cell count⁃ing kit-8,CCK-8)、BCA 蛋白定量试剂盒(美国Ther⁃mo公司)。兔抗人p38、兔抗人p-p38、兔抗人JNK、兔抗人p-JNK、兔抗人ERK、兔抗人p-ERK(美国Ab⁃cam 公司)。DUSP1 过表达慢病毒(上海吉凯基因公司)。
1.3 方法
1.3.1 细胞培养和慢病毒转染用含10%胎牛血清的DMEM 和RPMI 1640 培养基分别培养人宫颈鳞癌细胞C33a 和SiHa,37°C,静置培养。细胞每3 天进行1次传代,细胞密度维持在70%~80%。取对数生长期的C33a 和SiHa 细胞,用过表达DUSP1 的慢病毒进行转染,设为C33a 实验组和SiHa 实验组;用携带无义序列的慢病毒进行转染,设为C33a 对照组和SiHa 对照组,共4 组。以感染复数(Multiplicity of infection,MOI)=10 的病毒转染,2 μg/mL 嘌呤霉素培养基培养上述细胞,2周后筛选,提取样本总RNA和总蛋白质。
1.3.2 qRT-PCR 检测DUSP1基因表达水平宫颈鳞癌及其癌旁组织低温充分匀浆、胰酶消化,预冷PBS 洗涤,Trizol 试剂提取样本总RNA。采用Prime Script TMRT Ⅱ反转录试剂盒将样本RNA 反转录为cDNA,PCR 引物序列由上海生工生物工程股份有限公司合成。引物序列如下:DUSP1 上游5’-CCCTGAGTAC⁃TAGCGTCCCT-3’;下游5’-GGCCACCCTGATCG⁃TAGAGT-3’,GAPDH 设为内参基因。SYBR Green和实时定量PCR 扩增仪(7500 fast)检测基因表达水平,GAPDH 为内参基因,结果采用相对定量方法RQ=2-ΔΔCt计算,ΔCt=Ct(目的基因)-Ct(内参基因)[8],每个样品设副孔重复3次,取平均值。
1.3.3 宫颈鳞癌细胞增殖、迁移和侵袭实验收集转染后的4组细胞,经胰蛋白酶消化,获得细胞重悬液,按2×103/个孔将100 μL细胞悬液加入各检测孔,实验设置3 个副孔,置于37ºC,5%CO2的培养箱中培养[9]。按梯度时间(0、24、48、72 和96 h)取样,加入10 μL CCK-8 试剂孵育后,450 nm 处检测各孔光密度(OD)值,计算相应细胞数量[10]。将2.5×105个/mL 细胞重悬液置于Transwell 上室中孵育12 h,甲醇固定,结晶紫染色,棉签擦拭小室上层膜,置于倒置显微镜下随机观察5 个小室下层膜细胞数,实验重复3 次。迁移和侵袭实验过程参照文献[11]。
1.3.4 Western blot 检测DUSP1 对MAPK C33a 细胞信号通路的影响分别收集转染后的C33a 实验组和对照组细胞,PBS 洗涤,加入PMSF 及裂解液,置于冰上裂解40 min。12 000 r/min,4°C 离心10 min,取上清。通过Bradford 法对蛋白质进行定量分析,牛血清白蛋白(Bovine serum albumin,BSA)制作蛋白浓度标准曲线。取20 μg 转染后C33a 细胞,SDS 电泳后进行PVDF 转膜,5%脱脂奶粉常温封闭2 h,加入一抗4°C孵育过夜。TBST 洗脱,分别加入一抗兔抗人p38(1∶2 000)、p-p38(1∶1 000)、JNK(1∶1 000)、p-JNK(1∶10 000)、ERK(1∶500)、p-ERK(1∶500)和β-actin(1∶1 500),4℃孵育过夜,加入二抗(1∶5 000 用封闭液稀释)室温孵育1 h,ECL 显色,分析各条带吸光值并进行定量分析。
1.4 统计学分析数据采用SPSS 21.0 统计软件进行分析,计量资料以均数±标准差(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 DUSP1 在宫颈鳞癌及癌旁组织中的表达情况DUSP1 在癌组织中的表达水平(3.16±1.48)显著低于癌旁组织(7.72±2.42),差异具有统计学意义(P<0.01)(图1A)。与C33a对照组(2.27±0.32)比较,C33a实验组(11.45±1.82)中DUSP1 的表达水平显著增高,差异具有统计学意义(P<0.01);与SiHa对照组(2.32±0.28)比较,SiHa 实验组(14.15±2.17)中DUSP1 的表达水平显著增高,差异具有统计学意义(P<0.01)(图1B)。

图1 DUSP1在宫颈鳞癌与癌旁组织中的表达水平
2.2 DUSP1 表达水平与临床病理参数的相关性DUSP1 的表达与患者肿瘤大小、年龄、FIGO 分期、TNM 分期无显著相关(P>0.05);无淋巴结转移患者DUSP1 表达水平高于有淋巴结转移患者,差异有统计学意义(P<0.05),(表1)。
表1 宫颈鳞癌组织中DUSP1表达与患者临床病理参数的关系(±s)
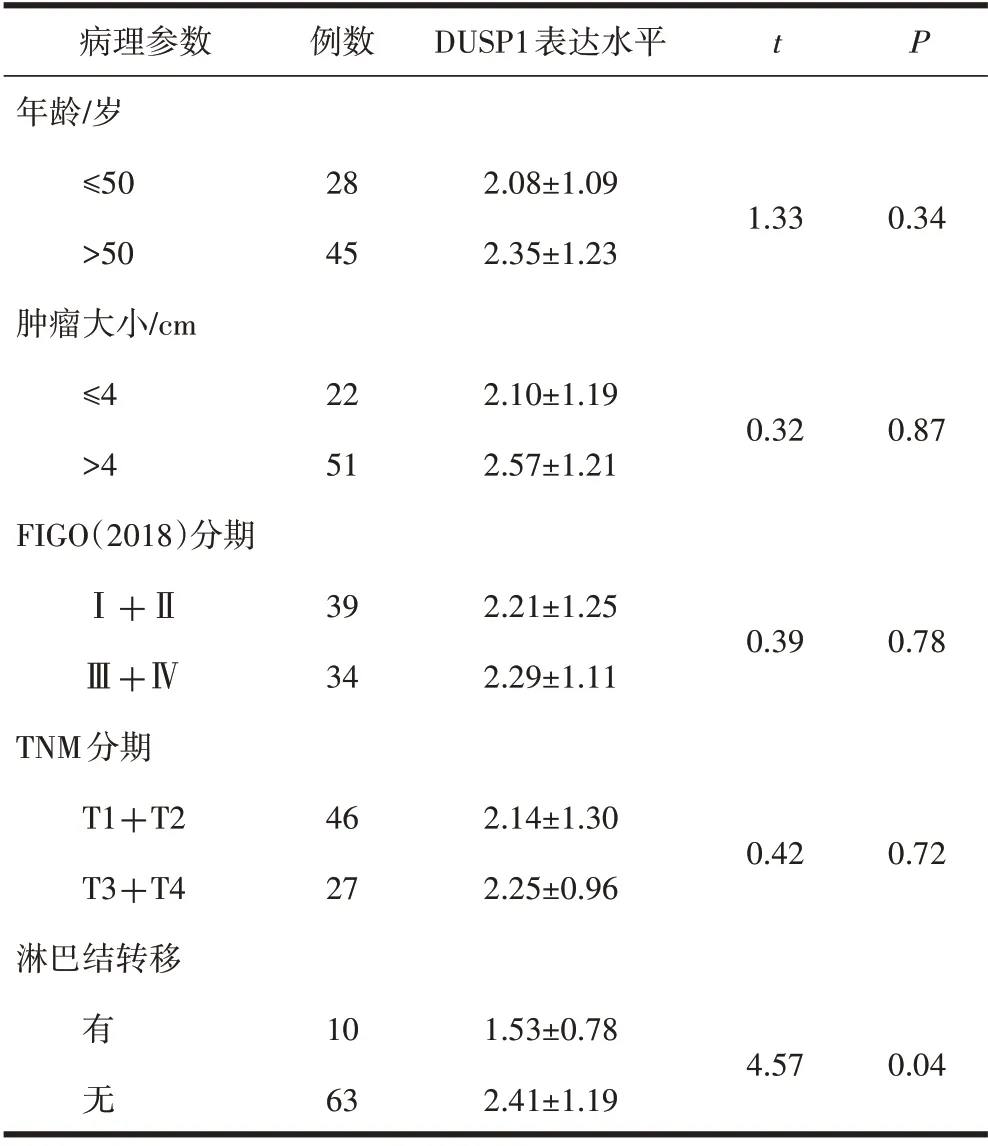
表1 宫颈鳞癌组织中DUSP1表达与患者临床病理参数的关系(±s)
病理参数年龄/岁≤50>50肿瘤大小/cm≤4>4 FIGO(2018)分期Ⅰ+ⅡⅢ+ⅣTNM分期T1+T2 T3+T4淋巴结转移例数DUSP1表达水平t P 28 45 2.08±1.09 2.35±1.23 1.33 0.34 22 51 2.10±1.19 2.57±1.21 0.32 0.87 39 34 2.21±1.25 2.29±1.11 0.39 0.78 46 27 2.14±1.30 2.25±0.96 0.42 0.72有无10 63 1.53±0.78 2.41±1.19 4.57 0.04
2.3 过表达DUSP1 对宫颈鳞癌细胞C33a、SiHa 增殖、迁移及侵袭能力的影响自48 h 起,C33a 实验组和SiHa实验组OD 值与对照组比较显著下降,差异具有统计学意义(P<0.05)(表2)。迁移实验结果显示,C33a 实验组迁移细胞数目(210.34±14.32)个、SiHa 实验组迁移细胞数目(220.00±17.28)个,显著低于C33a对照组(848.74±32.85)个、SiHa 对照组(812.75±21.63)个,差异均具有统计学意义(P<0.01)。侵袭实验结果显示,C33a 实验组侵袭细胞数目(168.30±40.12)个、SiHa 实验组侵袭细胞数目(194.93±22.37)个,显著低于C33a对照组(626.32±4.55)个、SiHa对照组(615.26±10.21)个,差异均具有统计学意义(P<0.01)(图2)。
表2 过表达DUSP1对宫颈鳞癌细胞C33a及SiHa增殖的影响(±s)

表2 过表达DUSP1对宫颈鳞癌细胞C33a及SiHa增殖的影响(±s)
注:与C33a对照组比较,*P<0.05。
时间C33a细胞SiHa细胞0 h 24 h 48 h 72 h 96 h对照组0.10±0.03 0.18±0.03 0.23±0.03 0.36±0.03 0.44±0.06实验组0.09±0.02 0.17±0.03 0.21±0.06*0.24±0.03*0.32±0.04*对照组0.10±0.02 0.19±0.02 0.27±0.05 0.37±0.03 0.58±0.04实验组0.09±0.03 0.16±0.02 0.20±0.03*0.24±0.02*0.33±0.05*
2.4 过表达DUSP1 对宫颈鳞癌细胞C33a MAPK信号通路的影响Western blot结果显示,C33a实验组中MAPK 信号通路分子p38、JNK、ERK 蛋白的磷酸化表达水平(p-p38、p-JNK、p-ERK)显著低于C33a 对照组,差异具有统计学意义(P<0.05)(表3)。
表3 过表达DUSP1对宫颈鳞癌细胞C33a MAPK信号通路的影响(±s)
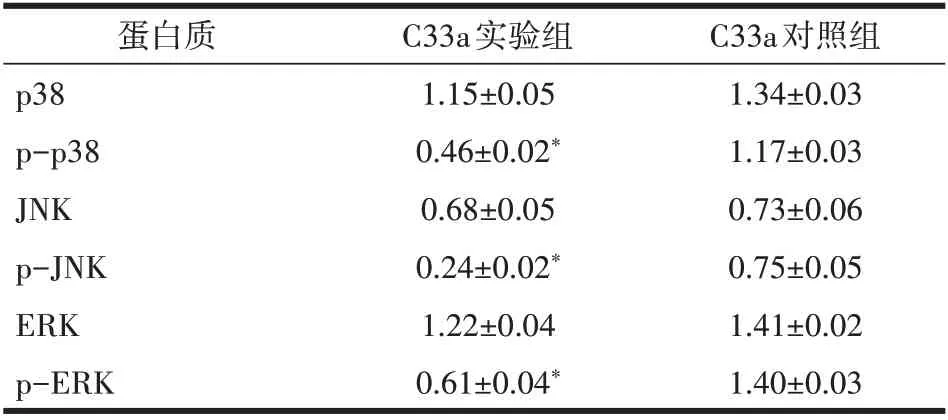
表3 过表达DUSP1对宫颈鳞癌细胞C33a MAPK信号通路的影响(±s)
注:与对照组比较,*P<0.05。
蛋白质p38 p-p38 JNK p-JNK ERK p-ERK C33a对照组1.34±0.03 1.17±0.03 0.73±0.06 0.75±0.05 1.41±0.02 1.40±0.03 C33a实验组1.15±0.05 0.46±0.02*0.68±0.05 0.24±0.02*1.22±0.04 0.61±0.04*
3 讨论
目前,宫颈鳞癌的治疗方式有手术治疗、化疗和放疗,其治疗效果常受宫颈鳞癌细胞耐药性的影响,且效果不理想。因此,寻找新的治疗靶点,提高治疗效果尤为重要。DUSP1 也被称为丝裂原活化蛋白激酶磷酸酶1(Mitogen-activated protein kinase phospha⁃tase1,MKP1),作为MKP 磷酸酶家族成员,其作用是通过使丝裂原活化蛋白激酶中特异性苏氨酸/酪氨酸残基去磷酸化从而限制其活性,是一种重要的抑制因子。有研究表明,DUSP1 在晚期乳腺癌[12]、非小细胞肺癌[13]、胰腺癌[14]中的表达水平显著升高,在前列腺癌[15]、胆囊癌[8]和结肠癌[16]中的表达水平较低。说明DUSP1 参与各类肿瘤的发生和发展,在多种肿瘤细胞中发挥着重要作用。
本研究结果显示,DUSP1 在宫颈鳞癌组织中的表达水平显著低于癌旁组织,且其表达水平与有无淋巴结转移之间有差异。说明DUSP1可能调控宫颈鳞癌细胞的转移。DUSP1 作为MAPK 基因家族的重要成员,主要介导MAPK 信号通路,参与癌症的发生和发展。如结肠癌中,MAPK 信号通路在肿瘤的生长、增殖和迁移中具有抑制作用[17-18]。在乳腺癌中,褪黑激素通过MAPK 通路抑制细胞的侵袭和转移[19]。本研究中,过表达DUSP1 可下调C33a 细胞MAPK 信号通路中相关蛋白p-p38、p-JNK、p-ERK 的表达,抑制或减缓MAPK信号通络的信号传递,改变下游相关生物学进程。DUSP1 在宫颈鳞癌C33a 和SiHa 细胞中的过表达使癌细胞C33a 和SiHa 的迁移和侵袭能力降低,同时可以抑制癌细胞的增殖。推测DUSP1可能通过调控MAPK信号通路功能蛋白磷酸化,调节下游生物学进程,从而影响宫颈鳞癌的发生与发展,但具体的分子机制尚需进一步探讨。
综上所述,DUSP1 的过表达与宫颈鳞癌细胞增殖、迁移、侵袭能力相关,可能是潜在的抑癌基因,有望成为临床治疗宫颈鳞癌的新型靶标。
