肺泡蛋白沉积症合并肺诺卡菌病一例
2022-06-30伍春霞陈亚娟
伍春霞 陈亚娟
患者,男,51岁,因“咳嗽2年、喘累半年,加重1个月”于2019年8月8日入院。2年前患者受凉后出现咳嗽,干咳为主,半年前开始出现活动后喘累,未予诊治。1个月前患者熬夜后出现咳嗽、喘累加重,伴少许咳痰,生活不能自理,外院胸部CT提示“双肺弥漫性病变”,考虑间质性肺病,予“甲强龙、莫西沙星”等治疗后症状改善欠佳,为进一步诊治于我院就诊,门诊以“双肺弥漫性病变”收入我科。既往身体健康,有吸烟史40年,每日约30支;有饮酒史40年,每日约200 ml。体格检查:T 37.1 ℃,P 94次/分,R 24次/分,Bp 112/63 mmHg,经皮血氧饱和度(SpO2)84%(未吸氧,≥94%,括号内为正常参考值范围,以下相同)。神志清楚,呼吸急促,颈静脉无怒张,双肺未闻及干湿啰音,心腹体格检查无阳性体征,双下肢无水肿。辅助检查:血气分析(未吸氧):pH 7.52(7.35~7.45)、PaCO226 mmHg(35~45 mmHg)、PaO243 mmHg(80~100 mmH)、HCO3-21.2 mmol/L(22.0~27.0 mmol/L)、剩余碱(BE) -1.7 mmo/L(-3.0~+3.0 mmol/L),动脉血氧饱和度(SaO2)84%(95%~100%)。入院完善辅助检查:血常规:WBC计数12.69×109/L(3.50~9.50×109/L),中性粒细胞百分比83.7%(40.0%~75.0%);红细胞沉降率32 mm/h(2~38 mm/h);降钙素原0.06 ng/ml(0~0.50 ng/ml);C反应蛋白>90.0 mg/L(0~8.0 mg/L);血G试验、GM试验、隐球菌荚膜抗原、体液免疫、肺癌标志物、输血前检查均未见明显异常;血抗核抗体谱、抗中性粒细胞胞浆抗体谱等自身免疫指标均为阴性。2019年8月11日患者胸部高分辨率CT(HRCT)+肺动脉造影(CTPA)检查结果(图1):双肺间质性炎症合并感染伴右肺空洞形成;CTPA未见肺动脉栓塞。治疗上加用莫西沙星400 mg每日1次联合依替米星300 mg每日1次静脉滴注抗感染。完善支气管镜内罩面罩+无创呼吸机下气管镜检查,结果示气管、支气管未见明显异常。右肺灌洗液送检细胞分类计数、病原宏基因二代测序(mNGS)、GM试验、过碘酸-希夫(PAS)染色等检查。2019年8月15日患者灌洗液液基夹层杯结核杆菌检测结果示分枝杆菌(++),未找到癌细胞;细胞分类计数:中性粒细胞百分比96%(≤3%),巨噬细胞百分比1.5%(>85.0%),淋巴细胞百分比2.5%(≤15.0%)。因灌洗液找到分枝杆菌,故加用异烟肼、利福平、吡嗪酰胺、乙胺丁醇联合抗结核治疗。2019年8月18日患者灌洗液mNGS检出诺卡菌属(皮疽诺卡菌),未检测到结核分枝杆菌,肺诺卡菌病诊断明确。遂停用抗结核药物,加用复方磺胺甲噁唑片4片每日4次口服联合莫西沙星400 mg每日1次口服。头颅MRI、腹部CT等检查均未发现肺外脓肿样改变。2019年8月20日患者灌洗液结核分枝杆菌聚合酶链反应(PCR)荧光检测结果:结核分枝杆菌复合群低于检测下限,非结核分枝杆菌低于检测下限。灌洗液病理检查结果:送检物见大量蛋白沉积物及红细胞(图2),支持肺泡蛋白沉积症(PAP)诊断(因病理科PAS染色试剂盒缺乏未行PAS染色)。2019年8月26日复查胸部CT提示右肺空洞性病变缩小(图3),患者病情好转出院,院外继续口服复方磺胺甲噁唑片、莫西沙星,择期返院行全肺灌洗术。出院诊断:1.慢性呼吸衰竭(Ⅰ型);2.PAP;3.肺诺卡菌病。随访:2019年9月患者于我院门诊随访加用雾化吸入粒-巨噬细胞集落刺激因子(GM-CSF,第1~7日125 μg每日2次、第8~14日不治疗,以此作为1个为期2周的治疗周期),2020年3月13日患者复查胸部CT提示肺部空洞明显缩小、双肺弥漫性病变减少,自行停用磺胺甲噁唑片及雾化吸入GM-CSF,因症状明显缓解,患者不愿返院行全肺灌洗术。2020年11月30日患者于我院门诊随访胸部CT提示双肺空洞未见、双肺弥漫性地图征样改变进一步减少(图4)。
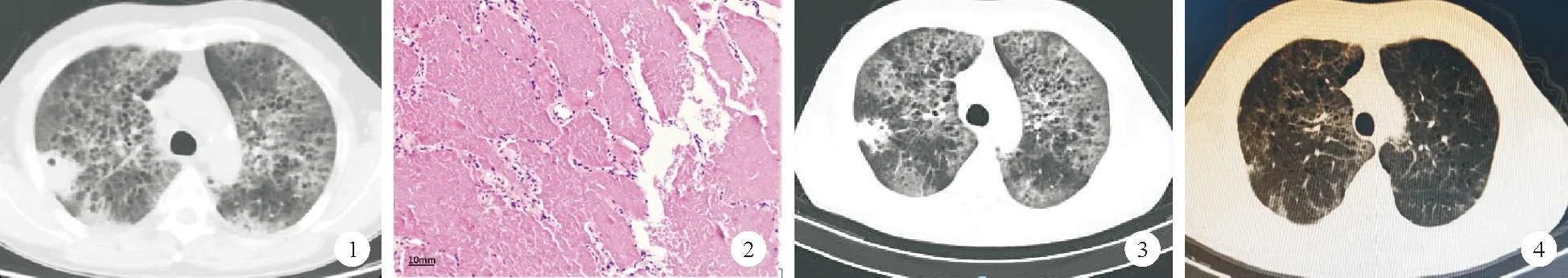
图1 2019年8月11日患者胸部HRCT检查结果 图2 2019年8月20日患者右肺灌洗液病理检查结果[苏木素-伊红(HE)染色,×100] 图3 2019年8月26日患者胸部CT检查结果 图4 2020年11月30日患者胸部CT检查结果
讨 论
诺卡菌为条件致病菌,诺卡菌病是诺卡菌属引起的局限或播散性化脓性疾病,可呈急性、亚急性或慢性病程,以慢性多见。免疫功能受损患者感染诺卡菌的风险增加,而慢性肺部疾病和酗酒是诺卡菌感染的额外危险因素[1]。Singh等[2]研究发现慢性肺部疾病(52%)是诺卡菌感染的第二大基础疾病,其中慢性阻塞性肺部疾病最常见,可能与其局部防御功能受损,再加上长期的皮质类固醇药物治疗导致免疫功能低下相关。本例患者存在肺泡蛋白沉积症这一慢性肺部疾病,有长期酗酒、熬夜及糖皮质激素使用史,以上均为诺卡菌易感因素。
肺诺卡菌病的临床表现及影像学征象均缺乏特异性,易误诊、漏诊。病原学检查是诊断诺卡菌病的金标准[3],送检标本包括痰液、胸腔积液、穿刺液、支气管肺泡灌洗液或肺脓肿的引流物,且建议多次、多部位采集标本送检以提高阳性率[4]。因诺卡菌细胞壁中含有分枝菌酸成分,通常呈现出不同程度的抗酸性,故抗酸染色时镜下常呈弱阳性表现,同时由于临床检测结核分枝杆菌采取萋-尼抗酸染色方法进行染色再通过肉眼判断其染色呈强阳性或弱阳性,因此在显微镜下很难与结核分枝杆菌进行鉴别。本例患者初期诊断为肺结核,灌洗液mNGS检测最终明确诊断,因此临床中需特别注意鉴别肺诺卡菌病和肺结核,避免误诊。
诺卡菌病的治疗方式包括药物、切开引流、手术切除,药物是治疗诺卡菌病的最佳选择[5]。磺胺类药物具有较高的口服生物利用度,因此复方磺胺甲噁唑常作为治疗诺卡菌病的临床首选药物,亚胺培南、阿米卡星、头孢曲松等药物亦作备选方案。诺卡菌根据感染类型、宿主免疫情况等,治疗方案及治疗疗程均有不同:原发性肺诺卡菌病治疗疗程3~4个月;而对于血行播撒性脓肿且免疫功能正常患者治疗疗程为3个月以上,免疫抑制患者两种药物联合治疗1年以上[6]。
PAP主要是由于体内存在的抗GM-CSF自身抗体导致肺泡巨噬细胞对肺泡表面活性物质的清除障碍所致[7],此类存在抗GM-CSF自身抗体的PAP称为特发性PAP或自身免疫相关PAP(APAP),其临床表现不具有特异性。血清细胞角蛋白19片段抗原(CYFRA21-1)、肺表面活性物质相关蛋白A(SP-A)和乳酸脱氢酶水平均可作为敏感的血清标志物诊断和评价APAP的疾病严重程度[8-9]。此外,APAP患者癌胚抗原(CEA)和涎液化糖链抗原(KL-6)水平也有不同程度的升高,而全肺灌洗术后CEA和KL-6水平均可降低[10]。基于PAP的病因及病理生理机制,国外报道GM-CSF替代疗法也有一定的治疗作用[11]。GM-CSF替代疗法包括皮下注射和吸入疗法。ARAI等[8]研究证实血清CYFRA21-1可作为GM-CSF吸入疗法有效性的评估指标。
目前PAP公认最有效的治疗方法是全肺灌洗术,能够显著缓解患者症状并改善肺功能和预后[12],适用于PaO2<60 mmHg或存在明显呼吸困难的患者[13]。本例患者发病初期符合全肺灌洗术指征,因合并诺卡菌感染未行此操作,后期因治疗效果显著,患者不愿行全肺灌洗术,在门诊规律吸入GM-CSF,自行停药7个月后再次于我院门诊复查胸部CT提示肺部地图征样改变进一步减少。虽未行抗GM-CSF自身抗体检测,但临床证实此患者属APAP。此例APAP患者未行全肺灌洗术,仅规律雾化吸入GM-CSF,临床症状和影像学检查结果均得到显著改善,故APAP患者早期规律使用GM-CSF是否可作为首选治疗方式仍需更多临床研究证实。
本例患者经支气管灌洗液送检mNGS明确诊断为肺诺卡菌病,同时灌洗液病理检查支持PAP诊断,规律使用复方磺胺甲恶唑片及雾化吸入GM-CSF治疗,临床效果及影像学检查结果均获得显著改善。PAP为临床罕见病,PAP合并肺诺卡菌病更为少见,积极取得病理学、病原学诊断,合理抗诺卡菌和雾化吸入GM-CSF治疗有助于早期改善预后。目前,PAP合并机会性诺卡菌感染,发病机制尚不明确,其内在关系如何,还需开展更多研究进一步探讨。
