苯酰胺类化合物防污活性基团的初步探索
2022-06-22荀靖懿郑纪勇程旭东张宏泉蔺存国
荀靖懿 , 郑纪勇, 程旭东 马 力, 张宏泉 蔺存国
(1. 武汉理工大学 材料科学与工程学院, 湖北 武汉 430070; 2. 中国船舶重工集团公司第七二五研究所 海洋腐蚀与防护重点实验室, 山东 青岛 266237)
海洋生物污损对海洋工程、管道设备、船舶等造成很大危害[1]。对船舶而言, 生物污损会增加船舶航行阻力, 加快燃料消耗, 降低船舶在航率, 还会破坏设施的表面涂层, 加速金属腐蚀[2]。为了解决海洋污损问题, 人类开发多种防污损方法, 比如机械清除法、低表面能涂料防污法、超声波防污法、化学防污法及生物防污法。其中化学防污法是目前使用最广泛的方法之一, 防污剂是其发挥作用的关键成分。传统的化学防污法通常使用有毒的化学物质如TBT、砷、汞化合物、氧化亚铜等[3], 对海洋环境造成严重危害。基于TBT的防污涂料高效且稳定, 但对环境影响巨大, 已于2008年被禁用。而无锡自抛光涂料也因为重金属积累的问题饱受诟病。因此,越来越多的研究人员开始研制绿色长效的新型防污剂[4-8]。
目前新型防污剂主要来自天然提取物的筛选[9-10]和人工合成化合物的改性。天然提取物主要是从海陆微生物和动植物体内分离提取的具备防污活性的次级代谢产物[11-13], 该类产品添加剂在海洋环境中易于降解, 可保持生态平衡。在所有来源类别中, 微生物是主要的来源, 超过一半的防污化合物从海洋微生物中分离出来, 包括真菌和细菌。此外, 22%的防污化合物从藻类中鉴定出来, 而23%从包括珊瑚和海绵在内的海洋无脊椎动物中分离出来[14-15]。海洋天然产品虽然被认为是有毒杀菌剂或金属基防污涂料的替代品,但其供应问题限制了它们在海洋涂料行业的商业应用, 因此研究人员通过人工合成的方法来制备经济高效的新型防污剂[16-17]。在合成中, 防污活性基团的保留是合成高效防污剂的关键。
本文以先期研究从天然产物中获得的苯酰胺类化合物为模型, 探究分子结构中的防污活性基团及其对污损生物附着的影响, 设计并合成出非对称的苯酰胺化合物HNOB(2-hydroxy-N-octylbenzamide)、含有长碳链对称结构的化合物DOLPA(N1, N3-dioctylisophthalamide)和含有苯酚对称结构的化合物DHNOB[N, N′-(octane-1, 8-diyl)bis(2-hydroxybenzamide)], 利用室内硅藻附着实验和贻贝实验初步测试3种物质的防污活性, 结合分子结构对比, 来推测可能的防污活性基团结构。这项工作有助于新型防污活性化合物的设计开发和结构优化, 并对探讨该类化合物防除污损生物附着机理、快速筛选有潜力的防污化合物具有重要意义。
1 实验
1.1 样品和试剂
1-氨基辛烷, 1-8-二氨基辛烷, 水杨酸甲酯和间苯二甲酸二甲酯均购自于麦克林, AR级试剂; 碳酸钠, 无水硫酸钠, 正己烷, 乙醇, 丙酮, 二甲基亚砜和二氯甲烷均购自于上海沪试, AR级试剂; F/2 Medium购自于上海光语生物科技; Econea购自北京偶合科技, 纯度95%。
1.2 HNOB、DHNOB、DOLPA的合成
本文采用胺酯的交换[18-20]反应来合成酰胺[21-22],3种苯酰胺类化合物合成路线如图1所示。

图1 三种化合物的合成路线: (a) HNOB、(b) DOLPA和(c) DHNOBFig. 1 Synthesis route of three compounds: (a) HNOB, (b) DOLPA, and (c) DHNOB
1.2.1 HNOB的合成
HNOB通过1-氨基辛烷和水杨酸甲酯进行酯交换反应得到(图1a)。在100 mL三口烧瓶中依次加入50 mmol水杨酸甲酯, 55 mmol辛胺, 并以500 r/min的转速搅拌, 加热至140 ℃时, 反应开始计时, 反应12 h。反应结束后, 停止加热, 冷却出料。加入二氯甲烷溶解产物, 将反应液置于分液漏斗中, 加入50 mL的 5% 盐酸水溶液, 震荡静置后分液, 得到下层液,再加入适量10% Na2CO3水溶液洗涤至中性, 静置分层得到下层液, 重复3次上述步骤。取有机相, 加入5 g无水硫酸钠干燥剂过夜干燥, 过滤。对滤液进行旋蒸, 除去二氯甲烷, 最后得到淡粉色固体。
1.2.2 DOLPA的合成
DOLPA通过间苯二甲酸二甲酯和1-氨基辛烷进行酯交换反应得到(图1b)。在氮气氛围下, 将2.91 g(15 mmol)间苯二甲酸二甲酯和3.89 g (30 mmol) 1-氨基辛烷加入到带有冷凝器的圆底烧瓶中, 混合物在100 ℃下搅拌12 h, 得到粗产物。所得产物用适量丙酮溶解, 用布氏漏斗进行抽滤, 再用丙酮冲洗过滤物, 按上述步骤洗涤3次。用正己烷/乙醇进行重结晶, 最后结晶物在60 ℃下真空干燥24 h, 得到白色结晶物DOLPA。
1.2.3 DHNOB的合成
DHNOB通过1-8-二氨基辛烷和水杨酸甲酯进行酯交换反应得到(图1c)。在氮气氛围下, 将1.4 g(10 mmol) 1-8-二氨基辛烷和3.80 g (25 mmol)水杨酸甲酯加入到带有冷凝器的圆底烧瓶中, 混合物在100 ℃下搅拌7 h, 得到粗产物。所得产物用适量二氯甲烷溶解, 布氏漏斗进行抽滤, 再用二氯甲烷冲洗过滤物, 按上述步骤洗涤3次。用正己烷/乙醇进行重结晶, 最后过滤物在60 ℃下真空干燥24 h, 得到白色粉末固体DHNOB。
2 材料测试与表征
2.1 傅里叶红外分析
用Nicolet 8700型红外吸收光谱仪对样品进行结构表征, 测其在400~4 000 cm–1范围内的吸收峰,得到红外吸收光谱图。
2.2 核磁共振分析
核磁共振谱图采用Bruker Avance NEO 600测试。HNOB、DOLPA和DHNOB样品测试分别使用二氯甲烷、甲醇和二甲基亚砜氘代溶剂溶解。化学位移(δ)是相对于三甲基硅烷(TMS)的百万分之一(ppm)。
2.3 硅藻附着实验
硅藻是导致生物污损的关键污损生物, 其在固相表面的附着可诱导大型污损生物附着, 同时附着的硅藻生物膜异常顽固, 能够广泛适应各种性质的表面[23]。因此, 抑制硅藻的附着是防除污损生物的重要思路之一。室内硅藻附着实验可用于表征化合物的防污性能(图2)。

图2 室内硅藻附着实验示意图Fig. 2 Schematic of the indoor diatom attachment experiment
按照Guillard & Ryther方法配置含硅F/2培养液用于培养小形舟形藻(Navicula parva)和中肋骨条藻(Skeletonema costatum)。本实验设计6个梯度浓度, 分别为6.5 μg/mL、12.5 μg/mL、25 μg/mL、50 μg/mL、100 μg/mL和200 μg/mL, 考察3种化合物在不同浓度下对硅藻附着抑制效果。此外每组增设阴性对照组和空白对照组, 化合物浓度为0 μg/mL且含5%体积溶剂的为阴性组, 化合物浓度为0 μg/mL且无溶剂的为空白组。6.5 μg/mL组按下述步骤实施: 预先刻制好圆载玻片, 培养浓度约为1×106个/mL的小形舟形藻或中肋骨条藻藻液以及浓度为6.5 μg/μL的HNOB溶液(HNOB使用二甲基亚砜溶解, DOLPA和DHNOB使用乙醇溶解)。在24微孔板中依次加入圆载玻片、1 900 μL小形舟形藻或中肋骨条藻藻液, 13 μL HNOB溶液和87 μL二甲基亚砜溶剂, 混合均匀。其他组依此类推。最后将微孔板放置于人工气候箱中, 23 ℃恒温培养。每组设置3个平行样。72 h后用灭菌海水轻轻冲洗圆载玻片上未附着硅藻, 用LEICA DM2500荧光显微镜在20倍物镜下观察圆载玻片上硅藻附着情况, 并随机选取5个视野在360 nm波长下拍摄荧光照片, 视野面积为0.197 5 mm2, 使用Image pro图像识别处理软件对照片中硅藻个数进行计数。SY为阴性组硅藻附着数量,ST为测试组硅藻附着数量。硅藻附着抑制率Y按下述公式计算:

使用GraphPad Prism 9软件中的Dose-Response模型将抑制率与对数浓度拟合曲线[24], 根据函数计算出半数抑制浓度(EC50),式中Hill Slop描述了曲线的陡度。
2.4 贻贝实验
贻贝足丝腺可分泌足丝, 足丝末端含有万能胶水之称的“贻贝粘着蛋白”, 可锚固在大部分硬质表面,这使得贻贝成为船体上常见的污损生物, 群集数目高达1 000个/m2。贻贝实验主要考察化合物对贻贝足丝的抑制效果。实验步骤如下: 向6孔细胞培养板中加入9 950 μL天然海水和50 μL浓度为1 μg/μL的化合物溶液, 配制成5 μg/mL的混合液。同时设置空白组, 阴性组(该组中使用乙醇溶剂为阴性组1, 使用二甲基亚砜溶剂为阴性组2)和阳性组(Econea)。向细胞培养板中加入贻贝, 24 h后观察贻贝活性和分泌的足丝个数, 记为实验组1。观察后将实验组1中的贻贝取出并放入正常海水中继续培养24 h, 再次观察其活性和足丝个数, 该组记为实验组2。
3 结果与分析
3.1 苯酰胺类化合物分子结构表征
对合成的3种苯酰胺类化合物进行红外光谱、核磁氢谱和核磁碳谱的测试, 结果分别如图3、图4和图5所示:

图3 三种苯酰胺类化合物及其原料的红外光谱表征Fig. 3 Chemical characterization of the three compounds and their raw materials via FTIR

图4 三种苯酰胺类化合物的核磁氢谱表征Fig. 4 Chemical characterization of the three compounds via 1H NMR

图5 三种苯酰胺类化合物的核磁碳谱表征Fig. 5 Chemical characterization of the three compounds via 13C NMR
在HNOB红外谱图(图3a)中, 3 407 cm–1单峰为酰胺N-H伸缩振动峰, 1 644 cm–1和1 540 cm–1分别为羰基伸缩振动(酰胺Ⅰ带)和N-H弯曲振动(酰胺Ⅱ带), 另外HNOB没有出现羰基峰, 这表明合成初步成功。结合图4中1H NMR分析: δ0.89为长碳链末端-CH3信号, 其峰面积为 3。δ1.22~δ1.41, δ1.65,δ3.45为长碳链上亚甲基-CH2-信号, 峰总面积约为14, 与亚甲基上H个数一致。δ6.53~δ7.43为苯环及酰胺上H吸收峰。δ12.51为酚羟基吸收峰。通过图5的13C NMR证实分子结构中碳的个数与目标产物一致。
结合DOLPA和间苯二甲酸二甲酯红外谱图(图3b)看, 在1 715 cm–1处酯键C==O振动峰消失, 能够初步说明DOLPA成功合成。通过1H NMR确定DOLPA化学结构, 如图4所示, δ8.24, δ7.94, δ7.55归属于苯环上-C-H信号, 3个信号峰面积比约为1∶2∶1。δ1.30~δ1.63则为长链上-CH2-信号。δ0.90为长链上末端甲基-CH3信号, 其峰面积约为6。同时通过图5中13C NMR证实DOLPA结构中碳的个数与目标产物一致。
综合水杨酸甲酯和DHNOB红外谱图(图3c)看,酯基吸收振动峰消失, 酰胺Ⅰ带和酰胺Ⅱ带的生成,能够初步表明DHNOB合成成功。通过1H NMR确定DHNOB的化学结构, 如图4所示, δ7.80的信号属于-NH, δ6.72~δ7.27归属于苯环上-C-H信号, 峰面积比约为1∶1∶1∶1。δ1.50和δ1.32为长链-CH2-信号。这些数据表明成功合成DHNOB。同时通过13C NMR确定DHNOB化学结构(图5): 167 ppm为羰基C信号, 162 ppm为连接酚羟基C信号, 118 ppm、132 ppm、116 ppm、115 ppm、128 ppm分别为苯环位置上的碳信号。38 ppm、28 ppm、26 ppm、29 ppm则为长碳链上碳信号。
3.2 硅藻附着实验
对合成的化合物HNOB, DOLPA和DHNOB进行硅藻附着实验, 使用LEICA荧光显微镜对圆载玻片进行拍照, 用Image pro软件对荧光照片上的红点进行计数, 并测出其对典型污损生物的半抑制浓度。拟合曲线如图6所示:
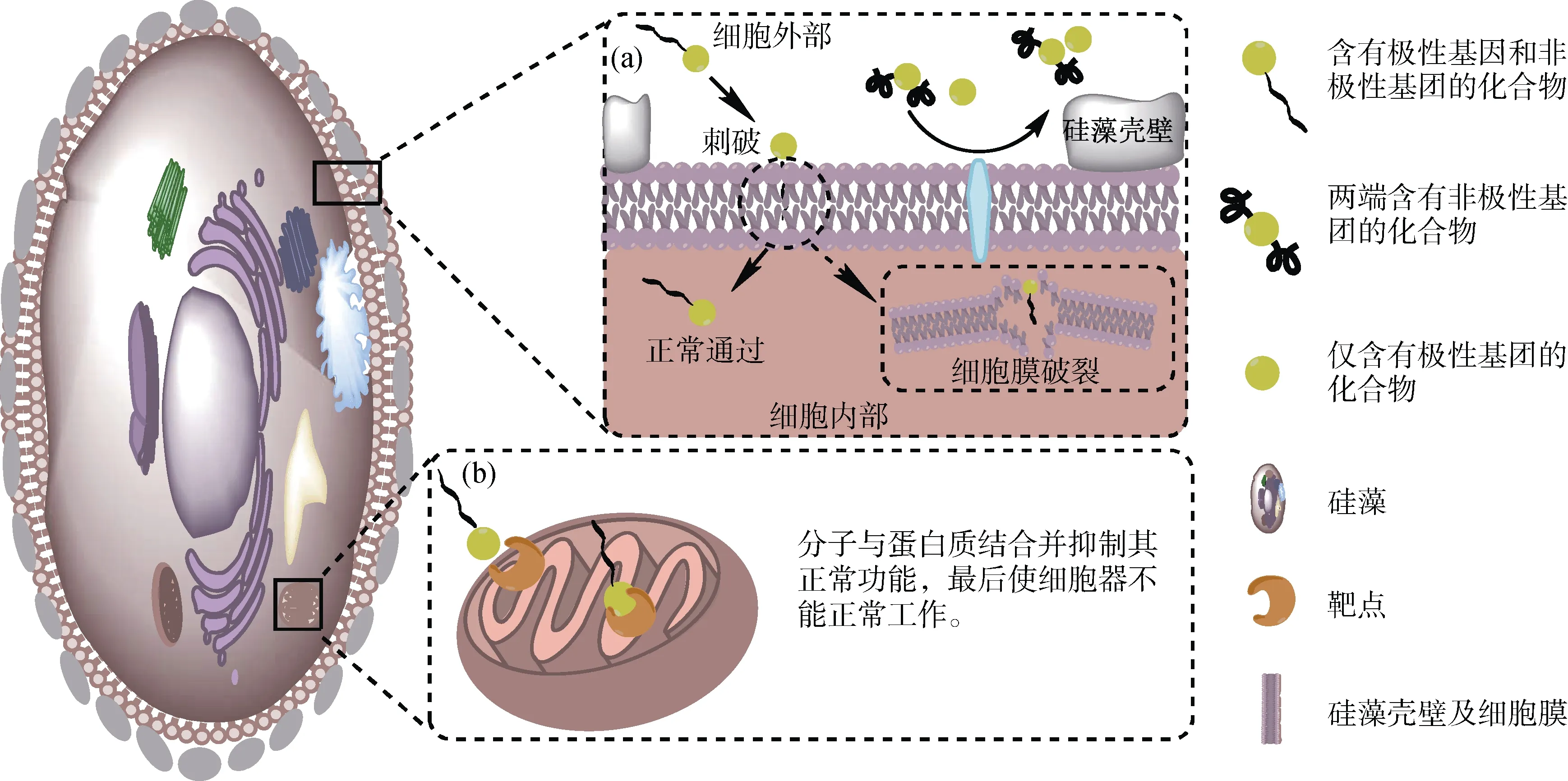
根据抑制率Y与对数浓度lgC的关系拟合出如图6a和图6b的图像, 表1给出拟合后的相关系数R2、Hill Slope和EC50。从表1的EC50看出, 化合物对两种硅藻都具有一定的抑制, 并且EC50(HNOB) 表1 拟合函数的相关数值R2, Hill Slope和EC50Tab. 1 Correlation values of the fitting function R2, Hill Slope, and EC50 图6 硅藻抑制率与lgC的拟合曲线Fig. 6 Fitting curve of the inhibition rate with lgC 如图7a和图8所示, 3种化合物对小形舟形藻均有明显的抑制作用, 其中HNOB对小形舟形藻的抑制效果最明显, 半数抑制浓度EC50为4.661 μg/mL。HNOB和DOLPA的浓度在200 μg/mL时, 对硅藻具有强烈的灭杀效果, 但HNOB在低浓度时具有比DOLPA更好的抑制效果, 6.5 μg/mL浓度作用下, 视野中小形舟形藻的附着个数为177。DHNOB也具有一定抑制作用, 但是在浓度达到50 μg/mL后, 提高浓度对硅藻的抑制作用不明显, 小形舟形藻的附着个数均在70左右。 图7 不同化合物浓度作用下, 20倍视野中硅藻附着个数Fig. 7 Number of diatoms attached in the 20× field under different compound concentrations 图8 硅藻在不同浓度化合物作用下72 h后的荧光照片Fig. 8 Fluorescence images of diatoms exposed to different concentrations of compounds for 72 h 从图7b和图8可以看出3种化合物对中肋骨条藻抑制规律和小形舟形藻相似, 不同之处在于高浓度时DOLPA对中肋骨条藻抑制作用不明显。 苯酰胺类化合物结构类似于表面活性剂的结构[25]。结合表面活性剂的生物效应[26], 我们认为苯酰胺类化合物可能吸附于带负电荷的微生物表面, 并逐步渗入类脂层[25], 从而改变细胞膜通透性, 使细胞内容物外渗, 导致微生物死亡, 推测机理如图9a所示。另外结合药物设计中的药效团模型[27-28], 认为化合物有可能在通过磷脂双分子层后, 与细胞器上的糖蛋白或者其他类型的蛋白进行结合并对该蛋白的正常功能起到抑制作用, 最终导致微生物失去活性[27],推测机理如图9b所示。 图9 化合物抑制硅藻活性的机理示意图Fig. 9 Mechanism diagram of the compound inhibiting the diatom activity 结合3种化合物结构看, DHNOB由于结构中疏水性烷基结构[29]被两端的酚结构所屏蔽, 从而使化合物不易穿透生物膜进入细胞体内进行作用。同时氢键供体酚羟基和氢键受体酰胺结构依然能与部分蛋白结合而起到抑制作用, 但是作用程度有限, 所以具有对称酚类结构的化合物对硅藻附着的抑制效果一般。仅具有长碳链结构的化合物(DOLPA)对硅藻附着的抑制效果不佳, 对2种硅藻的半抑制浓度均大于20 μg/mL。分析认为与结构的极性大小有关, 极性小不易吸附在微生物膜表面。另外还与化合物长碳链的构象有关, 蜷曲的构象不易穿透生物膜, 反之伸展开的构象容易穿透生物膜。HNOB化合物具有静电作用的酚羟基和酰胺结构, 可以像表面活性剂一样先吸附于细胞膜等表面, 再通过疏水性烷基结构渗入类脂层, 破坏细胞正常的结构, 最终导致微生物死亡。所以HNOB在实验中表现出较好的防污活性。 通过贻贝足丝个数和存活状态来判断化合物对大型污损生物的抑制和毒杀作用。3种苯酰胺类化合物对贻贝足丝和活性的影响结果如表2所示。 表2 3种苯酰胺类化合物对贻贝足丝及活性的影响Tab. 2 Effects of the three benzamide compounds on mussel byssus and activity 对照组中可以看出, 阳性组均杀死了贻贝, 空白组和阴性组贻贝均存活且有足丝生成。实验组1中HNOB的3组平行样在24 h后没有足丝生成, 可以判断其对贻贝足丝具有抑制作用。同时3个平行样的贻贝均存活, 初步表明HNOB对贻贝没有毒杀作用。DOLPA组贻贝均存活且生成足丝, 每组贻贝平均生成12根足丝, 对贻贝足丝的抑制效果不明显。DHNOB样中2#平行样贻贝死亡, 其他两组贻贝均存活且有足丝生成。从实验组2看出, HNOB的3#贻贝存活且生出4根足丝, 1#贻贝死亡。结合实验组1的情况看, 贻贝在有HNOB的海水中不会分泌足丝, 24 h后将其放入正常海水中后又会分泌足丝, 表明HNOB对贻贝足丝具有抑制效果, 且对贻贝的毒杀作用较低, 符合绿色防污剂的设计要求。DOLPA和DHNOB两组均存活, 但DOLPA组贻贝分泌的足丝个数要少于DHNOB组。长期来看, DOLPA对贻贝的抑制作用比DHNOB好, 但远低于HNOB防污效果。 在这项工作中, 我们通过酯交换反应合成HNOB,DOLPA和DHNOB 3种化合物, 对其进行FTIR,1H NMR和13C NMR表征与分析, 并通过室内硅藻附着和贻贝实验对化合物防污性能进行测试, 根据实验结果与化合物结构对比分析, 得到如下结论: (1)1H NMR、13C NMR和FTIR表明成功合成3种目标化合物, 其中DOLPA两端具有8个碳的脂肪链结构, DHNOB两端具有亲水性的酚羟基和能形成氢键的酰胺结构, 而HNOB既有酚酰胺的结构又有8个碳的脂肪链结构。 (2) 硅藻附着和贻贝实验均表明HNOB防污性能好于DOLPA和DHNOB。根据Does-Response模型拟合出曲线并计算得到EC50, HNOB



3.3 贻贝实验

4 结论
