植物对镉吸收、转运及耐性调控机制研究进展
2022-06-22李慧君明荔莉张文生
李慧君, 明荔莉, 张文生,*
1. 北京师范大学天然药物教育部工程研究中心,北京 100088
2. 拱北海关技术中心,珠海 519000
3. 地表过程与资源生态国家重点实验室珠海基地,珠海 519087
4. 北京师范大学中药资源保护与利用北京市重点实验室,北京 100875
镉(cadmium, Cd)是自然界中普遍存在的一种重金属元素,具有较高的生物毒性。 自然状态下,土壤中Cd 含量处于较低水平。 然而,随着工农业的发展,我国遭受Cd 污染的土地面积不断增加,农田土壤Cd 污染尤为突出[1]。 采矿、冶炼、污水灌溉、污泥培肥和磷肥施用等人类活动以及大气沉降是农田土壤Cd 污染的主要来源。 2014年,我国原环境保护部和原国土资源部公布的《全国土壤污染状况调查公报》数据显示,我国耕地土壤重金属污染点位超标率达19.4%,其中Cd 的点位超标率为7.0%,污染最为严重[2]。 与其他重金属相比,土壤中的Cd 迁移性较强、生物毒性较高,容易被作物吸收、富集,进入食物链,最终危害人体健康[3-4]。 因此,Cd 污染受到人们的广泛关注。
Cd 是植物生长发育过程中的非必需金属元素。研究表明,Cd 吸收会导致细胞损伤,干扰细胞正常生理代谢过程,影响植物生长发育[5]。 为抵御Cd 毒害,植物进化出了多种解毒机制,主要包括限制根系Cd 吸收、阻止Cd 进入细胞、螯合作用、液泡储存和激活抗氧化防御系统等[6]。 在不断认识植物对Cd毒性生理调控的同时,人们开始探索其背后的分子机制。 本文围绕植物对Cd 吸收、转运的吸收蛋白和排出蛋白,以及调控Cd 耐性基因表达的转录因子和microRNA 这4个方面总结相关研究进展,以期为今后相关研究提供参考。
1 植物对镉的吸收、转运(Uptake, translocation of cadmium in plants)
1.1 镉吸收蛋白
重金属吸收蛋白是Cd 进入根细胞的主要转运蛋白,一般定位在细胞质膜上,负责将重金属转运至细胞质,包括锌/铁蛋白(ZIP)家族、天然抗性巨噬细胞蛋白(NRAMP)家族和黄色条纹蛋白(YSL)家族等。
ZIP 家族是锌转运蛋白(ZRT)和铁转运蛋白(IRT)家族的总称,优先参与锌(Zn)和铁(Fe)的吸收、转运,同时也参与根系对Cd 的吸收过程。 拟南芥中的AtIRT1是从植物中克隆出的第一个ZIP家族基因,它是缺Fe 情况下根部诱导的Fe2+高亲和吸收蛋白[7]。 目前,已在拟南芥、水稻、苜蓿和大豆等植物中鉴定出了100 多个ZIP家族基因,该家族成员具有广泛的底物特异性,参与Cd2+、Zn2+和Cu2+等多种金属离子的吸收转运[8]。 Zheng 等[9]发现 Cd 胁迫下,AtIRT1和OsZIP1基因表达上调,证明了AtIRT1和OsZIP1分别参与拟南芥和水稻根系对Cd2+的吸收。 在缺铁的情况下,水稻中OsIRT1和OsIRT2会促进根部吸收Cd,且OsIRT1较OsIRT2对Cd 表现出更高的敏感性[10]。 Zn/Cd 超积累植物东南景天能通过位于细胞质膜的 SaZIP4 蛋白超吸收 Zn 和Cd[11]。 最近,Tan 等[12]发现,OsZIP5和OsZIP9协同作用,参与水稻对Zn 和Cd 的吸收。 研究表明,Fe和Zn 均与Cd 的吸收存在一定竞争关系,即在Cd胁迫下,植物将减少对Zn/Fe 的吸收[13]。 大多数ZIP蛋白的表达是由Zn、Fe 或Mn 元素缺乏诱导的,调控ZIP 家族蛋白的内源表达对维持细胞金属稳态至关重要,主要是由于该家族基因参与了植物根系对金属的吸收及金属在植物不同组织部位的运输和分配[14]。
NRAMP 家族是一个膜整合蛋白家族,最初被认为只能转运Fe2+,之后的研究发现其对Cd2+、Zn2+和Mn2+等离子转运也具有重要的调控作用[8]。 如At-NRAMP3 和AtNRAMP4 位于拟南芥液泡膜上,参与Fe2+、Mn2+和 Cd2+从液泡向细胞质的转运[15-17]。 水稻中OsNRAMP1和OsNRAMP5是同源质膜基因,主要在根部表达,具有向根细胞转运Cd 和Mn 的能力[18-19]。 其中,OsNRAMP5 是水稻中主要的 Cd 吸收蛋白,几乎承担了90%的Cd 吸收转运[20]。 Tang等[21]通过敲除OsNRAMP5得到的突变体水稻较普通野生型水稻根和芽中Cd 含量明显降低。 Chang等[22]发现OsNRAMP5过表达可提高水稻根系中Cd的积累,但是茎和籽粒中Cd 积累显著降低,研究者认为主要是因为Cd 在根系的径向运输受到干扰,从而影响了其在木质部的装载。 此外,Zhang 等[23]在东南景天中发现了一种新的参与Cd 和Zn 超积累的质膜转运蛋白——SaNRAMP1,烟草过表达SaNRAMP1能显著增加体内 Cd、Zn 和 Mn 的积累。 李亚敏等[24]根据模式生物Nramp基因的保守序列,克隆测序得到了玉米Nramp1基因,Cd 胁迫实验发现玉米叶片和根系中ZmNramp1基因的表达量与Cd 含量呈现显著正相关关系,证实了该基因与玉米中重金属Cd 的吸收转运具有密切联系。
YSL 蛋白是寡肽转运蛋白(OPT)家族的一员,主要参与植物中金属与植物载体(PS)或烟碱胺(NA)螯合物的吸收转运。 玉米ZmYS1 是第一个被鉴定出的YSL 家族蛋白,作为载体参与Fe(Ⅲ)-PS 的跨膜吸收和运输[25],同时在不同植物体内、不同组织部位介导细胞对 Cd2+、Fe2+和Zn2+的吸收转运。 Feng等[26]在超富集植物龙葵中克隆得到了SnYSL3基因,发现 Cd 胁迫会刺激SnYSL3表达上调,将SnYSL3在酵母中表达可以促进 Cd2+/Fe2+/Cu2+/Zn2+-NA 复合物的转运,首次报道了 SnYSL3 参与Cd-NA 复合物的转运。 Wang 等[27]将从印度芥菜中分离得到的BjYSL7在烟草中过表达后发现,茎中Cd 含量显著高于野生型植株,这说明BjYSL7可能介导了Cd 向地上部分的运输。 紫花苜蓿MsYSL1定位于质膜,过量的 Mn、Cd、Pb 或缺 Fe、Zn、Cu 会刺激其在根中表达,表明MsYSL1 可能参与包括Cd在内的多种重金属-NA 复合物的转运[28]。
1.2 镉排出蛋白
排出蛋白的功能是将重金属排出细胞质,或运载至液泡,是植物根细胞中Cd 进入木质部或区隔在液泡中的主要转运蛋白。 重金属ATP 酶(HMA)和Ca2+/H+反向转运蛋白(CAX)是植物体内重要的Cd 排出蛋白。
HMA 是一类能够利用ATP 水解产生的能量驱动离子进行跨膜运输的转运蛋白,在Cd 向地上部运输和液泡区室化中发挥重要作用。HMA家族基因在拟南芥和水稻中的研究相对成熟。 Wong 和Cobbett[29]研究发现,敲除AtHMA2和AtHMA4基因后,Cd 在拟南芥根茎间的转移几乎完全消失,证明了定位于质膜的HMA2 和HMA4 是负责拟南芥根茎间Cd 转运的主要因素。 Liedschulte 等[30]在烟草中也有类似的发现:敲除NtHMA4基因会导致根部Cd 向茎的转移减少90%以上。 水稻中OsHMA2基因主要在根部维管束薄壁细胞中表达,与拟南芥的AtHMA2和AtHMA4功能类似,参与 Cd 在木质部的装载[31]。 而HMA3 位于液泡膜上,在植物的不同组织部位广泛分布,具有区隔化Cd 和Zn 的功能。Ueno 等[32]首次报道了水稻OsHMA3基因位于根部细胞液泡膜上,可选择性地将Cd 区隔在液泡中,限制Cd 向地上部的转运。 而Shao 等[33]则在控制Os-HMA2表达的前提下发现,过表达OsHMA3会促进水稻各组织部位Cd 向液泡转运,从而降低水稻籽粒中的Cd 含量。 最近,吴海涛等[34]从野生重金属耐性植物伴矿景天中克隆到一个HMA家族的基因——SpHMA2,该基因高表达可提高模式植物拟南芥的Cd 耐性及地上部分积累,说明SpHMA2是一个对Cd 正响应的基因,且在Cd 胁迫时,可能主要负责Cd 从地下往地上部的转运。
CAX 是一类定位在细胞质膜、液泡膜、叶绿体类囊体膜及线粒体膜上的转运蛋白,能够与HMA蛋白家族协同作用参与细胞质中二价阳离子向液泡的转移积累[35]。 植物液泡膜的CAX 主要是Ca2+转运蛋白,介导Ca2+从细胞质进入液泡,同时也具有转运Cd2+、Zn2+和Mn2+等离子的能力。 对参与 Cd转运的CAX基因研究较多的是拟南芥。 拟南芥中包含6个CAX家族成员,即CAX1 ~CAX6,均具有转运Cd 的能力,其中CAX2和CAX4编码蛋白对Cd 的转运能力最强[36-37]。 Korenkov 等[38-39]将At-CAX2和AtCAX4在烟草中表达发现,烟草根部细胞质中Cd、Zn 和Mn 向液泡转运增加,并且CAX2和CAX4对Cd 吸收最敏感。 这可能是由于Cd2+具有与Ca2+相似的离子半径,使得这2个离子竞争相同的膜转运蛋白[40]。 最近,廖琼等[41]发现甘蓝型油菜CAX家族共包含17个成员,并且CAX基因主要在地下部表达,其中BnaC4.CAX1-2和BnaC3.CAX2-2是该家族的核心基因,并受Cd2+胁迫的显著诱导。 陈少鹏等[42]克隆了越橘中VcCAX2基因,发现该基因在越橘根系中表达量随着Cd 胁迫程度的提高呈现增加的趋势。
此外,ATP 结合盒转运蛋白(ABC)在植物细胞Cd 的外排过程中也发挥着重要转运作用。 MRP(ABCC)和PDR(ABCG)是目前研究较为深入的ABC转运蛋白亚族。 如 Brunetti 等[43]通过Cd 特征荧光物定位实验证明AtABCC3存在时,Cd 在拟南芥液泡中的分布远多于细胞质,并且推测AtABCC3 将Cd 以植物螯合肽(PCs)-Cd 复合体的形式转运到液泡区隔。 Kim 等[44]发现了定位于拟南芥根部表皮细胞质膜的AtPDR8 具有将Cd 排出细胞外的功能。
总之,由于Cd 是植物的非必需元素,因此植物体内没有Cd 的特异性转运蛋白,Cd 在植物体内的跨膜转运主要利用特异性较低的必需元素Fe2+、Zn2+和Mn2+等二价阳离子的转运蛋白。 Cd 在植物根系吸收、转运的主要转运蛋白如图1 所示。
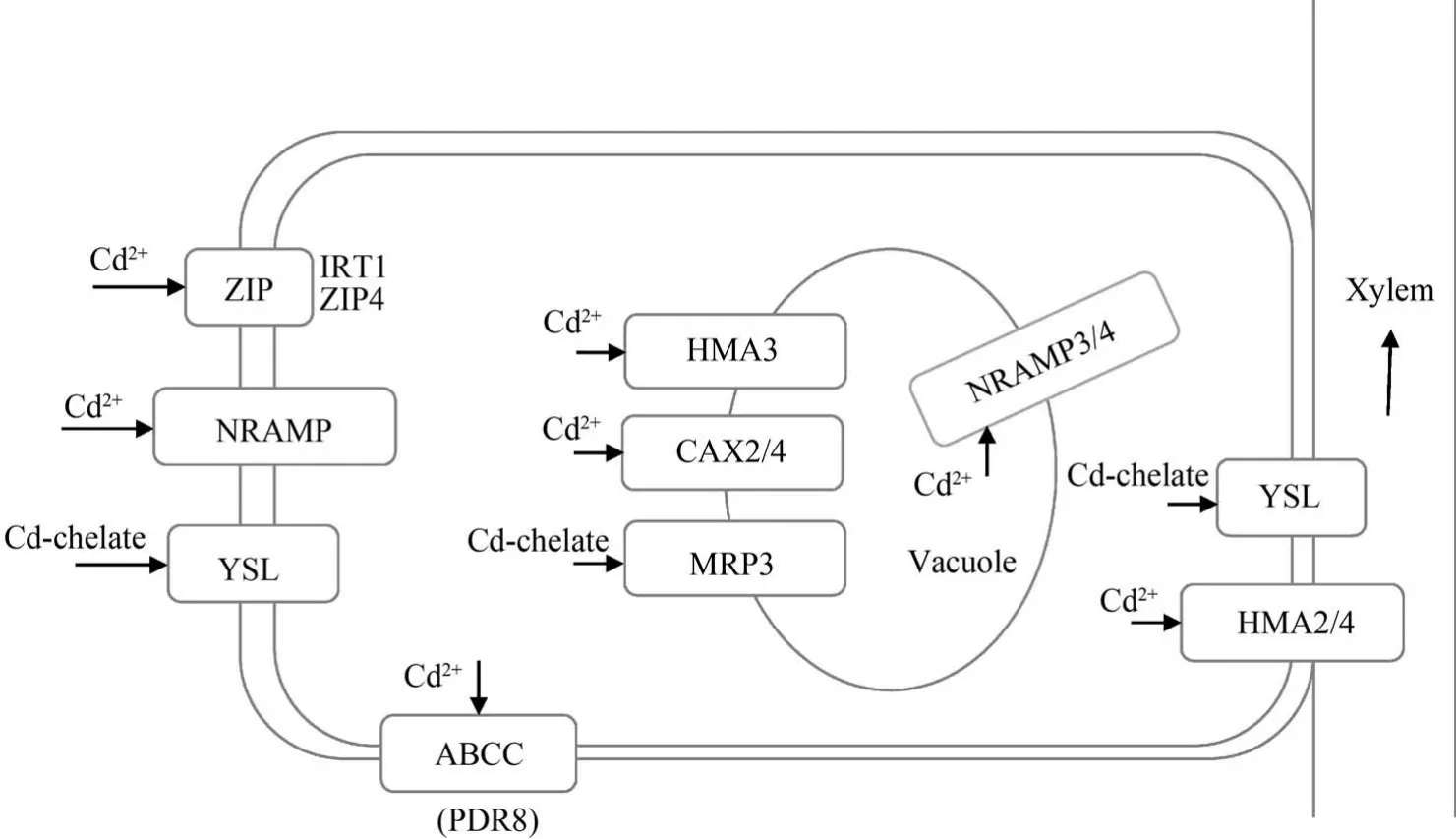
图1 镉在植物体内吸收、转运的主要转运蛋白示意图[45]Fig.1 Schematic diagram of the main transporters involved in Cd uptake and translocation in plants[45]
2 植物镉耐性调控机制(The tolerance mechanism of cadmium in plants)
2.1 转录因子调控
转录因子(transcriptional factors, TFs)可通过与特定基因的顺式作用元件结合调控下游基因的表达,在植物响应逆境胁迫的过程中发挥重要作用[46]。 大量研究表明,WRKY、MYB 和bHLH 等转录因子家族均参与植物Cd 耐性的调控。
WRKY 蛋白是植物特有的一类转录因子,同时也是植物中最大的转录因子家族之一,主要通过与启动子区域的W-box 元件结合调控下游靶基因的表达。 如大麻的40个WRKY 转录因子中有14个成员参与 Cd 胁迫响应[47]。 Liu 等[48]的研究表明,AtWRKY18、AtWRKY40 和 AtWRKY60 能与特定基因启动子区的W-box 结合,从而负调控拟南芥的Cd 耐性。 AtWRKY12 对拟南芥 Cd 耐性也具有负调控作用。 Han 等[49]揭示了 AtWRKY12 作用机制主要是其能与GSH1启动子结合,直接抑制GSH1基因的表达,间接干扰Cd 解毒物质PCs 的合成。而Sheng 等[50]则发现拟南芥的WRKY13 转录因子可以与PDR8启动子直接结合,激活Cd 排出蛋白PDR8 的表达,减少细胞内Cd 积累,正调控拟南芥的 Cd 耐性。 Hong 等[51]用 Cd 处理玉米幼苗,发现ZmWRKY4、超氧化物歧化酶(SOD)和抗坏血酸过氧化物酶(APX)基因表达上调,并推测可能是由于ZmWRKY4可以激活ZmSOD4和ZmcAPX的表达,从而促进抗氧化酶的合成,提高玉米的Cd 耐性。 此外,在Cd 超积累植物中也发现了参与调控Cd 耐性的WRKY 转录因子。 如王影等[52]从超积累型东南景天中获得了一条新的东南景天WRKY 转录因子家族基因——SaWRKY7,并发现其在早期响应Cd 胁迫诱导表达,推测其可能在东南景天Cd 积累或Cd 耐受过程中发挥重要作用。
MYB 转录因子是一类结构中含有一段高度保守的 DNA 结构域(MYB)的转录因子,分为1RMYB、R2R3-MYB、R1R2R3-MYB 和 4R-MYB 这 4类,其中R2R3-MYB 数量最多,多数R2R3-MYB 转录因子可以正调控植物对逆境的响应。 如丁杰等[53]从大豆根系中获得了16个与Cd 胁迫应答相关的R2R3-MYB基因,进一步分析发现,大豆根系中的MYB基因主要通过调控重金属Cd 的吸收、转运、解毒过程来缓解Cd 的毒害作用。 Agarwal 等[54]研究发现,拟南芥中R2R3-MYB 亚家族的AtMYB4基因过表达可显著提高植株的Cd 耐性,并认为主要是由于MYB4 能特异性激活PCS1和MT1C基因的表达,促进PCs 和金属硫蛋白(MTs)的合成,从而降低Cd 毒性。 除了直接作用于Cd 解毒物质合成过程的基因,MYB 转录因子还可以通过脱落酸(ABA)信号途径调控植物Cd 耐性。 如Zhang 等[55]发现拟南芥R2R3-MYB 转录因子MYB49 具有正调控Cd耐性作用,并认为MYB49 主要通过与ABI5互作,干扰MYB49 与下游基因bHLH38和bHLH101的直接结合,减少Cd 吸收蛋白IRT1 的合成,提高植株对 Cd 的耐受性。 此外,Hu 等[56]报道了水稻中1R-MYB 亚家族基因OsMYB45可被Cd 诱导表达,该基因突变会抑制OsCATA和OsCATA的表达,降低过氧化氢酶(CAT)的活性,这可能是MYB45 转录因子调控Cd 耐性的方式。
bHLH 转录因子家族成员均含有由50 ~60个氨基酸组成的典型bHLH 结构域,该结构域分为N端的碱性区域和C 端的螺旋-环-螺旋(HLH)区域2个不同的功能区[57]。 碱性区域通常包括10 ~18个氨基酸,具有DNA 的结合位点,能够识别靶基因启动子区的 E-box 和/或 G-box 元件;HLH 区域由 2个α-螺旋以及连接2个螺旋的环状结构组成,是二聚体形成的结合域[58]。 Wu 等[59]研究发现 Cd 胁迫可以提高拟南芥中bHLH家族基因FIT、AtbHLH38和AtbHLH39的表达,并且过表达FIT/AtbHLH38或FIT/AtbHLH39可增强植株Cd 耐性。 进一步实验证明FIT/AtbHLH38或FIT/AtbHLH39过表达一方面能够启动重金属区室化基因的表达(如HMA3、MTP3、IREG2和IRT2),从而将 Cd 区隔在根部,抑制Cd 向地上部分转运;另一方面还能启动尼克酰胺合成酶基因(NAS1和NAS2)的表达,从而促进植物体内铁螯合物尼克酰胺(NA)的合成,增加Fe 的吸收转运,减少 Cd 的积累。 最近,Yao 等[60]在拟南芥中也有类似发现:bHLH104 能够正调控4个重金属解毒基因的表达,即IREG2、MTP3、HMA3和NAS4,从而提高拟南芥的 Cd 耐性。 此外,人们在大豆中也发现了参与其Cd 耐性调控的bHLH 转录因子。 如Xu 等[61]发现 Cd 处理会诱导大豆根部bHLH 转录因子 GmORG3 表达上调, 过表达GmORG3可以提高植物的Cd 耐性,其作用机制可能是由于植物对Fe 的吸收转运增强,从而限制了Cd 向地上部分的转运。 刘晓庆等[62]则从大豆根系中筛选得到了响应Cd 胁迫的GmbHLH041基因。实验发现,GmbHLH041基因在 Cd 胁迫24 h 后表达量显著提高,说明该基因在大豆Cd 胁迫应答中可能发挥着重要作用。
2.2 microRNA 调控
microRNA(miRNA)是一类长度约20 ~24个核苷酸、内源性、非编码RNA 分子,可通过与靶序列互补结合,降解靶mRNA、抑制翻译、DNA 甲基化,在转录和转录后水平调控靶基因的表达,是植物生长发育及应答非生物胁迫过程中的重要调控因子[63]。 近年来,人们利用微阵列芯片技术和高通量测序技术在不同植物中检测出大量Cd 胁迫应答相关的miRNA。 如Ding 等[64]采用微阵列芯片技术在水稻中识别出19个Cd 胁迫应答相关miRNA,其中 miR528 表达上调,其余 18个表达下调。Tang 等[65]则通过高通量测序技术从水稻中鉴定出163个Cd 胁迫差异表达miRNA,并且根部与地上部展示出不同的基因表达变化。 最近,Jian 等[66]采用高通量测序技术对甘蓝型油菜中Cd 胁迫应答的miRNA 进行全基因组分析,共鉴定出39个差异表达miRNA,包括8个已知的和31个新的miRNA,并推测miRNA 可能通过调控转录因子表达、生物胁迫防御、离子稳态及次生代谢物的合成以响应Cd 胁迫。
目前,关于植物miRNA 对Cd 胁迫的响应机制研究也在逐步开展,已有许多响应Cd 胁迫的miRNA 及其对应靶基因的研究报道(图2)。 Cd 胁迫相关miRNA 的靶基因多为调节性基因,包括调控下游基因表达的转录因子和参与信号转导的蛋白激酶等。 miR166 的靶基因为同源异形域-亮氨酸拉链(HD-ZIP)转录因子。 Ding 等[67]发现 Cd 胁迫下水稻根系中 miR166 表达受到显著抑制,而过表达miR166 则可以降低Cd 向地上部的转运,减少籽粒中Cd 积累。 进一步实验发现,miR166 可能通过负调控其靶基因OsHB4(一种HD-ZIP 转录因子)的表达,进而调节OsHMA2和OsHMA3等Cd 耐性基因的表达,影响水稻中 Cd 的吸收、转运和解毒。miR390 的靶基因则为富含亮氨酸的类受体蛋白激酶(RLK)[68]。 水稻过表达 miR390 可以显著抑制miR390 靶基因OsSPK(一种RLK)的表达,但OsSPK与Cd 转运蛋白之间的调控关系有待进一步验证。此外,miRNA 对Cd 胁迫的响应还涉及抗氧化防御方面。 如miR398 靶基因是可清除活性氧(ROS)的CSD,Cd 胁迫下miR398 在小麦叶中表达下调会导致CSD 活性提高,增强植株的Cd 耐性[69]。
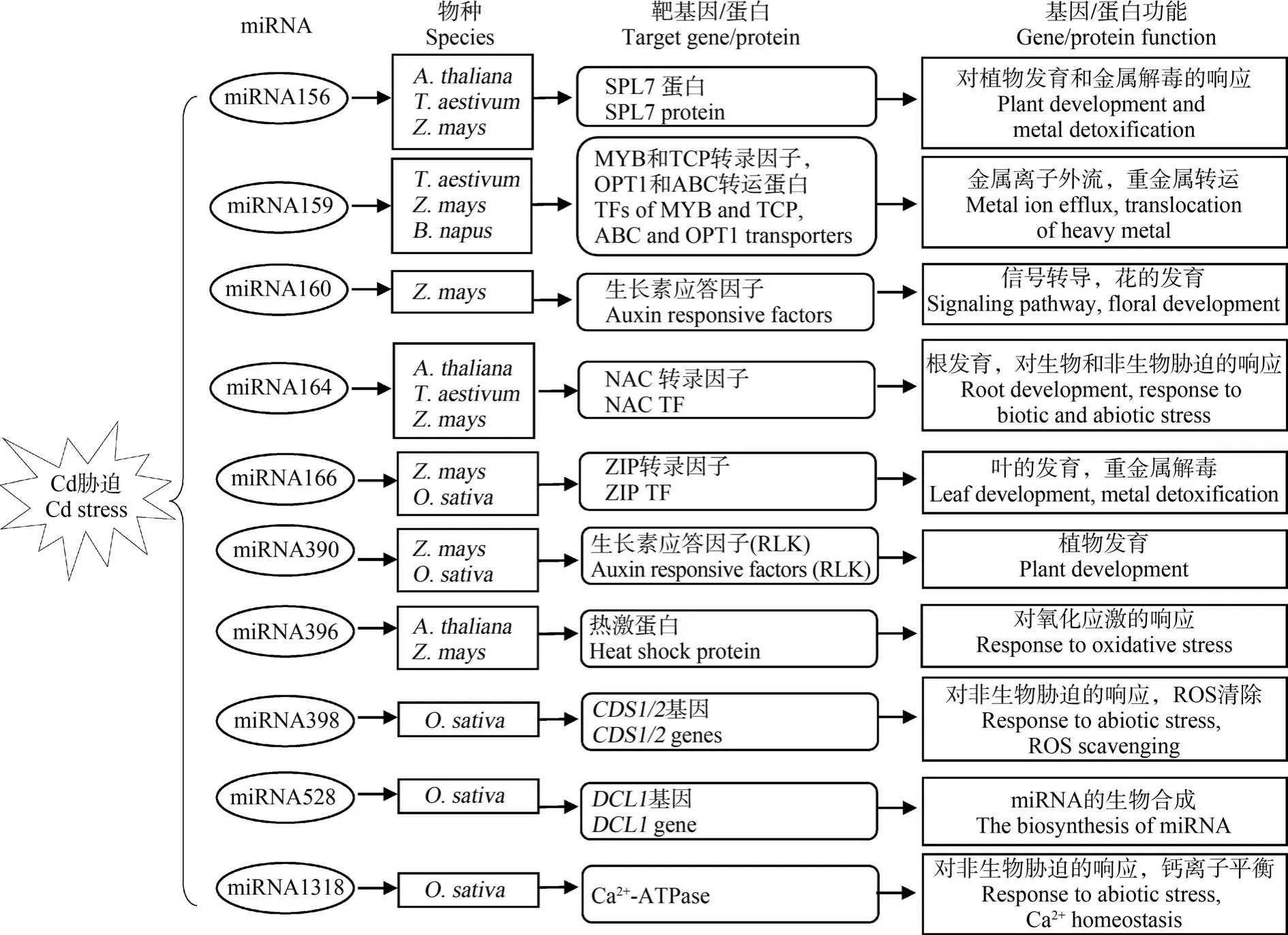
图2 响应Cd 胁迫的miRNA 及其靶基因[63,70-71]注:A. thaliana 为拟南芥,T. aestivum 为小麦,Z. mays 为玉米,B. napus 为甘蓝型油菜,O. sativa 为水稻;ROS 表示活性氧。Fig.2 miRNAs and their target genes in response to Cd stress[63,70-71]Note: A. thaliana is Arabidopsis thaliana; T. aestivum is Triticum aestivum; Z. mays is Zea mays; B. napus is Brassica napus;O. sativa is Oryza sativa; ROS stands for reactive oxygen species.
目前,关于植物对重金属Cd 的耐性机制研究不断深入。 通常,Cd 离子进入植物细胞后会影响其正常的代谢活动。 植物感受到Cd 离子的胁迫后,能够通过信号传导途径激活体内抗氧化酶及相关金属转运蛋白的表达,从而避免或缓解Cd 离子对细胞的毒害作用。 在转录及转录后水平上,植物的镉耐性涉及一系列复杂的调控网络,在今后的研究中有待进一步探索和挖掘。
3 总结与展望(Summary and prospect)
Cd 污染是一个严重的环境问题。 土壤中的Cd进入植物细胞后不仅影响植物的生长发育与代谢过程,还会经过食物链传递危害人体健康。 因此,Cd在植物体内的吸收和转运一直是研究的热点。 目前,研究者对于土壤中的Cd 经植物根系吸收,并向地上部分转运过程已经有了较好了解,尤其是Cd 转运蛋白功能研究取得了一定进展。 同时,随着在生理生化水平上对植物Cd 解毒机制认识的深入,其背后的分子调控机制也在逐渐得以揭示,已发现多个参与调控植物Cd 耐性基因表达的转录因子及miRNA。 但植物对Cd 的吸收、转运是一个十分复杂的过程,关于植物Cd 耐性的具体分子调控机制仍有待进一步探索。 如解析Cd 转运蛋白的晶体结构是理解这些转运蛋白的分子作用机制的关键;探究Cd 胁迫下不同转运蛋白之间的相互关系及协调作用有助于明确这些转运蛋白的功能调控;挖掘响应Cd 胁迫转录因子和miRNA 的靶基因将成为阐明Cd 耐性基因表达调控分子机理的主要研究内容。 此外,植物遭受Cd 胁迫时,细胞内存在一系列信号传递,今后的研究还应关注这些信号因子对基因表达的影响,以及不同信号通路之间的对话,从而进一步明确植物响应Cd 胁迫的调控网络。
