B族维生素对枯草芽孢杆菌发酵生产腺苷的影响
2022-06-22孙鹏杰余子辰徐庆阳
孙鹏杰,余子辰,徐庆阳
(天津科技大学 生物工程学院,天津 300450)
腺苷属于嘌呤型核苷,又称腺嘌呤核苷,其分子质量为267.23,分子式为C10H13N5O[1];可以间接参与能量的转移、信号转导,此外还能合成药物中间体,也能直接作为药物作用于机体。腺苷的生产方法主要有化学合成法、核糖核酸(ribose nucleic acid,RNA)水解法和发酵法[2-3];发酵法生产腺苷成本较低,原料易得,产腺苷效率较高,因此在腺苷生产中占据绝对优势[4]。日本早在20世纪70年代就开始了腺苷发酵生产工艺技术的研究,并不断取得技术上的突破,迄今已进入大规模工业生产阶。腺苷作为药物,也首先由日本于1989年投入美国市场,随后又在法国、比利时、英国等多个国家获得批准[5]。我国腺苷发酵生产起步较晚,目前主要利用化学法和酶法进行生产,但污染较大、成本较高,只有几家公司可以利用直接发酵法进行腺苷的发酵生产。与国外相比,目前我国腺苷的发酵生产水平低,腺苷产量和转化率都处在一个较低的水平[6]。
在利用发酵法生产腺苷中,培养基作为菌体生长及产物生成的全部能量来源,对发酵成功与否起着决定性的作用。苏跃稳[7]通过对部分B族维生素添加量的优化,进而提高了L-苏氨酸的产量;陈华强[8]通过优化柠檬酸钠与次黄嘌呤的添加量进而使腺苷产量提高了39.46%。因此对现有培养基成分的分析以及其中关键物质的作用机理进行探索是提高发酵效率的又一关键途径。现有的腺苷发酵培养基存在产量较低、糖苷转化率较低等问题,B族维生素作为菌体生长过程中关键的生长因子,是生物体内多种酶的辅酶,并且还是氢载体的合成前体[9-10],适量的外源添加能极大地增强酶的活力,加快菌体生长,提高菌活力,还能一定程度的改善代谢流的流向,进而促进产量的增长。因此本实验选用B族维生素作为优化目标,以达到改善现有培养基问题的目标。
本研究以枯草芽孢杆菌(Bacillus subtilis)XGL为供试菌株,在原有培养基的基础上,以常用的VB1、VB3、VB5、VB7、VB12为变量进行单因素试验,并对VB1、VB3、VB5、VB7、VB12在腺苷生产中的功能及作用机理进行了探究,之后通过正交试验对B族维生素的添加量进行优化,以腺苷产量、菌体量和糖苷转化率为指标,最终确定了B族维生素的最佳添加配比。在此复合添加量的情况下,菌体量、腺苷产量和糖苷转化率都得到了较高的提升,对其他核苷类生产菌株的B族维生素添加量提供了一定的参考,对培养基的改良提供了一定的依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
枯草芽孢杆菌(Bacillus subtilis)XGL(此菌株是经紫外诱变筛选得到的,是组氨酸和黄嘌呤缺陷型菌株):天津科技大学代谢工程研究室保藏。
1.1.2 试剂
蛋白胨、酵母粉(均为生化试剂):英国Thermo Fisher Oxoid公司;MnSO4·H2O(分析纯):天津市化学试剂六厂;MgSO4·7H2O(分析纯):天津市耀华化工厂;FeSO4·7H2O、葡萄糖(均为分析纯):天津化学试剂三厂;KH2PO4·3H2O(分析纯):天津塘沽化学试剂厂;黄嘌呤、组氨酸(均为分析纯):北京索莱宝科技有限公司;VB1、VB3、VB5、VB7、VB12(≥98%):国药集团化学试剂有限公司。
1.1.3 培养基
斜面培养基:参考文献[3]。
种子培养基:葡萄糖25 g/L、豆浓20 mL/L、蛋白胨8 g/L、酵母粉5 g/L、玉米干粉25 g/L(121 ℃、30 min单独灭菌)、KH2PO41.5g/L、MgSO4·7 H2O 0.4 g/L、VB11 mg/L、VH 1 mg/L、黄嘌呤0.1 g/L、组氨酸0.05 g/L。
初始发酵培养基:葡萄糖100 g/L、味精12 g/L、酵母粉1 g/L、蛋白胨0.3 g/L、K2HPO4·3H2O 0.6 g/L、CaCl20.2 g/L、MgSO4·7H2O 0.5 g/L、MnSO4·H2O 10 mg/L、(NH4)2SO41 g/L、微量元素混合溶液[11]2%(V/V)。灭菌条件均为121℃,20min。
1.2 仪器与设备
SBA-40E生物传感分析仪:山东省科学院生物研究所;752紫外分光光度计:上海精密科学仪器有限公司;5 L自动控制发酵罐:上海保兴生物设备工程有限公司;Agilent 1200高效液相色谱仪、Agilent C18高效液相色谱柱(5 μm,250 mm×4.6 mm):美国Agilent Technologies;CT88A全自动立式蒸汽灭菌器:驰通仪器(上海)有限公司。
1.3 方法
1.3.1 菌株培养方法
摇瓶培养:将菌种从甘油管中取两环接种至斜面培养基中活化培养12 h,接两环活化好的菌种至种子培养基中,培养12~14 h,之后接入2 mL至发酵培养基中;发酵条件[3]:pH维持在6.7,温度维持在34 ℃,200 r/min培养46 h(期间用苯酚红显色剂显示瓶内pH变化,用手动补加氨水的方法维持瓶内pH)。
5L发酵罐培养:按20%的接种量将种子液接种至发酵培养基中进行发酵培养,发酵初期pH维持在6.7~7.0,发酵中后期pH维持在6.4~6.7,温度维持在34 ℃左右,溶氧维持在30%~50%之间。培养过程中通过流加80%葡萄糖溶液维持发酵46 h(发酵过程中每2 h取一次样,发酵过程中通过利用蠕动泵流加氨水的方法来维持pH)。
1.3.2 试验方法
(1)VB1、VB3、VB5、VB7、VB12添加量优化单因素试验
在培养基其他成分不变的情况下(VB1、VB3、VB5、VB12的原始添加量为5mg/L,VB7的原始添加量为2mg/L),分别控制VB1、VB3、VB5、VB12的添加量为0、2 mg/L、4 mg/L、6 mg/L、8 mg/L进行培养基组成优化单因素发酵试验;VB7的添加量分别控制为0、1 mg/L、2 mg/L、3 mg/L、4 mg/L进行培养基组成优化的单因素试验,以探究不同B族维生素对腺苷产量、转化率、OD600nm值的影响。
(2)VB1、VB3、VB5、VB7、VB12添加量优化正交试验
在单因素试验的基础上,设置L16(45)的正交试验设计,以探究VB1、VB3、VB5、VB7、VB12的最佳添加量及试验组合,正交试验因素与水平见表1。
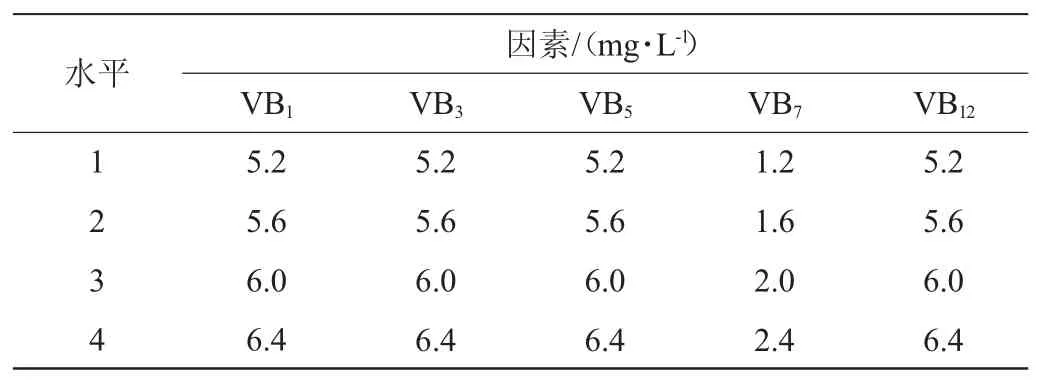
表1 B族维生素添加量优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for vitamin B addition optimization
1.3.3 指标检测方法
发酵过程中pH、溶氧、温度检测方法:发酵过程中的pH、溶氧、温度通过发酵罐的智能检测系统实时检测,并通过pH试纸进行pH的辅助检测,进而进行手动调控,已实现更为精准的发酵过程控制;摇瓶通过苯酚红显色剂进行pH监测,并通过手动补充氨水进行调节。
菌体量测定方法:发酵过程中每2 h取一次样,取样稀释一定倍数之后,在波长600 nm处测定吸光度值。
发酵过程中残糖含量测定[11]:取发酵液1mL,13000r/min离心2 min,将上清稀释一定倍数后,利用SBA生物传感仪测定发酵液中糖含量。
腺苷产量测定:用100 mL容量瓶加入适当去离子水,然后加入1 mL发酵液,最后加入NaOH(1 mol/L)2 mL,之后定容、13 000 r/min离心过膜。高效液相色谱测定条件[12-13]:柱温30 ℃,检测波长259 nm,流动相总流量0.8 mL/min,流动相为10%的乙腈,色谱柱采用Kromasil C18柱(250 mm×4.6 mm,5 μm)[3]。
1.3.4 糖苷转化率的计算
糖苷转化率的计算公式如下:
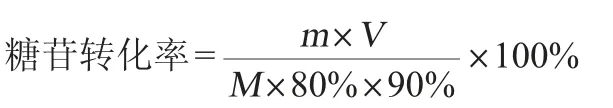
式中:m为腺苷质量浓度,g/L;V为发酵液体积,L;M为添加糖的总量,g。
1.3.5 数据处理
文中图表均使用Origin9.5软件绘制,正交试验与数据均使用Minitab 19.0 statistical software软件设计、处理。
2 结果与分析
2.1 单因素试验
2.1.1 VB1添加量优化
由图1可知,腺苷产量和糖苷转化率受VB1的影响较大,在不外源添加VB1的情况下腺苷产量仅有17.48 g/L,但随着VB1添加量的增多,腺苷产量和糖苷转化率有明显的增长,并且添加量为6 mg/L时腺苷产量和糖苷转化率分别达到了21.86 g/L、22.31%,较不外源添加VB1分别提高了25.05%和8.46%,较原始培养基分别提高了13.73%和20.7%,但随着VB1添加量增长至8 mg/L时,腺苷产量和转化率都出现了下降的情况;VB1也会对菌体生物量造成一定的影响,在不添加VB1时OD600nm值仅有30.9,但当添加量为2 mg/L时,OD600nm值增长至36.2,较不添加增长了17.15%,之后随着添加量的增多,菌体生物量变化较小。VB1又称硫胺素,是氨基酸和碳水化合物代谢途径中必不可少的辅助因子[14-15],是很多关键酶的辅酶,若添加量过多会造成这些酶的活性被极大地加强,从而造成更多的代谢流流入三羧酸循环,造成磷酸戊糖途径代谢流的减弱,造成腺苷产量和转化率的下降[16],因此当VB1添加量>6 mg/L时,腺苷产量和转化率出现了下降的现象。故选择VB1的最佳添加量为6 mg/L。

图1 不同VB1添加量对腺苷产量、糖苷转化率和菌体生物量的影响Fig.1 Effect of different VB1 addition on adenosine yield,glycoside conversion rate and bacterial biomass
2.1.2 VB3添加量优化
由图2可知,随着VB3添加量的增长,腺苷产量和转化率均有一定的增长,并在6 mg/L处产量和转化率分别达到了22.1 g/L、22.79%,较不添加分别提高了20.23%和4.16%,较原始培养基分别增长了14.9%和23.3%,但随着添加量的再一次增加,腺苷产量和转化率均出现了明显的下降趋势;VB3对菌体的生长具有一定的促进作用,在外源添加0~2 mg/L时,菌体生物量增长明显,之后随着添加量的增长,菌体生物量趋于稳定;VB3作为辅酶Ⅰ和辅酶Ⅱ的重要组成部分,在细胞生命活动中参与细胞内的氧化过程、起着氢传递的作用,同时他还具有维持细胞的渗透压、促进细胞氧化呼吸的作用[17-18],对菌体的生长具有一定的促进作用,当添加2 mg/L的VB3时菌体生物量出现了较强的增长,但腺苷产量和转化率出现了下降,可能是此时菌体的代谢更多的用在了菌体生长,因此造成产量和转化率出现了一定的下滑;VB3还参与蛋白质氨基酸和嘌呤的代谢,对腺苷的产量具有极大促进作用,同时烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)、还原型辅酶烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH)是线粒体三羧酸循环中三种限速酶的共同因子,并且NADH是电子传递链的主要电子供体[19-20],VB3的添加量过多会也导致菌体的代谢流流向三羧酸循环,从而造成产量的转化率的下降。故选择VB3的最佳添加量为6 mg/L。

图2 不同VB3添加量对腺苷产量、糖苷转化率和菌体生物量的影响Fig.2 Effect of different VB3 addition on adenosine production,glycoside conversion rate and bacterial biomass
2.1.3 VB5添加量优化
由图3可知,VB5的添加量对腺苷的产量有着较为明显的影响,在一定的范围内,随着VB5添加量的增加,腺苷产量增长明显,并且在添加量为6 mg/L时产量和转化率达到了最高,分别为20.82 g/L、22.39%,较不添加VB5分别提高了20.21%、22.82%,且较原始培养基的产量和转化率分别增长了8.3%、21.1%,当VB5添加量增长至8 mg/L时,产量和转化率都出现了下降的情况;同样,在不添加VB5时OD600nm值仅有32.2,当外源添加2 mg/L的VB5时,OD600nm值增长到了34.3,如果再增加添加量,菌体生物量会稳定增长,不再有较强的波动。分析可知,VB5是NAD、NADH2和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)、NADPH2的生物合成原料,是生物氧化过称中的最重要的氢载体,还可作为氢受体和氢供体,起着传递氢的作用,此外,还能参与糖代谢以及部分氨基酸的代谢[21],对菌体生长具有一定的促进作用;由于VB3和VB5的功能主要与NAD、NADH等的生成有关,在对腺苷产量的影响上基本类似。故选择VB5的最佳添加量为6 mg/L。
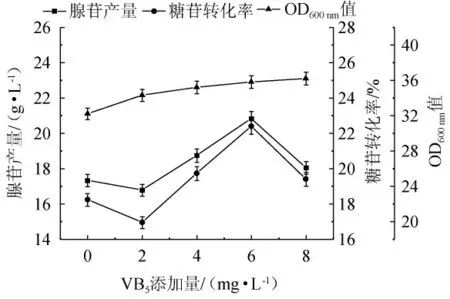
图3 不同VB5添加量对腺苷产量、糖苷转化率和菌体生物量的影响Fig.3 Effect of different VB5 addition on adenosine yield,glycoside conversion rate and bacterial biomass
2.1.4 VB7添加量优化
由图4可知,在不添加VB7的情况下,腺苷产量和转化率仅有14.32 g/L、15.56%,但是在添加一定量的VB7时,腺苷的产量和转化率会有显著的提高,在外源添加2 mg/L的VB7时,腺苷产量和转化率分别达到了19.23 g/L、20.01%,产量和转化率较不添加VB7分别提高了34.29%、28.60%,当添加量再次提高时,产量和转化率都会出现下降的趋势;OD600nm值会随着VB7添加量的增长有一定的增长,在添加4 mg/L的VB7时,OD600nm值达到了38.9,为本批实验的最高,较不外源添加VB7增长了11.46%。

图4 不同VB7添加量对腺苷产量、糖苷转化率和菌体生物量的影响Fig.4 Effect of different VB7 addition on adenosine yield,glycoside conversion rate and bacterial biomass
分析可知,由于VB7是细菌细胞内关键的辅助因子,是菌体内多种酶的辅酶[22],尤其是乙酰辅酶A羧化酶、丙酮酸羧化酶等关键酶的辅酶,并且它还参与菌体细胞膜的生成、CO2的固定等,当其添加量增加时,乙酰辅酶A的活性得到增强,三羧酸循环也因此得到了加强,进而促进菌体的生长;但添加量过多会造成三羧酸循环被极大地加强,进而导致腺苷的产量和转化率出现下降的情况,所以当VB7添加量达到>2 mg/L时,菌体生物量依旧增长,但腺苷产量和糖苷转化率却下降了。故选择VB7的最佳添加量为2 mg/L。
2.1.5 VB12添加量优化
由图5可知,VB12对腺苷的产量有着极大的促进作用,在不外源添加VB12的情况下仅有17.33 g/L的产量,但随着VB12添加量的增长,腺苷产量有着一定程度的增长,在6mg/L的添加量下腺苷产量达到了21.92 g/L,较不添加VB12增长了26.49%,如果再增加添加量,则会出现产量下降的情况;同时,转化率会随着VB12添加量的增长持续增长,在0~6 mg/L的VB12梯度添加条件下,转化率从18.44%持续增长到了21.63%;VB12对菌体生物量影响较大,在不外源添加VB12时菌体生物量仅有34.2,随着添加量的增多,OD600nm值会出现稳步提升,在6 mg/L时达到了40.6,为本批实验的最高,较不外源添加增长了18.71%。
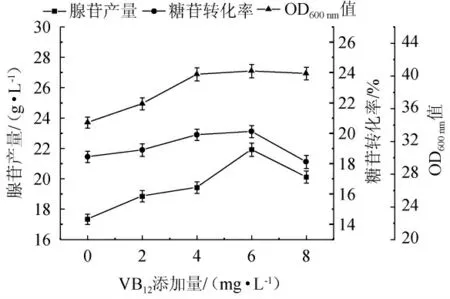
图5 不同VB12添加量对腺苷产量、糖苷转化率和菌体生物量的影响Fig.5 Effect of different VB12 addition on adenosine yield,glycoside conversion rate and bacterial biomass
分析可知,VB12是代谢酶不可或缺的辅助因子[23],VB12在细菌细胞内主要以辅酶的形式参与一碳单位的转移,并且能参与细胞脱氧核糖核酸(deoxyribonucleic acid,DNA)的合成、碳水化合物的代谢以及细胞生物质的合成,在添加一定量的VB12后菌体量得到了明显的提升,腺苷的产量也随之上升,此外VB12分子中还含有Co2+,在VB12添加量过高时,甲基丙二酰CoA异构酶活性被极大地提高,三羧酸循环被加强,相应的,磷酸戊糖途径被减弱,从而造成腺苷产量下降[24-25]。故选取VB12最佳添加量为6 mg/L。
2.2 B族维生素添加量优化正交试验
在单因素试验的基础上,以腺苷产量、菌体生物量和糖苷转化率作为考察指标,根据表1的试验方案设置L16(45)的正交试验,试验结果及分析见表2,方差分析结果见表3。

表2 B族维生素添加量优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for vitamin B addition optimization
由表2可知,影响发酵过程中腺苷产量大小的5个因素依次为D>B>A>E>C,最佳添加量组合为A3B2C3D4E3,即VB16 mg/L、VB35.6 mg/L、VB56 mg/L、VB72.4 mg/L、VB126 mg/L;影响糖苷转化率大小的5个因素依次为D>B>C>E>A,最佳添加量组合为A2B4C1D4E3,即VB15.6 mg/L,VB36.4 mg/L,VB55.2 mg/L,VB72.4 mg/L,VB126 mg/L;影响菌体生物量(OD600nm值)大小的5个因素依次为E>A>D>B=C,最佳添加量组合为A3B2C3D3E4,即VB16 mg/L,VB35.6 mg/L,VB56 mg/L,VB72 mg/L,VB126.4 mg/L。
由表3可知,VB7对腺苷产量和糖苷转化率影响最显著(P<0.05),VB12对发酵过程中的菌体生物量影响最显著(P<0.05)。

表3 正交试验结果方差分析Table 3 Analysis of variance of orthogonal experiments results
综上所述,同时腺苷产量和糖苷转化率达到本组试验的较高水平,而且需要满足一定菌体量的情况下,因此选择最佳添加组合A3B1C3D4E2,即VB16 mg/L,VB35.2 mg/L,VB56.0 mg/L,VB72.4 mg/L,VB125.6 mg/L。此时腺苷产量为23.11 g/L,糖苷转化率为32.55%,菌体生物量为40.2。
2.3 5 L发酵罐验证试验
在正交试验中选出对腺苷产量和转化率影响最显著的试验组,在培养基其他成分不变和发酵条件不变的情况下,改变其VB1、VB3、VB5、VB7、VB12的添加量分别为6 mg/L、5.2 mg/L、6 mg/L、2.4 mg/L、5.6 mg/L,进行5 L发酵罐发酵放大试验,进一步探究其发酵特性(腺苷产量从10 h起开始测量),结果见图6和图7。

图6 优化培养基与原始培养基在5 L发酵罐中的发酵结果对比Fig.6 Comparison of fermentation results between optimized culture medium and original culture medium in 5 L fermenter

图7 枯草芽孢杆菌在优化培养基5 L发酵罐中的腺苷产量、糖苷转化率以及菌体生物量Fig.7 The adenosine production,glycoside conversion rate and bacterial biomass of Bacillus subtilis in 5 L fermenter under the optimized medium
由图6、图7可知,改变其培养基中的维生素B族生长因子的添加量,对腺苷的产量、糖苷转化率以及OD600nm值都有不同程度的提升。在整体发酵过程中,优化后的培养基菌体生长速率较原始培养基菌体生长速率增加较大,在前10 h更为明显,并且在46 h时OD600nm值达到了74.84,较原始培养基提高了8%;并且对腺苷产量由一定的提升,在35 h之前,腺苷产量增加趋势较为明显,并且在发酵46 h时产量达到了53.66 g/L,较原始培养基增长了19.35%;同时转化率也得到了一定提升,达到30.10%,较原培养基提高了12.59%。
3 结论
在单因素试验的基础上,通过正交试验得出最有益于菌体产苷的VB1、VB3、VB5、VB7、VB12的添加量,即VB16 mg/L、VB35.2 mg/L、VB56 mg/L、VB76.4 mg/L、VB125.6 mg/L。最后通过5 L发酵罐与原培养基作对比实验,对比发现优化后的培养基菌体生物量、腺苷产量、糖苷转化率分别为74.84、53.66 g/L,30.10%,比优化前分别提高了8%、19.35%、12.59%。本研究所得的腺苷发酵培养基与原培养基相比产量、转化率和菌体生物量有了不同程度的提升,另外培养基是否可以通过外源添加某种氨基酸或微量元素来进一步提高菌体活力、提高发酵效率,有待于更多的研究探索。
