动物双岐杆菌乳亚种HCS04-002小鼠体内功能性研究
2022-06-14闵祥博汤纯矫艳平余萍赵迪
闵祥博,汤纯,矫艳平,余萍,赵迪
江西仁仁健康产业有限公司(樟树 331200)
乳糖(lactose)是雌性哺乳动物特有的一种二糖,仅存在于乳汁中;乳糖无法被人体吸收,在肠道内被一种消化酶——乳糖酶消化分解成能被人体吸收的葡萄糖和半乳糖[1]。
乳糖酶(lactase)又称β-半乳糖苷酶(β-galac-tosidase),是位于人体小肠绒毛的一种消化酶[2],乳糖酶是由小肠黏膜表面绒毛的顶端处分泌,在所有双糖酶中成熟最晚、含量最低,最易受损,修复又最慢[3];该酶可催化分解乳糖,同时乳糖酶还具有半乳糖苷的转移作用。
乳糖不耐受症(lactose intolerance,LI)是指与乳糖不完全消化相关的胃肠道症状,即由于小肠上皮细胞乳糖酶(也称β-半乳糖苷酶)缺乏,乳制品中的乳糖不能被分解吸收,从而进入结肠,被肠道细菌分解后,产生大量短链脂肪酸和氢气,造成渗透压升高,使肠腔内的水分增多,引起腹痛、胀气和腹泻等消化不良症状,称为乳糖不耐受症[4]。
乳糖不耐受症的机制尚不清楚,除了乳糖酶缺乏,还包括乳糖消化量、胃肠道传送、直肠动力异常、性别、年龄等因素[5]。除表现为乳糖不耐症之外,还存在乳糖代谢不良但不表现出症状的人群,通常称为乳糖吸收不良(lactose malabsorption,LM),即二糖消化不良,进而导致乳糖不耐受。乳糖不耐症与乳糖吸收不良合称为乳糖酶缺乏(lactase deficiency,LD)。乳糖酶缺乏是一种广泛存在的世界性问题,影响全世界近2/3的人口,亚洲患病率高达95%,LD对人类的健康造成很大的威胁[6]。既往研究显示[7-8],含乳糖饮食可以有效提高钙质吸收,相反地,无乳糖饮食会降低钙质吸收率。乳糖不耐受,特别是无乳糖饮食可能会导致骨盐沉积不充分等健康问题。乳糖不耐受症的治疗主要方式有添加乳糖酶,饮食调理,应用益生菌等。现如今关于解决乳糖不耐受问题的方法,均还有待完善。如食用低(无)乳糖制品,但无法长期满足患者营养需求[9];口服乳糖酶通常需要长期治疗且价格昂贵,且胃内pH等因素均会影响乳糖酶的功效[10];而改变基因又相对复杂且技术不成熟,仍处于试验阶段[11]。因此,应用益生菌缓解乳糖不耐受症的研究就显得尤为重要。
研究表明多种益生菌可产生乳糖酶[12-13],同时可延缓胃排空速率,减慢肠转运时间[12],改善肠道微生态平衡[14]。双歧杆菌、乳酸杆菌能酵解乳糖,在酵解乳糖时只产酸不产气,不增加渗透压,同时增加肠道短链脂肪酸的吸收,有利于减轻乳糖不耐受症状。另有研究表明,所有双歧杆菌均具有乳糖酶,且活力显著高于其他肠道菌群,因此适量补充双歧杆菌可预防和缓解乳糖不耐受病症的发生[15]。试验通过测定益生菌菌株的β-半乳糖苷酶酶活和小鼠小肠的β-半乳糖苷酶酶活,研究动物双歧杆菌乳亚种HCS04-002对缓解乳糖不耐受症的益生作用。
1 材料与方法
1.1 材料与仪器
1.1.1 试验菌株
动物双歧杆菌乳亚种(Bifidobacterium animalissubsp.Lactis)HCS04-002及其冻干菌粉、鼠李糖乳杆菌HCS01-008、罗伊氏乳杆菌HCS02-004、植物乳杆菌HCS03-012、嗜热链球菌HCS07-002、发酵乳杆菌HCS08-027、德氏乳杆菌保加利亚亚种HCS10-002、副干酪乳杆菌HCS17-044、瑞士乳杆菌HCS23-055:江西仁仁健康产业有限公司;动物双歧杆菌乳亚种(Bifidobacterium animalissubsp.lactis)HCS04-002菌株:2020年3月25日保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏号CGMCC No.19509。
1.1.2 试验动物
清洁级昆明种(KM)小鼠50只,5周龄,18~22 g,雄性。小鼠饲料为无菌块状鼠料,均由辽宁长生生物技术有限公司提供。
1.1.3 主要培养基及培养条件
乳杆菌MRS培养基配方(液/固):酵母蛋白胨1%,牛肉粉0.3%,酵母浸出物0.4%,磷酸二氢钾0.2%,柠檬酸0.2%,乙酸钠0.5%,葡萄糖2%,硫酸镁0.058%,硫酸锰0.025%,吐温-80 0.06%,番茄汁1%(V/V),琼脂2%,调至pH 6.50;115 ℃,30 min灭菌。
乳杆菌MRS-lac培养基配方(液):酵母蛋白胨1%,牛肉粉0.3%,酵母浸出物0.4%,磷酸二氢钾0.2%,柠檬酸0.2%,乙酸钠0.5%,乳糖2%,硫酸镁0.058%,硫酸锰0.025%,吐温-80 0.06%,番茄汁1%(V/V),调至pH 6.50;115 ℃,30 min灭菌。
培养条件:37 ℃,固体培养36~48 h,二级为单菌落至5 mL培养基培养20 h,三级为菌液5%接种量于100 mL培养基中培养17 h,正常培养。
双歧杆菌培养基配方(液/固):酵母蛋白胨3%,酵母浸出物2%,葡萄糖2.5%,低聚果糖0.5%,L-苹果酸0.5%,调至pH 7.20,(琼脂2%)115 ℃,30 min灭菌。
双歧杆菌MRS-lac培养基配方(液):酵母蛋白胨3%,酵母浸出物2%,乳糖2%,L-苹果酸0.5%,调至pH 7.20;115 ℃,30 min灭菌。
培养条件:39 ℃,固体厌氧培养36~48 h,二级为单菌落至5 mL培养基培养20 h,三级为菌液5%接种量于100 mL培养基中(装液量100%)培养17 h,盖锡纸培养。
1.1.4 主要试剂
邻硝基酚(ONP,分析纯AR,MACKLIN);磷酸二氢钾(KH2PO4,分析纯AR)、三水磷酸氢二钾(K2HPO4·3H2O,分析纯AR)、二水EDTA(C10H14N2Na2O8·2H2O,分析纯AR)、2-硝基苯-β-D-吡喃半乳糖苷(ONPG,生化试剂BR)、无水碳酸钠(Na2CO3,分析纯AR)(均为中国医药集团有限公司);全脂乳粉(齐齐哈尔菲格瑞斯食品有限公司)。
1.1.5 主要仪器与设备
恒温培养箱(DHP-500BS,北京市永光明医疗仪器有限公司);厌氧工作站(LAI-3DT,上海龙跃仪器设备有限公司);低温高速离心机(TGL-16M,湖南湘仪实验室仪器开发有限公司);超声波细胞粉碎机(SCIENTZ-ⅡD,宁波新芝生物科技股份有限公司);酶标仪(Multiskan FC,赛默飞世尔科技公司)。
1.2 试验方法
1.2.1β-半乳糖苷酶的测定
按照GB/T33409—2016《β-半乳糖苷酶活性检测方法分光光度法》[16]并参考文献[17-18]方法进行改进。
1.2.1.1 标准曲线的绘制
称取0.1390 g邻硝基苯酚(ONP)于小烧杯中,加10 mL 96%乙醇溶解,将溶液转移入1 L容量瓶中,加水定容摇匀。
用移液管分别从这些溶液中移取2,4,6,8,10,12和14 mL溶液至不同100 mL容量瓶中,各加入25 mL碳酸钠溶液,用缓冲液定容摇匀,制成0.02,0.04,0.06,0.08,0.10,0.12和0.14 mmol/L的ONP,用无菌水作空白。
以邻硝基苯酚的浓度为横坐标,以稀释液的吸光度ΔA420nm为纵坐标做标准曲线,得出回归方程。
1.2.1.2β-半乳糖苷酶活力的测定试验(ONPG法)
将培养17 h后的发酵液15 mL于10000 r/min 4 ℃离心5 min。收集菌泥,用等体积的0.05 mol/L磷酸盐缓冲液(pH 6.80)洗涤2次。将菌体重悬于3 mL上述磷酸盐缓冲液中,进行超声破碎。破碎条件:超声功率200 W、工作时间/间隔时间1 s/9 s、60次、4 ℃。10 000 r/min 4 ℃离心20 min取上清液,即得粗酶液。将粗酶液进行适当稀释,取粗酶液200 μL于30 ℃下水浴预热5 min,加入同样在30 ℃预热5 min的ONPG溶液1 mL,摇匀,在30 ℃下水浴10 min,立即加入400 μL碳酸钠溶液来终止反应。30 min内于420 nm处测定OD值。
反应缓冲液的配制:称取8.8 g磷酸二氢钾(KH2PO4)、8.0 g三水磷酸氢二钾(K2HPO4·3H2O)、0.25 g七水硫酸镁(MgSO4·7H2O)和18.6 mg二水EDTA(C10H14N2Na2O8·2H2O)溶解于900 mL水中,转入1000 mL容量瓶中,用水定容并摇匀,缓冲液的pH应在6.50±0.05之间。
ONPG底物溶液的配制:将250.0 mg邻硝基苯-β-D-半乳糖苷(o-nitrophenyl-β-D-galactopyranoside,ONPG)溶解在约80 mL反应缓冲液中,接着转移到100 mL的容量瓶中,用反应缓冲液定容,摇匀,最早在用前2 h制备。
碳酸钠溶液的配制:将50 g碳酸钠(Na2CO3)和37.2 g二水EDTA溶解在约900 mL水中,定容至1000 mL。
空白样的制备:将添加ONPG底物和碳酸钠溶液的顺序颠倒,其余步骤与样品处理方式相同。
1.2.1.3 试验结果计算方法
1个酶活力单位(E)定义为:在30 ℃每分钟水解释放1 μmoL ONP所需的酶量。按式(1)计算酶活E(U/mL)。

式中:E为发酵液中酶活力,U/mL;f为测定酶液的稀释倍数;V为反应体系总体积,1.6 mL;K为标准曲线斜率,3.162 5;t为反应时间,10 min;V1为酶液体积,0.2 mL。A420nm为在420 nm波长处的吸光度。
1.2.2 小鼠小肠乳糖酶测定试验
1.2.2.1 小鼠分组灌胃
将4周龄的雄性KM小鼠(20.0±2.0 g)饲养于鼠笼中,保持温度25±0.5 ℃,相对湿度50%±5%,并执行12 h/12 h的灯光/黑暗循环。所有小鼠给予相同量的基本膳食,并提供足够的饮用水,适应性喂养1周后开始试验。小鼠随机分为5组:对照组、模型组、低剂量组、中剂量组、高剂量组,分别经口灌胃纯水、12%全脂乳粉溶液、12%全脂乳粉和益生菌粉混合溶液(详见表3),益生菌菌粉灌胃剂量分别为1,2和4 g/kg体重(即每100 mL 12%全脂乳粉溶液中分别添加10,20和40 g益生菌菌粉),灌胃体积为10 mL/kg,灌胃量根据灌胃前每只小鼠的体重调节。每天上午灌胃1次,在灌胃28 d的24 h后,处死小鼠进行后续分析,每组小鼠10只[19]。每日记录小鼠的体重,观察其摄食量和饮水量是否正常,精神状态、活跃程度和皮毛光泽是否发生异常[20]。

表1 各试验组与对照组设置
1.2.2.2 小鼠小肠乳糖酶的测定
摘取KM小鼠小肠测定其乳糖酶活性。具体操作为:处死小鼠,立即取其胃幽门以下小肠肠段作为待测标本,用移液管取预冷的0.85%冷生理盐水,其体积总量应是小肠重量的9倍,用超声波细胞粉碎机(SCIENTZ-ⅡD)于冰浴中低速匀浆1 min,匀浆时间10 s/次,间隙30 s,连续6次,在冰(水)中进行,然后低温以3 000 r/min离心10 min取上清液。将上清液进行适当稀释,取上清稀释液200 μL于30 ℃下水浴预热5 min,加入同样在30 ℃预热5 min的ONPG溶液1 mL,摇匀,在30 ℃下水浴10 min,立即加入400 μL碳酸钠溶液来终止反应。30 min内于420 nm处测定吸光度。
2 结果与分析
2.1 菌株β-半乳糖苷酶活性测定
对自有9株乳酸菌菌株进行β-半乳糖苷酶酶活测定,测定结果详见表2。动物双岐杆菌乳亚种HCS04-002的β-半乳糖苷酶酶活最高,酶活为0.758 U/mL。有研究表明双歧杆菌可以产生乳糖酶[21-22],试验表明动物双岐杆菌乳亚种HCS04-002可明显产β-半乳糖苷酶。因此,选用动物双歧杆菌乳亚种HCS04-002进行后续的小鼠试验。

表2 各菌株β-半乳糖苷酶酶活数据
2.2 小鼠小肠β-半乳糖苷酶活性测定
乳糖酶是动物体内消化分解乳糖的主要酶源。由图1可知,全脂乳粉和益生菌的加入,使小鼠小肠内容物β-半乳糖苷酶的活性高于对照组,且具有统计学差异(p<0.05),可见动物双歧杆乳亚种HCS04-002可促进小肠中β-半乳糖苷酶的恢复和增加。动物双歧杆菌乳亚种HCS04-002低剂量组试验小鼠小肠的β-半乳糖苷酶活性高于对照组的,但与模型组相比无显著差异;中剂量组和高剂量组试验小鼠小肠的β-半乳糖苷酶活性明显高于对照组和模型组,说明在此剂量下HCS04-002对乳糖不耐受有一定调节能力。
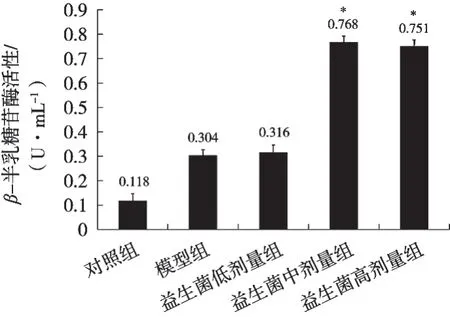
图1 各组别小鼠小肠β-半乳糖苷酶活性
3 结论
试验结果表明,动物双岐杆菌乳亚种HCS04-002可以产生β-半乳糖苷酶且酶活较高;经28 d的动物双歧杆乳亚种HCS04-002处理后,剂量达到2 g/kg时,小鼠小肠的β-半乳糖苷酶活性明显升高,说明动物双歧杆乳亚种HCS04-002表现出有一定的缓解乳糖不耐受的功能。试验发现,2 g/kg剂量组和4 g/kg剂量组之间没有表现出明显的酶活量效关系,这可能与该株菌缓解乳糖不耐受机理或者给样时间较短有关。试验仅对给样后KM小鼠小肠的β-半乳糖苷酶酶活进行测定,后续可增加测定小鼠脏器指数、血清和肝脏指标、小肠指标等,还可以考虑通过16SrRNA测序,分析小鼠结肠内容物的微生物菌群的多样性和丰度的变化等[23-24],以期更全面地了解动物双歧杆乳亚种HCS04-002缓解乳糖不耐受症的机理,为进一步开发和应用提供数据支持。
