甘蓝黑腐病致病菌分离与种质资源抗性鉴定
2022-06-12许园园邢苗苗严继勇宋立晓卢昱宇曾爱松
许园园 邢苗苗 严继勇 宋立晓 卢昱宇 曾爱松


摘要:黑腐病是影响甘蓝生产的主要病害之一,为了更好地研究该致病菌的致病机制,本研究在全国各地发病田间采集具有典型症状的病害样本,对病原菌进行分离、纯化,并对其形态特征、理化特性和致病性进行分析,同时测定了来源不同的该菌株基因序列,分析其同源性并构建了系统发育树;以Xcc8004为接种菌,采用喷雾法对11份甘蓝种质资源进行黑腐病苗期人工接种抗性鉴定。结果表明:不同来源的黑腐病菌DNA序列存在碱基差异,系统发育分析结果显示相近地区黑腐病菌聚为一类,亲缘关系较近;致病力测试初步表明长江中下游地区收集到的黑腐病菌致病力较强;供试材料均未表现免疫和高抗反应,不同材料的抗病性有明显差异,其中筛选到抗病材料3份,耐病材料3份,感病材料3份,高感材料2份。建立一套有效的黑腐病生理小种划分鉴定方法并筛选高抗黑腐病材料是今后黑腐病抗病育种的重要工作。
关键词:甘蓝;黑腐病;致病菌;系统进化;抗性鉴定;病菌分离鉴定
中图分类号:S436.35 文献标志码: A
文章编号:1002-1302(2022)10-0098-06
结球甘蓝(Brassica oleracea L. var. capitata)简称甘蓝,为十字花科芸薹属甘蓝种的一个变种,在世界各地广泛栽培,我国每年种植面积约90万hm2,占世界甘蓝类蔬菜收获面积的1/3以上,在蔬菜周年供应和出口创汇中发挥重要作用[1-2]。
甘蓝黑腐病是威胁甘蓝生产的主要病害,是由野油菜黄单胞菌野油菜致病变种(Xanthomonas campestris pv. campestris)引起的一种毁灭性细菌病害[3],该菌主要通过水孔、气孔、伤口以及根部等多种方式侵染寄主植物,病原菌侵入植株后快速进入维管束,在寄主细胞壁迅速增殖,合成大量的多糖、黄原胶堵塞木质部导管,限制了导管中的水分流动,导致“V”字形病斑,随后,子叶感病时脱绿萎蔫,而后迅速枯死,真叶感病则出现小黑点,沿维管束蔓延、扩展,病斑不断扩大,叶脉逐渐变黑,叶肉组织最终枯黄或者坏死,在叶子中沿着叶脉形成“V”形病斑。受近年来栽培面积的逐渐增加及高密度、连作等不合理栽培方式的影响,甘蓝黑腐病的发生已蔓延至我国各地,严重时可使甘蓝减产70%,对甘蓝及其他十字花科蔬菜的品质和产量造成严重损失[4-5]。
黑腐病病原菌鉴别研究仍处于相对落后状态,目前尚未发现覆盖全部生理小种的黑腐病病原菌收集、鉴别研究体系,也没有统一的接种方法,尤其是缺乏利用分子生物学快速鉴定的技术,对生理小种分化演变以及遗传规律尚不完全清楚。黑腐病抗性遗传较为复杂,不同抗源材料可能存在不同抗性遗传机制[6]。
目前,黑腐病防治措施主要为轮作换茬、加强生产管理及喷药防护;但农业防治效果有限,化学防治又容易产生抗药性、农药残留及环境污染问题,使用抗病品种是最为经济有效的方法,优异抗黑腐病种质是发掘抗性基因的材料基础,由于免疫和高抗黑腐病甘蓝资源匮乏,使得抗黑腐病育种一直未取得有效突破[7]。因此,扩大筛选范围,快速、准确寻找高抗种质资源极为迫切。前人在甘蓝黑腐病抗源筛选研究中做了大量工作,但截至目前仅有极少数抗源被鉴定[8-9],导致生产中严重缺乏商品性优良的抗黑腐病甘蓝品种,因此,抗黑腐病甘蓝品种培育与改良是目前甘蓝生产上亟待解决的迫切问题。本研究基于收集到的危害甘蓝生产的具有典型症状的病害样本,对各病原菌进行分离、纯化,并对其形态特征、理化特性和致病性进行分析,同时对来源不同的菌株基因进行测序与序列比对,分析其同源性并进行系统发育分析;以Xcc8004为接种菌,采用喷雾法对11份国内外甘蓝种质资源进行黑腐病苗期人工接种抗性鉴定,研究结果旨在为该致病菌的准确、快速、有效鉴定,高抗品种选育以及抗性遗传规律解析和抗性基因挖掘提供基础。
1 材料与方法
1.1 试验材料
供试黑腐病菌菌株见表1,保存于营养琼脂培养基(nutrient agar medium,NAM),配方:蛋白胨 10 g/L、牛肉粉3 g/L、氯化鈉5 g/L、琼脂15 g/L,pH值7.3。
参试11份甘蓝材料均由笔者所在研究所甘蓝课题组提供,其中包含6份课题组保存的高代自交系材料和5份杂种F1代,京丰和庆丰作为抗感对照。Xcc8004为标准菌株,由西南大学友情提供。
1.2 试验方法
1.2.1 病原菌的分离纯化 收集病样时选择典型的黑腐病发病初期叶片,病叶干净无虫食,病样采集后于取样袋中带回,4 ℃存放,24 h内进行分离、纯化,纯化后的菌株保存于肉汤培养基中,-80 ℃保存,每次使用在肉汤培养基上划线以恢复细菌活性,然后回接于甘蓝叶片上使其恢复致病能力,重新分离纯化后用于接种试验。
1.2.2 病原菌的形态学鉴定 对分离的单菌落,稀释后涂布于肉汤固体培养基上,28 ℃培养72 h,对长出的菌落进行形态、色泽等方面的观察。
1.2.3 病原菌的回接鉴定 根据科赫法则,为进一步确定所得的病原菌为甘蓝黑腐病的致病菌,将病原菌稀释成1×108 CFU/mL的悬浮液,喷雾法回接到甘蓝感病品系上,以接种无菌水的甘蓝为对照,接种后24 h保持90%以上的相对湿度,14 d后观察发病情况。
1.2.4 病原菌的分子鉴定 十六烷基三甲基溴化铵(CTAB)法分别提取病原菌的基因组DNA,根据GenBank提供的植物病原菌序列设计扩增引物,经0.8%琼脂糖凝胶电泳检测,对各目的片段进行回收,Pmd18-T载体连接,感受态细胞制备,目的片段转化,挑取热激转化后的白色菌落,在LB培养基中,37 ℃培养过夜,提取质粒DNA进行PCR扩增,将转入目的片段的Escherichia coli菌液送至南京金斯瑞生物科技有限公司进行测序,将测序所得的序列NCBI在线比对,比较其同源性。0F42E0FD-5CE0-4789-8969-FED884934AB0
1.2.5 黑腐病抗性鉴定 所有参试材料均于2019年9月进行第1次人工接种鉴定试验,并于2020年9月进行重复试验,试验地点为江苏省农业科学院蔬菜研究所智能温室与六合试验基地。
采用苗期喷雾法接种,具体参考李永镐等的方法[10],稍作改动。
育苗:将所用基质高温高压灭菌,甘蓝种子在50 ℃温水中浸泡10 min,用吸水纸吸干种子表面水分;营养钵(8 cm×8 cm)在1%福尔马林溶液中浸泡24 h,用清水冲洗数次,每钵1粒,在温室内育苗,幼苗生长至4~6张真叶(约30 d)苗龄时,选择生长健壮、一致的幼苗进行接种鉴定。
接种:将黑腐病菌菌株移至肉汤培养基中,在28 ℃、200 r/min条件下摇培24 h,用适量无菌水调节浓度至1.0×108 CFU/mL(D600 nm=0.2)细菌悬浮液,备用,接种前将幼苗移入鉴定室内,浇透水并盖塑料膜保湿12~24 h(15~20 ℃),使其叶缘出现露珠,次日用喷雾器将菌液均匀喷洒到植株叶片上,以叶片无菌液滴落为止,接种后继续保湿24 h,除去薄膜后幼苗于20~25 ℃室温下培养。
病情调查和分级:每份甘蓝材料设3组重复,每组重复10株幼苗,接种后12~15 d调查发病情况,分级标准:0级:接种叶片无任何症状;1级,接种叶片水孔处有黑色枯死,无扩展;3级,接种叶片病斑从水孔向外扩展,占叶面积5%以下;5级,接种叶片病斑从水孔向外扩展,占叶面积5%~<25%;7级,接种叶片病斑从水孔向外扩展,占叶面积25%~<50%;9级,接种叶片病斑从水孔向外扩展,占叶面积50%及以上。
根据病情指数计算抗性水平:
病情指数(disease index,DI)=∑(病级指数×该病极值)调查总叶数×最高病级×100。
抗性水平划分:根据甘蓝叶片病情级别,分别计算出DI平均值,进而确定其抗性水平,划分标准参考李锡香(2008)的方法[11],并稍作改动。划分标准:高抗(HR),0≤DI≤11.11;抗病(R),11.112 结果与分析
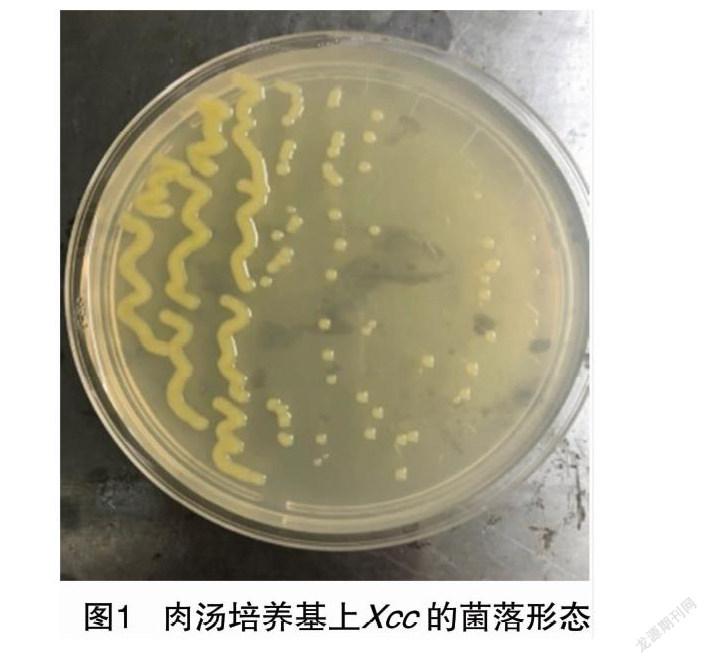
2.1 病原菌的菌落特征和形态
黑腐病病原菌菌落近圆形,边缘完整,略凸起,薄或者平滑,具光泽,有黏性(图1)。
2.2 病原菌的回接鉴定
将采集的黑腐病病样分别经分离纯化后,按照科赫法则回接到甘蓝感病系,14 d后所有接种植株的发病率为100%,叶片接种部位出现典型的“V”字形病斑,而对照无菌水接种区域(CK)没有出现病变。以上说明所分离的病原菌为甘蓝黑腐病致病菌(图2)。
2.3 病原菌的分子鉴定
提取黑腐病全基因组DNA,经0.8%琼脂糖凝胶电泳检测得到较完整的黑腐病病菌的全基因组DNA,电泳片段显示约22 kb。用细菌通用引物,对黑腐病菌16S rDNA全序列进行扩增,PCR扩增得到 1.5 kb 大小的片段,这与细菌16S rDNA序列大小吻合,该片段为目的片段。将目的片段回收,pMD18-T载体连接,感受态细胞制备,目的片段进行转化,提取质粒,PCR扩增后选取阳性克隆送置南京金斯瑞生物科技有限公司测序。将测序所得的序列进行序列比对(图3)和系统发育分析(图4),发现不同来源的黑腐病病菌DNA序列存在差异,系统发育分析结果显示相近地区黑腐病病菌聚为一类,亲缘关系较近。
2.4 黑腐病病菌致病力测试
根据图4显示的不同来源的黑腐病系统发育聚类分析结果,挑取代表性地区(北方地区Xcc-HEB;西南地区XccCD;长三角地区Xcc-HZ;西北地区Xcc-SX)的黑腐病病菌菌样进行黑腐病致病力测试,采用喷雾法,菌液浓度1.0×108 CFU/mL,材料选择耐病材料JX60,京丰作为抗病对照,实验室鉴定结果显示长三角地区的代表性菌种 Xcc-HZ 感染能力强于其他地区,而北方地区收集的黑腐病病菌Xcc-HEB致病力较弱(图5)。
2.5 甘蓝材料对黑腐病抗性鉴定
采用喷雾法对所有4~5叶期的甘蓝试验材料进行黑腐病试验,黑腐病菌浓度为1.0×108 CFU/mL,表2结果显示,对照京丰和庆丰抗性稳定,病情指数区分度大,抗病类型明显,因此所筛选的病情具有可信度,在11份甘蓝材料中,筛选到抗病材料3份,耐病材料3份,感病材料3份,高感材料2份,无高抗和免疫材料。
3 讨论与结论
甘蓝黑腐病发生严重时危害甘蓝生产,甘蓝黑腐病的防治首先是选用抗病品种,选用丰产、优质抗病的品种是最经济、有效的防病途径。甘蓝不同品种对黑腐病的抗性有很大差异,应通过抗病性鉴定筛选获得高抗品种。而由于黑腐病生理小种的分化较为复杂,Kamoun利用十字花科植物中的一些品种作为鉴别寄主将黑腐病病原菌划分为5个生理小种[12];Vicente等利用7个十字花科蔬菜品种作为鉴别寄主将黑腐病病原菌划分为6个生理小种[13];Jensen等采用rep-PCR技术将44个致病菌菌株划分为5个生理小种[14];Fargier等在Vicente鉴定得到的6个生理小种的基础上又鉴定出3个不同类型的野生类型,进而将其划分为9个不同类型的生理小种[15];Cruz等在2017年又鉴定出2个不同类型的野生油菜黄单胞菌[16]。因此目前共鉴定得到11个不同类型的黑腐病菌生理小种,说明黑腐病病原菌会存在分化现象,或者有其他存在的生理小种尚未被发现,其实很长时间以来,国际上比较常用的是Vicente等的划分标准。
鉴于黑腐病生理小种鉴定工作量大,篩选过程复杂,耗时长,因此,目前国内关于甘蓝黑腐病生理小种的分化和致病力的研究报道较少。李经略等研究了北京、哈尔滨、重庆、陕西4地的甘蓝黑腐病菌,结果表明不同生态环境形成的菌系对甘蓝苗期的致病力存在明显的分化现象,其中在陕西分离的病原菌致病力最强[17]。程伯瑛等研究了来自山西和陕西的2个菌株,结果发现这2个菌株在同一甘蓝品种上的致病力表现也存在差异[18]。本研究中,笔者所在课题组收集了1份标准菌株,以及4个地区共10份黑腐病致病菌,挑选代表菌株对其进行致病力测试,结果发现,长江中下游地区的Xcc-HZ致病力强于其他地区,而北方地区收集的黑腐病菌致病力较弱,但是由于本试验一个代表性地区仅选择了一个样本,且取样菌株数量有限,并未开展系统的生理小种鉴定研究,在今后的研究工作中,应加大对其生理小种分化的鉴定方法研究,找到一套高效、稳定的甘蓝黑腐病生理小种鉴别方法,以更好地解析我国甘蓝黑腐病菌生理小种的分布情况,结合生理小种划分对本试验结果进行进一步验证。
目前,甘蓝黑腐病抗病性的鉴定主要依赖于接种鉴定后观察发病,而外观表现是受基因控制的,所以通过分子辅助选择来检测材料是否具备抗病基因是最可靠、最直接的鉴定材料抗病性的方法,根据正向遗传学研究思路,想找到抗病基因,首先要筛选到高抗病材料,才能配置杂交组合,找到与黑腐病紧密连锁的基因,从而完善甘蓝黑腐病抗性鉴定方法,为甘蓝抗黑腐病育种提供依据。本研究筛选了笔者所在研究室保存的高代自交系和商品种共11份材料,遗憾的是并未筛选到高抗病材料,推测是由于使用的材料数量较少,后期应加大筛选数量,多年重复试验,采取实验室和田间表型鉴定相结合的方法,争取筛选到能稳定遗传的高抗黑腐病材料,为后期抗黑腐病甘蓝育种奠定研究基础。
参考文献:
[1]方智远. 我国甘蓝产销变化与育种对策[J]. 中国蔬菜,2008(1):1-2.
[2]杨丽梅,方智远,庄 木,等. “十二五”我国甘蓝遗传育种研究进展[J]. 中国蔬菜,2016(11):1-6.
[3]Afrin K S,Rahim M A,Rubel M H,et al. Development of race-specific molecular marker for Xanthomonas campestris pv. campestris race 3,the causal agent of black rot of crucifers[J]. Canadian Journal of Plant Science,2018,98(5):1119-1125.
[4]张云霞.甘蓝苗期黑腐病抗性鉴定及抗病相关机理的研究[D]. 南京:南京农业大学,2014.
[5]孔枞枞,刘 星,邢苗苗,等. 甘蓝黑腐病和枯萎病兼抗材料的鉴定筛选[J]. 中国蔬菜,2018(6):22-31.
[6]Sharma B B,Kalia P,Yadava D K,et al. Genetics and molecular mapping of black rot resistance locus Xca1bc on chromosome B-7 in Ethiopian mustard (Brassica carinata A.Braun)[J]. PLoS One,2016,11(3):e0152290.
[7]张 扬,李金萍,周慧敏,等. 李宝聚博士诊病手记(三十九) 十字花科蔬菜细菌性黑腐病的发生规律及防治[J]. 中国蔬菜,2011(17):23-25,65.
[8]Saha P,Kalia P,Sharma M,et al. New source of black rot disease resistance in Brassica oleracea and genetic analysis of resistance[J]. Euphytica,2016,207(1):35-48.
[9]Singh S,Dey S S,Bhatia R,et al. Molecular breeding for resistance to black rot[Xanthomonas campestris pv. campestris (Pammel) Dowson]in Brassicas:recent advances[J]. Euphytica,2018,214(10):1-17.
[10]李永镐,徐丽波. 甘蓝黑腐病苗期抗病性鉴定方法的研究[J]. 东北农学院学报,1990,21(2):125-129.
[11]李锡香. 萝卜种质资源描述规范和数据标准[M]. 北京:中国农业出版社,2008,82-83.
[12]Kamoun S. Incompatible interactions between crucifers and Xanthomonas campestris involve a vascular hypersensitive response:role of the hrpX locus[J]. Molecular Plant-Microbe Interactions,1992,5(1):22.
[13]Vicente J G,Taylor J D,Sharpe A G,et al. Inheritance of race-specific resistance to Xanthomonas campestris pv. campestris in Brassica genomes[J]. Phytopathology,2002,92(10):1134-1141.
[14]Jensen B D,Vicente J G,Manandhar H K,et al. Occurrence and diversity of Xanthomonas campestris pv. campestris in vegetable Brassica fields in Nepal[J]. Plant Disease,2010,94(3):298-305.
[15]Fargier E,Manceau C. Pathogenicity assays restrict the species Xanthomonas campestris into three pathovars and reveal nine races within X. campestris pv. campestris[J]. Plant Pathology,2007,56(5):805-818.
[16]Cruz J,Tenreiro R,Cruz L. Assessment of diversity of Xanthomonas campestris pathovars affecting cruciferous plants in Portugal and disclosure of two novel X.campestris pv.campestris races[J]. Journal of Plant Pathology,2017,99:403-414.
[17]李經略,赵晓明,李惠兰. 甘蓝苗期黑腐病菌致病性分化研究[J]. 陕西农业科学,1990,36(3):26-27.
[18]程伯瑛,武永慧,王翠仙,等. 惠丰甘蓝对黑腐病的抗性鉴定研究[J]. 北方园艺,2002(6):48-49.0F42E0FD-5CE0-4789-8969-FED884934AB0
