薯蓣皂苷对阿尔茨海默病模型大鼠认知功能的影响*
2022-06-10刘璐丁力方晓霞孙延鹏陈俊
刘璐,丁力,方晓霞,孙延鹏,陈俊
(湖北省十堰市太和医院·湖北医药学院附属医院神经内科,湖北 十堰 442000)
阿尔茨海默病(AD)为神经退行性疾病,是老年痴呆症最常见的一种形式,全球约有4 500万人患病[1],表现为学习、记忆功能明显损伤,无法进行日常独立活动。同时,AD患者大脑的各个区域伴随着病情的进展,会引起进行性神经元凋亡,导致脑萎缩[2]。AD的病理特征是细胞外老年斑和细胞内的神经原纤维缠结(NFT)[3],异常β-淀粉样蛋白(Aβ)聚集起源于纤维毒性物质,加速了AD微管失稳、突触功能障碍、神经炎症等发病机制,最终导致神经细胞丢失而发病[4]。神经炎症过程伴随着一系列促炎因子的表达,静脉注射β-淀粉样蛋白1-42(Aβ1-42)能显著促进小鼠脑内炎性因子的表达,并激活沉默信息调节因子1(SIRT1)介导的神经元凋亡[5]。SIRT1对慢性不可预测轻度应激模型大鼠的认知有神经保护作用,可通过抑制核因子κB(NF-κB)发挥神经保护作用[6]。薯蓣皂苷具有抗肿瘤、调节免疫、抗血小板聚集、调血脂等功效[7]。本研究中基于薯蓣皂苷的免疫调节及抗血小板聚集作用探讨了其对AD模型大鼠认知功能及SIRT1/NF-κB信号通路的影响。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:BX53型显微镜(日本奥林巴斯公司);DYCZ-25D型电泳仪(美国Thermo公司);Sartorius BSA型电子天平(德国赛多利斯公司,精度为0.001 g);伯乐Mini-PRO型荧光定量聚合酶链式反应仪(美国伯乐公司);LAS 4000型成像系统(美国GE Healthcare公司)。
试药:薯蓣皂苷对照品(南京建成生物工程研究所,批号为256294,纯度为99.99%);石杉碱甲(四川普西奥标物科技有限公司,批号为102518-79-6);Aβ1-42(上海研启生物科技有限公司,批号为30120-1543,纯度为99%);逆转录定量聚合酶链式反应(RTqPCR)试剂盒(上海优宁维生物有限公司,批号为954641);蛋白定量试剂盒(碧云天生物技术研究所,批号为954840);SIRT1蛋白抗体、NF-κB蛋白抗体、β-actin蛋白抗体(美国Abcam公司,批号分别为5573298,5579624,2011548)。
动物:SPF级12周龄SD大鼠60只,体质量200~220 g,雌雄各半,购自重庆医科大学实验动物中心,动物生产许可证号为SCXK(渝)2018-0001,动物使用许可证号为SYXK(渝)2018-0022,动物质量合格证号为00102458。试验期间所有大鼠均饲养于温度为18~25℃、相对湿度为60%~70%的清洁级动物房内,自由取食、饮水,自动控制光照/黑暗交替(12 h/12 h)。本研究获医院医学伦理委员会批准,符合动物伦理学要求。
1.2 方法
分组、建模与给药:按随机数字表法将60只SD大鼠分为正常对照组(A组,等量生理盐水),模型组(B组,等量生理盐水),石杉碱甲组(C组,0.02 mg/kg)[8],以及薯蓣皂苷低、中、高剂量组(D1组、D2组、D3组,17.5,35.0,70.0 mg/kg)[9],各10只。取Aβ1-42,溶于磷酸盐缓冲液中,配制成质量浓度为4 g/L的Aβ1-42溶液,于37℃温度下孵育36 h。除A组外,其余各组大鼠用1%戊巴比妥钠麻醉,分别在大鼠海马区前囟后3.8 mm、中线旁2.5 mm、前囟下3.0 mm各注射Aβ1-42溶液1 μL[10],以复制AD模型大鼠。建模成功后,C组、D1组、D2组、D3组大鼠分别于次日灌胃给予相应药物,A组和B组大鼠灌胃给予等量生理盐水,每日1次,持续30 d[9]。
大鼠神经功能缺损评分(MNSS):大鼠AD模型复制成功后,让另一实验外工作人员分别于给药干预前1 d和给药后30 d采用改良MNSS量表对大鼠的运动、感觉、反应和平衡能力进行评分,评分越高表示大鼠神经功能损伤越严重。0分为无损伤,1~6分为轻度损伤,7~12分为中度损伤,13~18分为重度损伤。
Morris水迷宫实验:将水池分为4个象限,大鼠随机放在1个象限内,记录大鼠找到平台所用的时间,若60 s内未找到平台,则将大鼠放在平台上10 s后离开,连续记录5 d,每天2次,平均时间为当日的最终逃逸时间。第6天,去掉平台,将大鼠放在任一象限并做好标记,记录大鼠在标记象限内的停留时间和平台区域穿越次数。
大鼠脑组织病理结构观察:实验末期,处死大鼠,取大鼠右脑半球,切取1/2,用生理盐水漂洗,置甲醛水溶液中固定48 h,取部分脑组织制作苏木精-伊红(HE)染色切片,于显微镜下观察大鼠脑组织病理结构。
总RNA提取及RT-qPCR检测:实验末期,处死大鼠,取大鼠左脑半球组织0.1 g,根据RNA提取试剂盒说明书提取大鼠脑组织中总RNA,并利用反转录试剂盒得到cDNA,保存于-80℃,备用。RT-qPCR体系为,SYBR Green qPCR SuperMix 16.25 μL,特异性引物2.0 μL,模板cDNA 3.25 μL,DEPC水补足至30 μL;反应条件为,95℃、10 min,95℃、10 s,60℃、30 s,70℃、30 s,共40个循环。设置3个复孔,按2-ΔΔCT法计算、分析mRNA表达。
大鼠脑组织SIRT1和NF-κB蛋白水平检测:新鲜分离的1/2大鼠右脑半球组织用生理盐水洗净,取0.1 g,采用放射免疫沉淀分析(RIPA)缓冲液溶解蛋白,离心(转速为13 000 r/min,离心半径为12 cm)提取蛋白上清液,使各组质量浓度为3 μg/mL,蛋白上样量为10 μL。经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,蛋白转移到硝化纤维素膜上,将膜放在5%脱脂奶粉溶液中封闭2 h,用特异性抗体SIRT1,NF-κB,β-actin于4℃条件下孵育12 h,用1%吐温-20溶液清洗3次,每次10 min;进行二抗孵育2 h,用磷酸盐缓冲液清洗3次,每次10 min,在LAS 4000型成像系统上显影。
1.3 统计学处理
采用SPSS 23.0统计学软件分析。计量资料以X±s表示,采用单因素方差分析,多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 MNSS量表评分
与A组比较,B组大鼠给药前1 d和给药后30 d的MNSS量表评分均显著升高(P<0.05);与B组比较,C组、D1组、D2组、D3组大鼠给药后30 d的MNSS量表评分均显著降低(P<0.05),且D1组、D2组、D3组间效应呈剂量依赖性(P<0.05);D3组和C组比较无显著差异(P>0.05)。详见表1。
表1 各组大鼠MNSS量表评分比较(±s,分,n=10)Tab.1 Comparison of MNSS score in each group(±s,point,n=10)
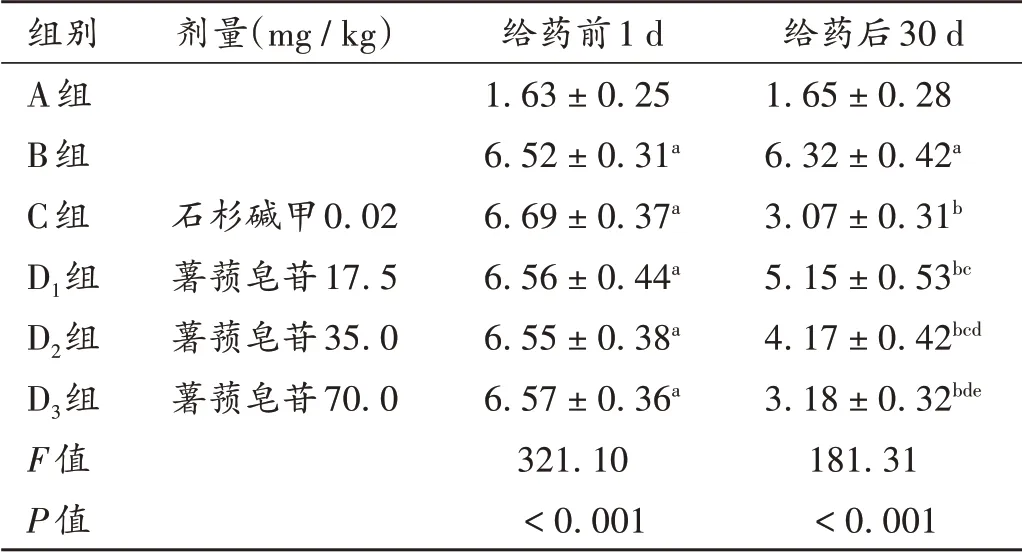
表1 各组大鼠MNSS量表评分比较(±s,分,n=10)Tab.1 Comparison of MNSS score in each group(±s,point,n=10)
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05;与D1组比较,dP<0.05;与D2组比较,eP<0.05。表2至表4同。Note:Compared with those in group A,aP<0.05;Compared with those in group B,bP<0.05;Compared with those in group C,cP<0.05;Compared with those in group D1,dP<0.05;Compared with those in group D2,eP<0.05(for Tab.1-4).
给药后30 d 1.65±0.28 6.32±0.42a 3.07±0.31b 5.15±0.53bc 4.17±0.42bcd 3.18±0.32bde 181.31<0.001组别A组B组C组D1组D2组D3组F值P值剂量(mg/kg)石杉碱甲0.02薯蓣皂苷17.5薯蓣皂苷35.0薯蓣皂苷70.0给药前1 d 1.63±0.25 6.52±0.31a 6.69±0.37a 6.56±0.44a 6.55±0.38a 6.57±0.36a 321.10<0.001
2.2 大鼠Morris水迷宫实验
与A组比较,B组大鼠逃逸时间显著延长,目标象限停留时间显著缩短,平台区域穿越次数显著减少(P<0.05);与B组比较,C组、D1组、D2组、D3组大鼠逃逸时间均显著缩短,目标象限停留时间均显著延长,平台区域穿越次数均显著增加,且D1组、D2组、D3组间效应呈剂量依赖性(P<0.05);D3组和C组比较无显著差异(P>0.05)。详见表2。
表2 各组大鼠逃逸时间、目标象限停留时间、平台区域穿越次数比较(±s,n=10)Tab.2 Comparison of escape time,residence time in the target quadrant and crossing times in the platform area in each group(±s,n=10)
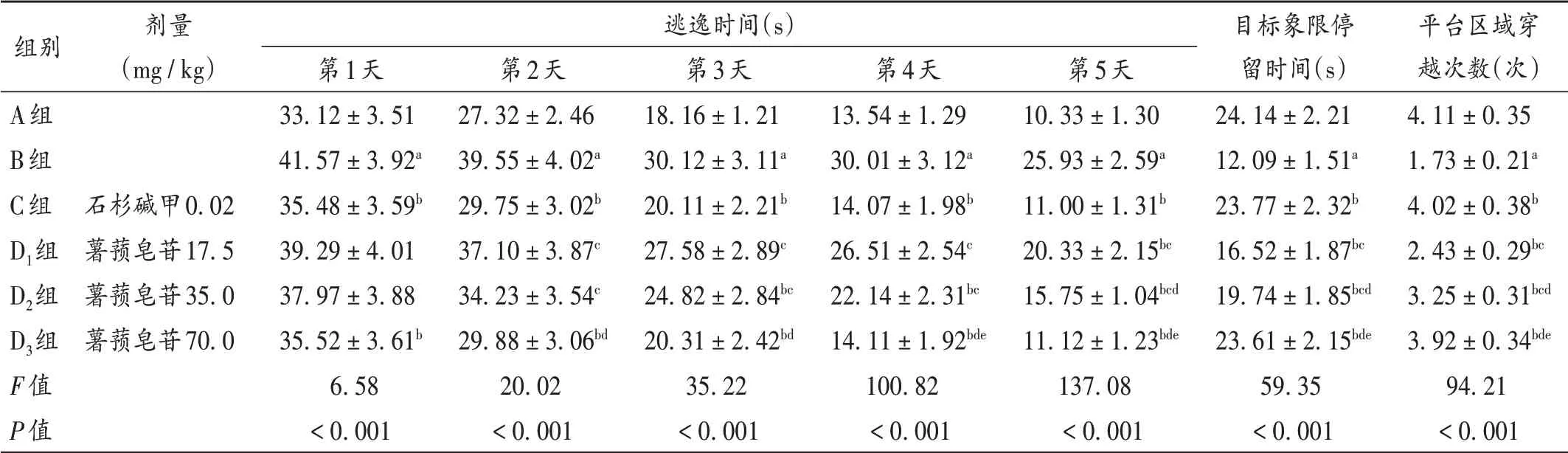
表2 各组大鼠逃逸时间、目标象限停留时间、平台区域穿越次数比较(±s,n=10)Tab.2 Comparison of escape time,residence time in the target quadrant and crossing times in the platform area in each group(±s,n=10)
组别A组B组C组D1组D2组D3组F值P值剂量(mg/kg)逃逸时间(s)石杉碱甲0.02薯蓣皂苷17.5薯蓣皂苷35.0薯蓣皂苷70.0第1天33.12±3.51 41.57±3.92a 35.48±3.59b 39.29±4.01 37.97±3.88 35.52±3.61b 6.58<0.001第2天27.32±2.46 39.55±4.02a 29.75±3.02b 37.10±3.87c 34.23±3.54c 29.88±3.06bd 20.02<0.001第3天18.16±1.21 30.12±3.11a 20.11±2.21b 27.58±2.89c 24.82±2.84bc 20.31±2.42bd 35.22<0.001第4天13.54±1.29 30.01±3.12a 14.07±1.98b 26.51±2.54c 22.14±2.31bc 14.11±1.92bde 100.82<0.001第5天10.33±1.30 25.93±2.59a 11.00±1.31b 20.33±2.15bc 15.75±1.04bcd 11.12±1.23bde 137.08<0.001目标象限停留时间(s)24.14±2.21 12.09±1.51a 23.77±2.32b 16.52±1.87bc 19.74±1.85bcd 23.61±2.15bde 59.35<0.001平台区域穿越次数(次)4.11±0.35 1.73±0.21a 4.02±0.38b 2.43±0.29bc 3.25±0.31bcd 3.92±0.34bde 94.21<0.001
2.3 大鼠脑组织病理结构
A组大鼠脑组织细胞结构完整、排列整齐,未见出血及水肿;B组大鼠细胞排列松散,部分细胞点状坏死,细胞边界不清,大量炎性细胞浸润,出血和水肿明显;C组、D1组、D2组、D3组大鼠脑组织出血减轻,水肿面积缩小,细胞点状坏死数量减少,且其效应呈剂量依赖性。详见图1。

图1 各组大鼠脑组织病理结构(HE染色,×200)Fig.1 Pathological structures of brain tissues of rats in each group(HE staining,×200)
2.4 大鼠脑组织中SIRT1与NF-κB mRNA和蛋白表达水平
与A组比较,B组大鼠脑组织SIRT1 mRNA和蛋白表达水平均显著降低,NF-κB mRNA和蛋白表达水平均显著升高(P<0.05);与B组比较,C组、D1组、D2组、D3组大鼠脑组织SIRT1 mRNA和蛋白表达水平均显著升高,NF-κB mRNA和蛋白表达水平均显著降低,且D1组、D2组、D3组间效应呈剂量依赖性(P<0.05);D3组和C组比较无显著差异(P>0.05)。详见表3、表4和图2。
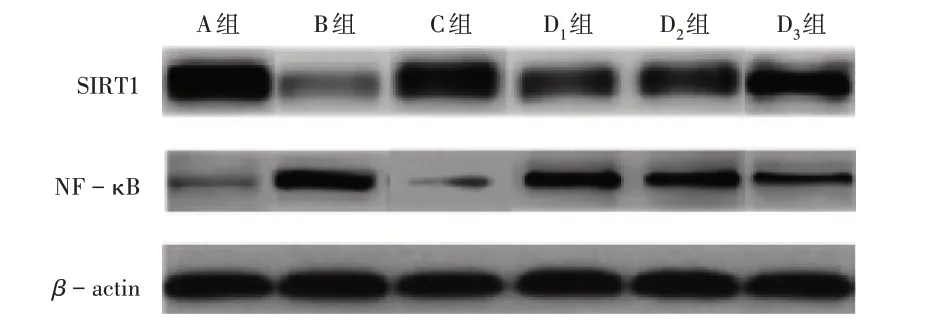
图2 各组大鼠脑组织中SIRT1和NF-κB蛋白表达电泳图Fig.2 Electropherograms of SIRT1 and NF-κB proteins in brain tissues of rats in each group
表3 各组大鼠脑组织中SIRT1和NF-κB mRNA表达水平比较(±s,n=10)Tab.3 Comparison of SIRT1 and NF-κB mRNA expression levels in brain tissues of rats in each group(±s,n=10)
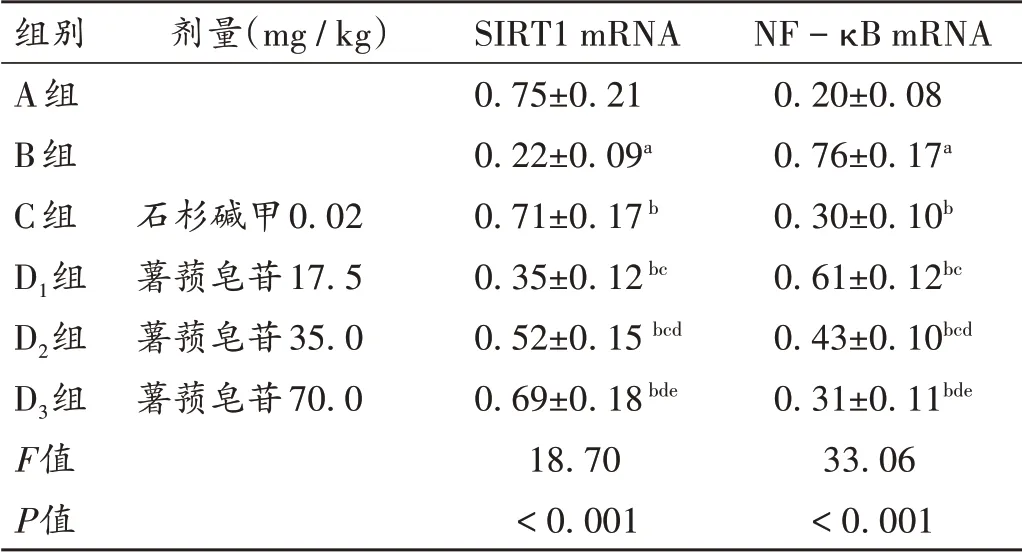
表3 各组大鼠脑组织中SIRT1和NF-κB mRNA表达水平比较(±s,n=10)Tab.3 Comparison of SIRT1 and NF-κB mRNA expression levels in brain tissues of rats in each group(±s,n=10)
组别A组B组C组D1组D2组D3组F值P值NF-κB mRNA 0.20±0.08 0.76±0.17a 0.30±0.10b 0.61±0.12bc 0.43±0.10bcd 0.31±0.11bde 33.06<0.001剂量(mg/kg)石杉碱甲0.02薯蓣皂苷17.5薯蓣皂苷35.0薯蓣皂苷70.0 SIRT1 mRNA 0.75±0.21 0.22±0.09a 0.71±0.17b 0.35±0.12bc 0.52±0.15 bcd 0.69±0.18bde 18.70<0.001
表4 各组大鼠脑组织中SIRT1和NF-κB蛋白表达水平比较(±s,n=10)Tab.4 Comparison of SIRT1 and NF-κB proteins expression levels in brain tissues of rats in each group(±s,n=10)
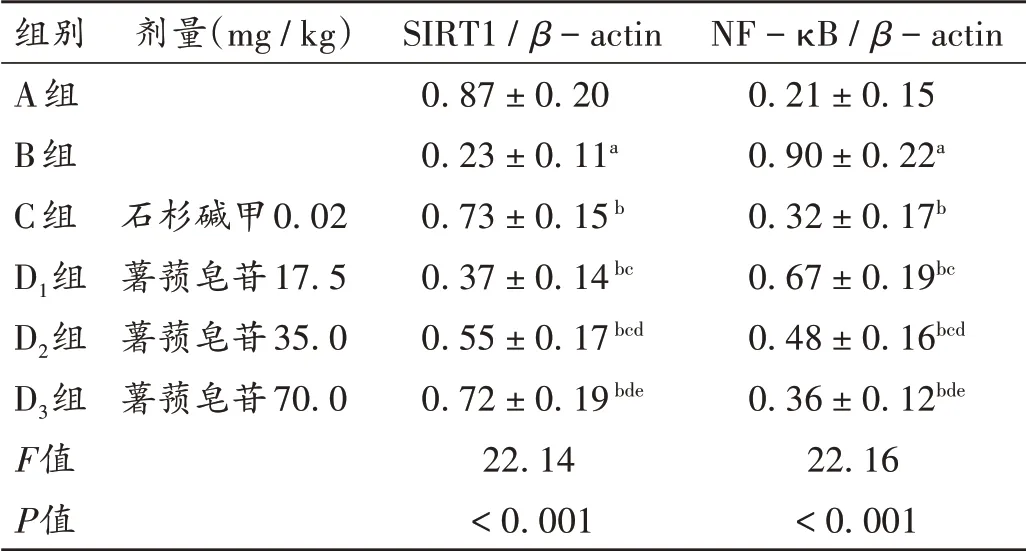
表4 各组大鼠脑组织中SIRT1和NF-κB蛋白表达水平比较(±s,n=10)Tab.4 Comparison of SIRT1 and NF-κB proteins expression levels in brain tissues of rats in each group(±s,n=10)
组别A组B组C组D1组D2组D3组F值P值剂量(mg/kg)石杉碱甲0.02薯蓣皂苷17.5薯蓣皂苷35.0薯蓣皂苷70.0 SIRT1/β-actin 0.87±0.20 0.23±0.11a 0.73±0.15b 0.37±0.14bc 0.55±0.17bcd 0.72±0.19bde 22.14<0.001 NF-κB/β-actin 0.21±0.15 0.90±0.22a 0.32±0.17b 0.67±0.19bc 0.48±0.16bcd 0.36±0.12bde 22.16<0.001
3 讨论
认知功能障碍是人体学习记忆和思维判断出现不同程度的异常现象,可引起严重的学习和记忆障碍,病情严重时可能导致失语、失用等[11]。人类大脑功能的正常运行是认知功能正常的基础,当大脑功能的结构受到其他因素影响而导致其发生异常改变时,可引起机体发生认知功能障碍[12]。认知功能障碍诊断极为困难,大脑结构复杂,人体认知功能由多种结构构成,一个或几个方面产生的异常均可能引起认知功能障碍[13]。本研究结果发现,在复制AD模型大鼠后,大鼠MNSS量表评分均显著升高,同时大鼠的学习能力和记忆能力均显著降低,表明大鼠神经功能受损;经薯蓣皂苷干预后,大鼠MNSS量表评分均显著降低,学习能力和记忆能力均显著提高,且呈剂量效应关系,进一步提示了薯蓣皂苷具有神经保护作用,对AD模型大鼠具有一定的治疗效果。
为了解薯蓣皂苷改善AD模型大鼠认知功能障碍的具体作用机制,本研究中初步探讨了薯蓣皂苷对SIRT1/NF-κB信号通路的影响。SIRT1是AD中维持细胞免疫平衡的关键翻译因子[14],可参与神经调节,并在神经疾病中发挥神经保护作用[15]。激活SIRT1表达可增强海马神经功能,从而逆转不同神经系统疾病所引起的认知缺陷[16]。黄酮类化合物可进一步促进SIRT1的转运,并在AD模型大鼠中提供神经保护[17]。薯蓣皂苷也是一种生物活性黄酮类化合物,在体内外具有较强的免疫调节作用,与SIRT1/NF-κB通路的激活有关[18]。当AD模型大鼠出现认知功能障碍时,SIRT1表达受到抑制,SIRT1 mRNA和蛋白均呈现低表达,而NF-κB mRNA和蛋白均呈现高表达,高表达的NF-κB可引起机体炎性反应进一步加重,从而使大鼠认的知功能发生障碍[19]。本研究中,经薯蓣皂苷干预后,大鼠SIRT1 mRNA和蛋白表达水平均升高,而NF-κB mRNA和蛋白表达水平均降低,其原因可能是薯蓣皂苷可刺激机体SIRT1的表达,从而靶向抑制NF-κB的表达,延缓机体炎性反应的发生,起到改善大鼠认知功能的作用。
本研究存在以下局限性,认知功能的影响是多因素共同作用的结果,可能还有其他信号通路的参与,后续将探讨更多作用机制;由于薯蓣皂苷是一种多靶点药物,具有抗氧化、抗炎等多种神经保护作用,而本研究中薯蓣皂苷的神经保护作用是否与其抗氧化或其他性质有关尚未讨论,后续将进一步研究。
综上所述,薯蓣皂苷可有效改善AD模型大鼠的认知功能障碍,其机制可能为通过促进机体SIRT1表达和靶向抑制NF-κB表达,从而逆转机体免疫平衡紊乱。
